清水紫花苜蓿育性变异材料鉴定分析与生理研究
李自立,师尚礼,阿芸,张辉辉,李小龙
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
紫花苜蓿(Medicago sativa)杂交制种在商业化生产中,采用化学、人工去雄的方式,费时、费力,雄性不育系的发现能够从根本上解决上述问题[1]。雄性不育是指植物在有性繁殖过程中受遗传基础和外界因素的影响,不能产生正常的花药、花粉或雄配子的现象,此外,雄性不育在高等植物中广泛存在,利用其进行杂交制种工作,不仅提高了杂交种的产量又保证了子代杂种优势的表型[2-3]。
植物的花蕾在发育过程中需要经一系列形态和生理生化等方面的变化,这些变化可能直接或间接地影响育性,如绒毡层细胞的异常发育,就有可能导致花粉粒败育,形成雄性不育[1-2]。有关学者对雄性不育和可育的生理生化过程研究发现,雄性不育系在能量代谢、物质代谢等方面与保持系有明显的差异[4-5],雄性不育系花药的可溶性蛋白、脯氨酸、过氧化物酶、超氧化物歧化酶、过氧化氢酶等生理生化指标与其保持系存在差异[6-8]。雄性不育系可溶性糖含量低于保持系,罗茜等[9]和李玉青等[10]认为可溶性糖的缺乏是因合成受阻所致,可能与绒毡层的异常发育有关;脯氨酸是花药中氨基酸的主要存储形式,能转化成其他种类的氨基酸[11],其含量的变化能够体现植物体的发育程度,而且在枸杞(Lycium chinense)[11]和葱(Allium fistulosum)[12]等植物中雄性不育株脯氨酸的含量显著低于正常植株;桑世飞[13]对油菜(Brassica napus)的研究中发现活性氧在植物生命活动中发挥着极其重要的作用,因为氧代谢过程的改变会损伤植物膜结构从而影响其正常的代谢平衡,并且活性氧的增加会致使丙二醛含量激增。
清水紫花苜蓿作为新发现的一类根茎型紫花苜蓿种质,于2010年驯化为栽培品种,其品种登记号为412[14]。该种质主要生长在甘肃省清水县和定西半阴湿山脚地带,其根颈部较长,易形成根茎混杂区,根茎距地表相对较深,没有主根,全部为水平或斜生的根茎根;茎一般为平卧或半平卧生长,比直根型和根蘖型的茎纤细矮小,其耐旱、耐寒、耐践踏,是优质的放牧型和水土保持草种,但由于其产量相对较低,存在着巨大的改良空间[15]。近年来,在清水紫花苜蓿群体中发现了开花多、结籽率低的育性变异植株,使培育不育系利用杂交优势技术改良清水紫花苜蓿产量成为可能。然而清水紫花苜蓿的研究主要聚焦在细胞学水平[16]、抗逆生理水平[17-18]和分子水平[19]上,而对育性方面的研究鲜有报道。因此,本研究通过对清水紫花苜蓿育性变异株进行花粉活力染色鉴定和相关生理分析,为形成清水紫花苜蓿不育系及杂交育种提供物质基础和理论参考。
1 材料与方法
1.1 试验区概况
试验布设在甘肃省兰州市安宁区甘肃农业大学牧草试验站,地处黄土高原西端(105°41′E,34°05′N),海拔1525 m,属温带半干旱大陆性气候,光照充足,气候干燥,昼夜温差大,年日照时数2600 h,无霜期171 d,年均温10.3℃,年平均降水量300 mm左右,区内地势平坦,肥力均匀,为黄绵土。灌溉采用滴灌方式。
1.2 试验材料
供试材料为清水紫花苜蓿育性变异株系GN-A1、GN-A2、GN-A3、GN-A4、GN-A5、GN-A6和育性正常株系,均由甘肃农业大学教育部草业生态系统重点实验室提供。
1.3 试验设计
2016年5月中旬,从甘肃农业大学会宁牧草试验基地清水紫花苜蓿群体中发现了植株花蕾数多而结籽率低的6株育性变异的清水紫花苜蓿植株(分别标记为GN-A1、GN-A2、GN-A3、GN-A4、GN-A5和GN-A6),挖取单株分株栽培繁殖,移栽于甘肃农业大学兰州牧草试验站形成株系进行观察,株系小区总面积16.79 m2(长7.3 m、宽2.3 m),2020年10月-2021年9月进行试验。
2020年8月10日,在6个株系中随机选取花药未开裂花蕾,使用I2-KI溶液对所选取的试验材料进行染色活力鉴定,以正常育性清水苜蓿为对照(CK),根据花蕾的形态特征采集不同时期花蕾,结合镜检结果将其划分为Ⅰ期(现蕾期24 h)、Ⅱ期(现蕾期40 h)、Ⅲ期(现蕾期60 h)、Ⅳ期(现蕾期68 h)、Ⅴ期(现蕾期84 h)5个发育阶段。采收后于-80℃下贮藏20 d后测定。本试验采用孙寰等[3]的育性划分标准(表1)。试验重复3次,取其平均值,以平均值±标准误表示。
1.4 测定指标及方法
1.4.1花粉活力测定 每一单株选取未开裂花药小花各5朵,随机取少数花粉粒于载玻片上混合,滴加1~2滴I2-KI溶液,盖上玻片。然后置于低倍显微镜下观察,选取3个视野,将花粉活力平均值作为花粉粒的活力值。凡被染成蓝黑色或蓝色的表明花粉活力强,不能被染色的则表现为黄褐色或黄色,证明其为活力低的花粉或不育花粉。参照王学奎[20]的方法进行活力测定。
1.4.2生理指标测定 游离脯氨酸(free proline,Pro)含量采用酸性茚三酮比色法测定[1]、可溶性糖(soluble sugar,SS)、淀粉(starch,Sta)含量采用蒽酮比色法测定[21]、可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝G-250染色法测定[20]、丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸法测定[22]、超氧化物歧化酶活性(superoxide dismutase,SOD)采 用 硝 基 四 氮 唑 蓝(nitroblue tetrazolium,NBT)法[20]测 定、过 氧 化 物 酶(peroxidase,POD)活性采用愈创木酚法[21]测定、过氧化氢酶(catalase,CAT)活性采用紫外吸收法[22]测定。
1.5 数据处理
采用SPSS 20.0以及Excel 2010进行统计分析及数据处理,采用Adobe Photoshop CC 2019对图片进行处理。变异系数(coefficient of variation,C.V)=标准偏差/平均值×100%。
2 结果与分析
2.1 花粉粒育性鉴定
供试材料花粉粒染色情况见图1,可育株(CK)的花粉粒数量较多且被染成深色或黑色的高达98.37%,其中95%以上的花粉粒呈圆球形,花粉粒饱满,表明花粉活力极高。GN-A1、GN-A2、GN-A3和GN-A6的(表2)花粉粒数量少、大小不一、基本未染色且花粉粒多呈椭圆形或畸形、花粉粒干瘪并显现出黄色或淡黄褐色,败育率分别为98.99%、97.93%、98.81%和97.97%,据育性划分标准,GN-A1、GN-A2、GN-A3、GN-A6初步鉴定其为不育株。GN-A4、GN-A5的花粉粒仅有个别被染成深色或蓝黑色,败育率分别为45.20%、36.40%,个别花粉粒呈不规则形状,所以,GN-A4属于典型半不育株,而GN-A5为半不育株。

表2 供试材料花粉粒染色率和败育率Table 2 Pollen grain staining rate and sterility rate of fertile and sterile plants
2.2 不育株和可育株花蕾营养物质含量的发育时期动态变化
2.2.1可溶性糖和可溶性蛋白含量的发育时期动态变化 不育株SS含量整体呈先降后升趋势,在第Ⅴ时期达到最高(16.62 mg·g-1),第Ⅱ时期为最低,且第Ⅴ时期较第Ⅱ时期高出了132.95%(图2);可育株呈降低-升高-降低趋势,第Ⅳ时期值最大(17.63 mg·g-1),第Ⅱ时期最低(7.60 mg·g-1),且第Ⅳ时期较第Ⅱ时期高出了131.97%。与可育株相比,不育株变化幅度较小,在第Ⅰ时期不育株SS含量较可育株显著增加了37.40%,而第Ⅳ时期不育株(12.39 mg·g-1)较可育株显著降低了29.72%;在其他时期,二者间差异不显著(P>0.05)。
可育株和不育株SP含量整体均呈缓慢下降趋势,随时间推移,不育株和可育株均以第Ⅰ时期为最高点(35.24和44.07 mg·g-1),第Ⅴ时 期 为 最 低 点(19.82和19.35 mg·g-1),且 不 育 株 最 大 值 较 最 小 值 增 加 了77.80%。不育株在第Ⅲ~Ⅳ时期急剧下降,而可育株在第Ⅰ~Ⅱ时期下降幅度最大。第Ⅰ时期不育株(35.24 mg·g-1)显著低于可育株(44.07 mg·g-1),较可育株降低了20.04%(P<0.05);其他时期两者间差异不显著(图2)。
2.2.2淀粉和游离脯氨酸含量的发育时期动态变化 不育株花蕾淀粉含量的时期动态变化为先下降后上升趋势(图3),以第Ⅱ时期为拐点,且为最小值(1.02 mg·g-1),而在第Ⅴ时期达到最大值(1.45 mg·g-1)。可育株淀粉含量整体呈平缓上升趋势;不育株最高值低于可育株最低值,其中,第Ⅱ时期不育株显著低出可育株43.33%(P<0.05),第Ⅲ~Ⅴ时期,分别极显著低出可育株28.29%、34.19%、34.35%(P<0.01)。
不育株游离脯氨酸含量动态变化为先下降后上升,以第Ⅰ时期为最大值(573.55 μg·g-1FW),第Ⅳ时期为最小值(268.75 μg·g-1FW),且第Ⅰ时期较第Ⅳ时期高出了113.41%;可育株亦呈先下降后上升趋势,但第Ⅲ时期为最小值(258.08 μg·g-1FW)。第Ⅲ时期,不育株Pro含量显著高出可育株38.73%(P<0.05),而其他时期两者间差异不显著。
2.3 不育株和可育株花蕾膜脂过氧化指标的发育时期动态变化
2.3.1过氧化氢酶和过氧化物酶活性的发育时期动态变化 不育株CAT活性呈先急剧下降后缓慢上升趋势(图4),以第Ⅱ时期为最小值(12.72 mg·g-1·min-1FW),第Ⅰ时期达到最大值(21.39 mg·g-1·min-1FW),而可育株呈缓慢上升趋势。在第Ⅰ~Ⅴ发育时期,第Ⅰ时期不育株极显著高出可育株65.35%(P<0.01);第Ⅱ时期不育株较可育株显著增加了4.35%;第Ⅳ时期不育株显著低出可育株10.32%(P<0.05)。
不育株POD活性变化趋势为倒N字型,以第Ⅲ、Ⅳ时期为拐点,在第Ⅰ时期达到最高点,而第Ⅴ时期为最低点,且高出了76.18%;反观可育株,整体为先下降后平缓的变化趋势,其中,在第Ⅰ~Ⅱ时期变化幅度较明显。在同一时期不同处理间相比,在第Ⅰ、Ⅴ时期不育株分别显著高出可育株31.57%、24.61%(P<0.05),在第Ⅱ、Ⅳ时期不育株分别极显著高出可育株25.78%、89.12%(P<0.01)。
2.3.2丙二醛含量和超氧化物歧化酶活性的发育时期动态变化 随着发育时期的变化,不育株和可育株的SOD活性整体呈下降趋势(图5),除第Ⅴ时期,其他时期不育株均极显著高于可育株(P<0.01),且分别高出了39.66%、61.67%、63.90%、71.88%;二者均在第Ⅰ时期活性达到最高,分别是306.31、219.32 U·g-1FW。此外,不育株和可育株的第Ⅰ与Ⅴ时期分别相差2.06、1.65倍。不育株花蕾SOD活性在第Ⅰ~Ⅲ时期和Ⅲ~Ⅴ时期下降至最低点,可育株下降趋势与不育株相近。
不育株和可育株MDA含量的变化趋势基本相近,均呈M型趋势,在第Ⅲ时期达到最低,分别为156.78、150.66 nmol·g-1FW,而在第Ⅱ时期均达到了最高点,分别为185.88和216.68 nmol·g-1FW。第Ⅰ、Ⅱ、Ⅳ时期不育株MDA含量分别显著低出可育株14.22%、14.22%和12.02%。
2.4 变异分析
由表3可知,不育株第Ⅰ~Ⅴ发育时期,MDA含量的变异幅度较小,其变异系数为1.42%~4.53%,而SS、SP含量和CAT、POD、SOD活性的变异幅度较大,变异系数分别为6.17%~13.32%、1.21%~11.37%、1.30%~8.70%、2.02%~6.04%和2.04%~6.16%,说明在不育株花蕾发育时期MDA含量变异较稳定,而CAT、POD、SOD活性和SS、SP含量变异较丰富;反观可育株,Pro含量、SOD、CAT和POD活性在第Ⅰ~Ⅴ发育时期其变异幅度较小,而SS、Sta含量变异幅度较大,说明SS、Sta含量在可育株和不育株花蕾的发育时期均不稳定。
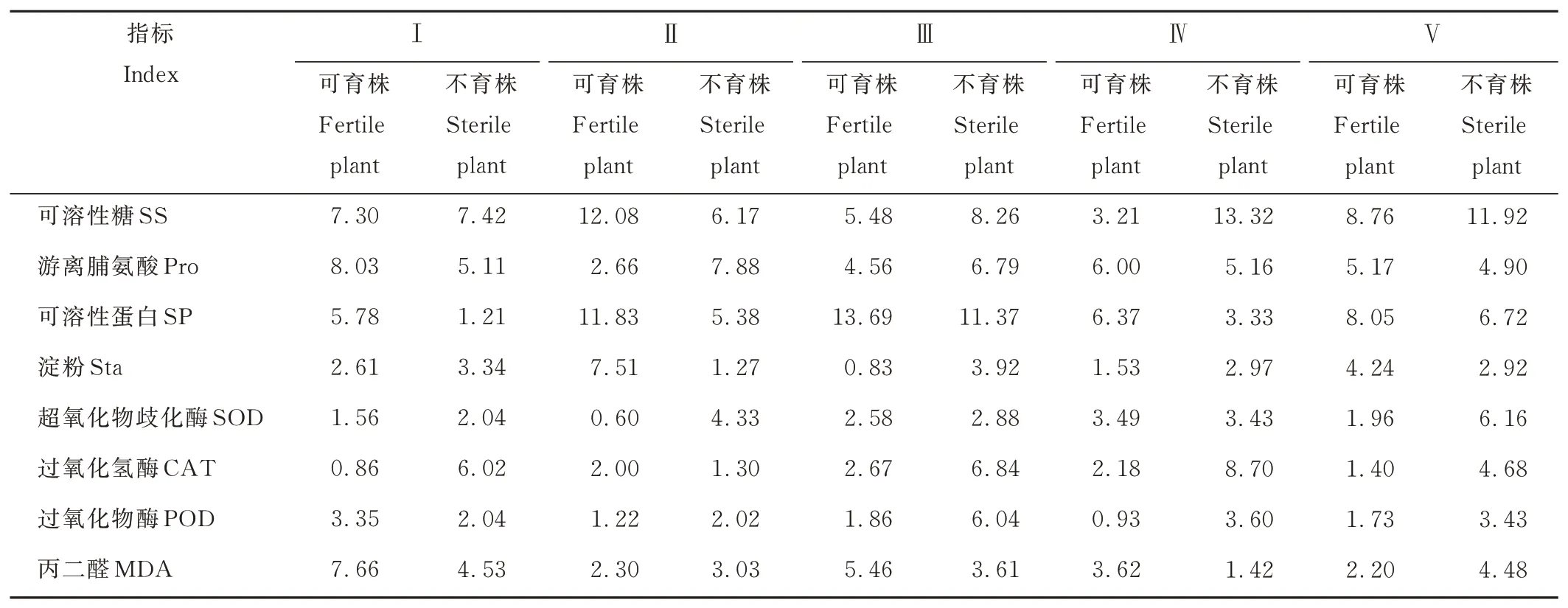
表3 不育株与可育株变异系数分析Table 3 Analysis of variation coefficient of sterile and fertile plants(%)
3 讨论
植物正常花粉能够积累较多淀粉,I2-KI溶液可将其染成蓝色或深色,而不育花粉往往积累较少或不含淀粉[2]。根据淀粉遇碘变蓝的特性,可从花粉粒内部染色的比率或颜色深浅来判定花粉粒中的淀粉含量,从而确定花粉育性[23]。刘海英等[24]通过对小麦(Triticum aestivum)花粉粒染色可知,不育花粉染色结果为非正常深褐色或黄色,花粉粒呈不规则状,而可育花粉粒为深色且饱满。本研究清水苜蓿不育株GN-A1、GN-A2、GN-A3、GN-A6花粉染色多呈黄色或淡黄褐色,且表现为椭圆形或畸形、花粉粒干瘪、形状不一,染色率均低于5%;可育株(CK)花粉粒被染成深色或黑色的近乎100%,其中95%以上花粉粒呈圆球形且饱满,说明活力极高;GN-A4、GN-A5花粉粒染成深色或蓝黑色的分别占54.80%和63.60%,个别呈现出不规则的形状,为典型半不育株和半不育株。
不育株的产生受环境、细胞结构、生理变化及基因等多种因素的影响[25]。此外,育性还受日长与温度的共同影响,不适的光温条件使植株中正常的基因表达被遏制,从而导致多种酶活性发生改变,引起代谢失调,使得植株同化能力降低,某些物质分解加速,花粉发育所必需的物质和能量得不到充分供应,从而导致花粉不能发育[26]。刘淑娟等[27]认为矿质元素的变异也会对植物的育性产生影响,如花粉的败育均与钙、镁和钾元素的变化有关,锰的含量变化也会影响到某些酶的活性,从而影响育性。同样,物质代谢作为植物生命活动的基础,而物质代谢之间的差异会反映在各个生理指标上,物质代谢的异常与植物的雄性不育密切相关,而碳水化合物作为花药发育的营养物质及物质合成的原料物质,其含量的短缺会影响花粉的发育[28-30]。王莹等[1]通过对紫花苜蓿雄性不育株(MS-GN1A)的研究发现,可育株花蕾的脯氨酸和可溶性糖含量呈先下降后上升趋势,且各个时期不育株可溶性糖含量都低于可育株,本研究结果与之相近,说明脯氨酸和可溶性糖含量的不足可能会导致不育。本研究结果显示,除了第Ⅰ时期,第Ⅱ~Ⅴ时期不育株可溶性蛋白含量与可育株差异不显著,与梁艳荣等[31]、孙日飞等[32]的研究结论一致。可育株淀粉含量随花蕾发育明显升高,在第Ⅴ时期达到最大值,整个发育阶段可育株淀粉含量均高于不育株,与王莹等[1]和蒋会兵等[33]的研究结果一致。不育株和可育株MDA含量均呈M型变化趋势,在第Ⅲ和Ⅴ阶段不育株略高于可育株,其他均低于可育株,与王莹等[1]的结果相似。POD与呼吸作用、光合作用及生长素的氧化均具有密切的关系[34],而CAT和SOD能够清除代谢过程中多余的有氧自由基[35]。何思等[7]研究发现,不育材料苎麻(Boehmeria nivea)在幼蕾期POD活性最高,且低于可育株;王莹等[1]和王永琦[35]发现不同阶段的不育株花蕾POD、SOD活性均高于可育株,而CAT活性仅在第Ⅰ、Ⅱ阶段高于可育株,本试验结果与此一致。
植物花蕾在发育过程中,其生理特征会发生很大变化,从而导致育性发生改变[36],而变异系数是反映遗传变异程度大小的指标,可以衡量不同变量的变异程度及稳定性[37],对于不育材料的生理变化和育种研究具有重要意义。本研究中从不育株第Ⅰ~Ⅴ发育时期来看,MDA含量的变异幅度较小,而SS、SP含量和CAT、POD、SOD活性的变异幅度较大,说明在不育株花蕾发育时期MDA含量变异较稳定,而其他生理指标变异较丰富;反观可育株,Pro含量、SOD、CAT和POD活性的变异幅度较小,而SS、Sta含量变异幅度较大,说明SS、Sta含量在可育株和不育株花蕾的发育时期均不稳定。
4 结论
通过I2-KI法染色,GN-A1、GN-A2、GN-A3及GN-A6初步鉴定为不育株,GN-A4和GN-A5分别为典型半不育株和半不育株。花蕾随着发育时期的进行,不育株的SS、SP、Sta、Pro含量均在不同阶段出现不足;膜脂过氧化指标出现紊乱,影响了膜脂稳定性从而导致育性发生变化,且在第Ⅲ~Ⅳ阶段的变化最为显著,因此这一阶段是育性产生异常的关键所在。

