Janus激酶抑制剂治疗儿童和青少年斑秃疗效及安全性的meta分析*
王贝贝,康嘉奇,王君辉,宣晓梅
(河北医科大学第一医院皮肤科,石家庄 050000)
斑秃(alopecia areata,AA)是一种非疤痕性脱发,其发生机制为通过T淋巴细胞介导的自身免疫攻击毛囊[1],主要表现为头皮、面部及其他有毛发的皮肤上出现边界清晰的圆形或椭圆形脱发斑。根据毛发受累范围可将其分为局限性斑片状斑秃(alopecia areata patchy,AAP)、全秃(alopecia totalis,AT)和普秃(alopecia universalis,AU)。AA在任何年龄均可发病,患者焦虑和抑郁倾向较高[2],尤其是儿童和青少年患者更易产生严重的社会和心理影响,因此,及时、充分的治疗,防止AA进一步发展至关重要。目前对于儿童和青少年AA患者的一线疗法为局部应用糖皮质激素,但起效较慢。其他传统疗法还包括外用米诺地尔、局部或系统性的免疫抑制剂、免疫致敏剂等治疗[3],但还没有一种治疗方法能够持续有效或永久逆转脱发。近年来,分子靶向疗法成为一种新的治疗方式,如Janus激酶(JAK)抑制剂,它已被美国食品和药品监督局(FDA)批准用于治疗类风湿性关节炎和银屑病,目前已经进入AA领域。一项meta分析显示,JAK抑制剂对72.4%的成人AA起效,头发开始生长的平均时间为(2.2±6.7)个月,头发完全再生平均时间为(6.7±2.2)个月,证实了JAK抑制剂在成人AA中的有效性,尤其是对于重症AA[4]。近年来也报道了许多JAK抑制剂治疗儿童和青少年AA的研究,但疗效不一。本研究通过整合国内外可获得的相关文献,对JAK抑制剂治疗儿童和青少年AA的疗效和安全性进行meta分析,从而为临床应用JAK抑制剂治疗儿童和青少年AA提供循证学依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1纳入标准
(1)研究类型:随机对照试验(RCT)、非RCT、病例系列(CS,包括≥3例患者)和病例报告(CR)研究等;(2)研究对象:年龄≤18岁且诊断为AA、AT和AU的患者;(3)干预措施:试验组接受外用或口服JAK抑制剂治疗;(4)结局指标:总有效率、良好反应率、部分反应率、不良反应发生率。
1.1.2排除标准
(1)综述、系统评价、评论、动物实验、基础研究;(2)研究对象>18岁;(3)重复发表、信息不全或无法获取全文的文献;(4)无明确的结局指标。
1.2 检索策略
采用主题词+自由词的检索策略,使用中文检索词“斑秃”“鬼剃头”“油风”“儿童”“小儿”“幼儿”“未成年人”“Janus 激酶抑制剂”“JAK 激酶抑制剂”“托法替尼”“鲁索替尼”“巴瑞替尼”等和英文检索词“Alopecia areata”“Alopecia circumscripta”“Children”“Minors”“Juveniles”“Adolescents”“Pediatric”“Janus Kinase Inhibitors”“JAK Inhibitors”“Tofacitinib”“Ruxolitinib”“Baricitinib”等。检索以下数据库:中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普(VIP)、万方数据(WanFang Data)、PubMed、Embase和Cochrane Library,检索关于JAK抑制剂治疗儿童和青少年AA的文献,检索时间为各大数据库建库至2021年7月2日。
1.3 文献筛选、数据提取及质量评价
由两名有经验的研究者根据纳入和排除标准选取合格文献,独立进行数据提取并交叉核对,如有分歧,讨论解决或根据第3位研究人员的意见协商解决。数据提取主要内容:文献的第一作者、发表年份、研究类型、AA亚型、样本量、年龄、干预措施、疗程、疗效、不良反应、复发或加重情况。采用MINORS(methodological index for non-randomized studies)质量评价工具[5],对所纳入的文献进行质量评价。具体条目有:(1)明确给出研究目的;(2)纳入患者的连贯性;(3)预期数据的收集;(4)终点指标能恰当地反映研究目的;(5)终点指标评价的客观性;(6)随访时间是否充分;(7)失访率低于5%;(8)是否估算了样本量。项目评分标准:0分,未报告;1分,报告但不充分;2分,报告且充分。非RCT的理想分数为16分。
1.4 统计学处理
采用Stata15.1软件进行meta分析。以率及其95%CI作为疗效分析尺度指标,检验水准α=0.05,以P<0.05为差异有统计学意义。采用Q检验和I2分析各纳入研究间的异质性,若P≥0.1且I2≤50%,则认为各研究间不存在统计学异质性,选用固定效应模型进行分析;若P<0.1和(或)I2>50%,说明各研究间存在统计学异质性,对主要结局指标先进行敏感性分析,在排除方法学异质性后再选择随机效应模型进行meta分析。通过漏斗图评估发表偏倚,Begg’s Test、Egger’s Test对漏斗图的对称性进行检验,若P>0.05,表示漏斗图对称,纳入研究间不存在发表偏倚。
2 结 果
2.1 文献检索结果
通过检索7个数据库,共获得相关文献77篇(CNKI 14篇,PubMed 12篇,Embase 50篇,Cochrane Library 1篇,CBM、VIP、WanFang Data均为0篇),同时人工检索获得7篇。剔除重复文献后剩余56篇,排除综述、系统评价、评论和动物实验等文献后剩余42篇,通过阅读摘要排除研究内容不吻合的文献后剩余28篇,阅读28篇文献全文后,剔除不符合纳入标准的文献12篇,最终获得16篇文献[6-21],均为单臂研究,文献检索与筛选流程见图1。
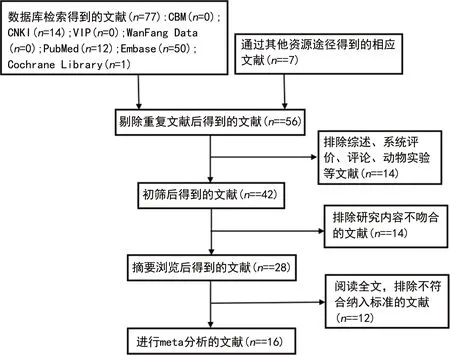
图1 文献检索与筛选流程图
2.2 纳入研究的基本特征
最终纳入16篇单臂研究[6-21],包括2篇CT、7篇CS和7篇CR,其中7篇CR汇总在一起作为合并案例(Pooled cases)组,共计10项研究。纳入的10项研究中共72例患者(AA 16例、AT 18例、AU 38例),其中JERJEN等[14]的研究中有3例患者因疗程不足6个月被剔除,故最终参与疗效评价的患者共69例。10项研究中有2项研究干预措施为外用JAK抑制剂,其余均为口服JAK抑制剂,随访时间1.9~38.0个月。以脱发严重程度评分(Severity of Alopecia Tool score,SALT评分)评价疗效,SALT评分改善<5%定义为对治疗无反应即“无效”,≥5%定义为对治疗有反应即“有效”,“有效”包括部分反应(评分改善<50%)和良好反应(评分改善≥50%)。纳入研究的基本特征见表1。

表1 纳入研究的基本特征

纳入研究疗程[均值(范围),个月]疗效(n)有效良好反应部分反应无效不良反应复发或加重(n)CASTELO-SOCCIO 2017[6]8.9(5.0~18.0) 7070 无无LIU 2019[7]15.3(5.0~31.0)2201NANAMORALES-MIRANDA 2019[8]6.03120上呼吸道感染1例NACRAIGLOW 2017[9]6.5(2.0~16.0)9NANA4头痛3例,上呼吸道感染4例,肝氨基转移酶水平轻度升高4例NACRAIGLOW 2019[10]8.5(6.0~15.0)3301无NADAI 2019[11]13.0(6.0~21.0)3300上呼吸道感染1例,腹泻2例NAPUTTERMAN 2018[12]8.1(1.9~17.7)8353无NABAYART 2017[13]3.0~18.04NANA2实验室指标轻度异常2例NAJERJEN 2021[14]14.7(7.0~38.0)9722上呼吸道感染4例,嗜酸性粒细胞增多5例,肝氨基转移酶升高5例,持续性无症状高胆红素血症1例,低蛋白血症1例,高胆固醇血症3例,甘油三酯升高1例,尿素升高3例,高钾血症3例NAPooled cases 2018-2020[15-21]8.6(5.0~19.0)7NANA1轻度头痛1例,蛋白尿1例1
2.3 纳入研究的质量评价
MINORS质量评价显示,纳入文献中终点指标评价的客观性、是否估算了样本量的报道信息较不充分,所有文献总评分为10~12分,为中等质量,见表2。
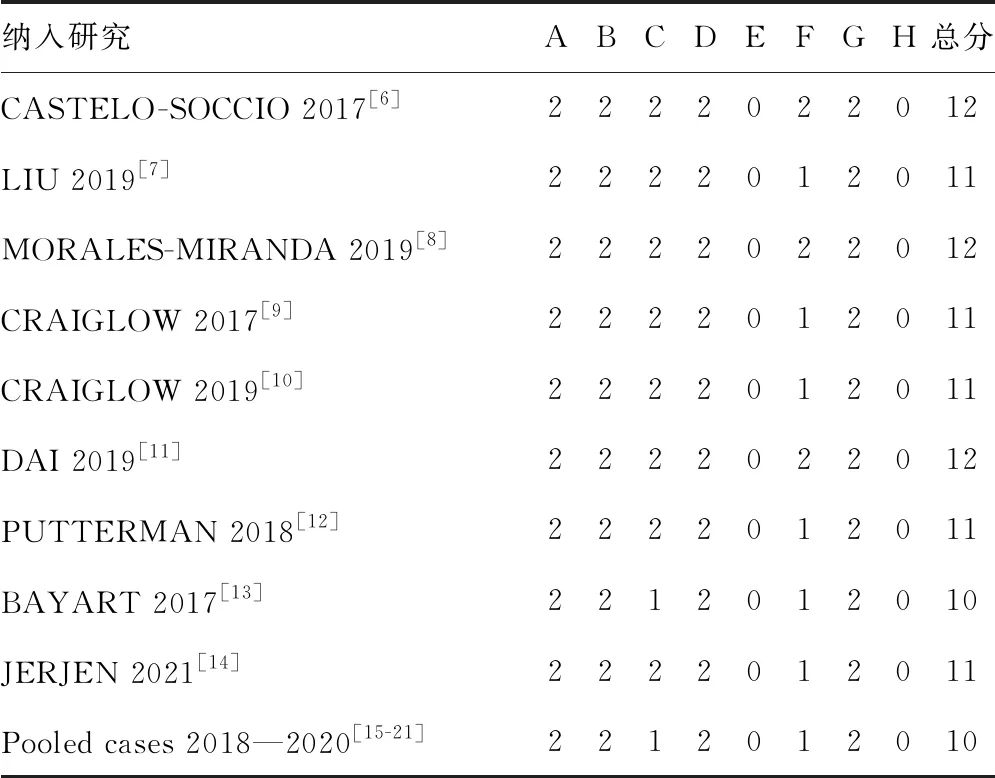
表2 纳入研究的质量评价(分)
2.4 Meta分析结果
2.4.1总有效率
共纳入10项研究[6-21],经过异质性检验,I2=0且P=0.68,纳入文献不存在异质性,选择固定效应模型进行meta分析,汇总的效应量为0.83[95%CI(0.71,0.93),Z=15.12,P<0.01],JAK抑制剂治疗儿童和青少年AA的总有效率为83%,见表3。
2.4.2良好反应率
纳入的研究中7项[6-8,10-12,14]报道了治疗后良好反应的患者数,经过异质性检验,I2=67.21%且P=0.01,纳入文献存在异质性,对其进行敏感性分析,发现无任何一项研究对本次meta分析的结果造成很大干扰,具有较好稳定性,见图2。因此,对这7项研究的异质性宽容接受,选择随机效应模型进行meta分析,得出7项研究汇总的效应量为0.47[95%CI(0.18,0.78),Z=4.01,P<0.01],JAK抑制剂治疗儿童和青少年AA的良好反应率为47%,见表3。
2.4.3部分反应率
纳入的研究中7项[6-8,10-12,14]报道了治疗后部分反应的患者数,经过异质性检验,I2=77.43%且P<0.01,纳入文献存在异质性,继续敏感性分析发现,无任何一项研究对本次meta分析的结果造成很大的干扰,具有较好稳定性,见图3。因此,选择随机效应模型进行meta分析,得出7项研究汇总的效应量为0.31[95%CI(0.03,0.69),Z=2.50,P=0.01],JAK抑制剂治疗儿童和青少年AA的部分反应率为31%,见表3。
2.4.4不良反应发生率
纳入的研究中7项[6,8,10-13,15-21]详细报道了每例患者不良反应发生情况,经过异质性检验,I2=69.13%且P<0.01,纳入文献存在异质性,继续敏感性分析后发现,无任何一项研究对本次meta分析的结果造成很大的干扰,具有较好稳定性,见图4。因此,选择随机效应模型进行meta分析,得出7项研究汇总的效应量为0.18[95%CI(0.00,0.48),Z=2.07,P=0.04],JAK抑制剂治疗儿童和青少年AA的不良反应发生率为18%,见表3。
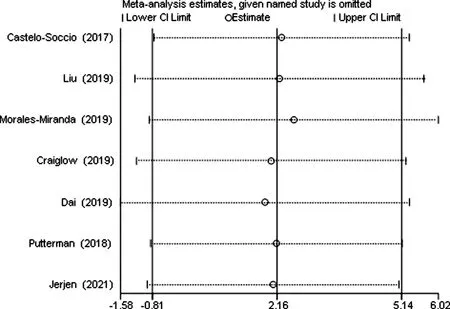
图2 良好反应率的敏感性分析图
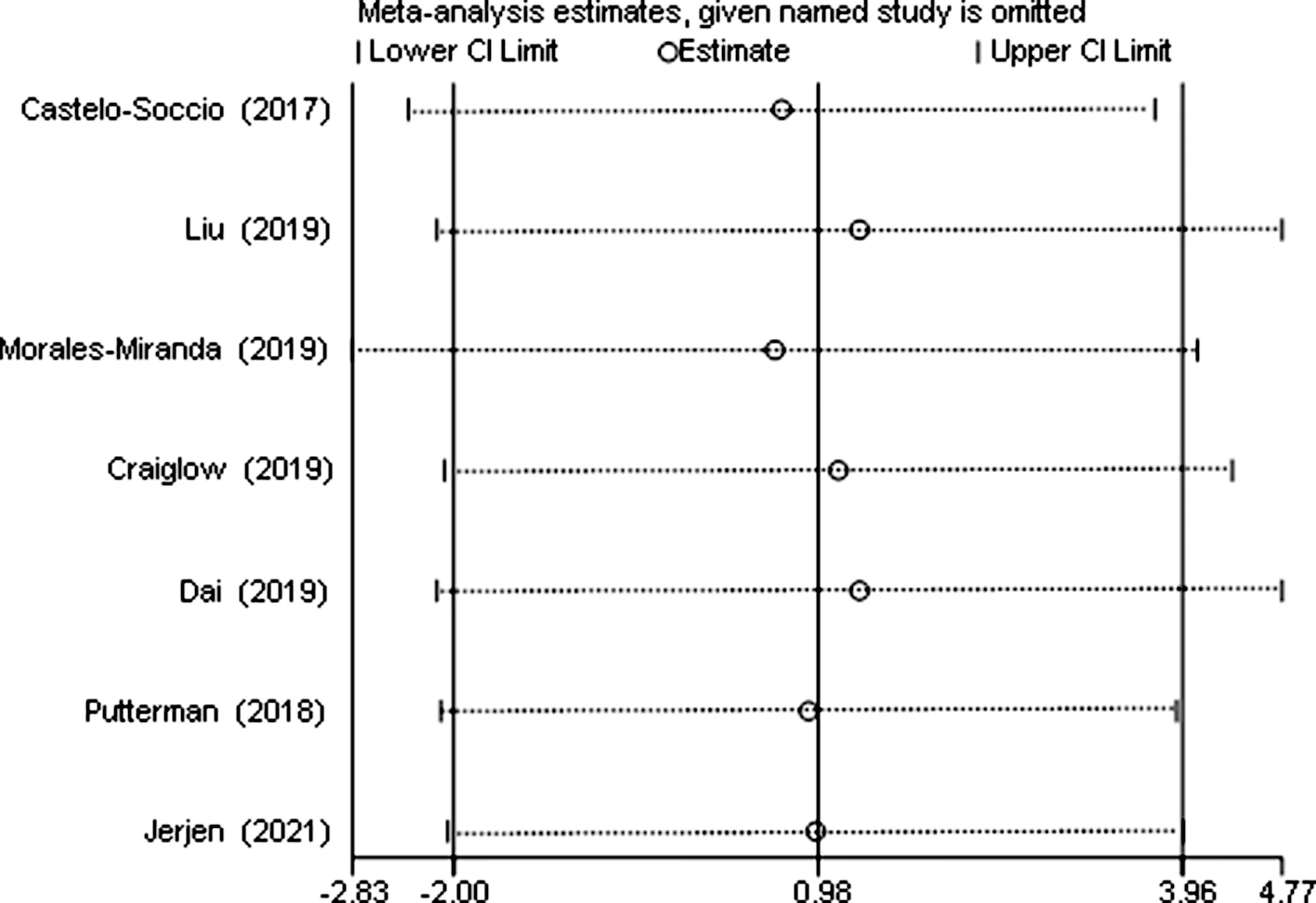
图3 部分反应率的敏感性分析图
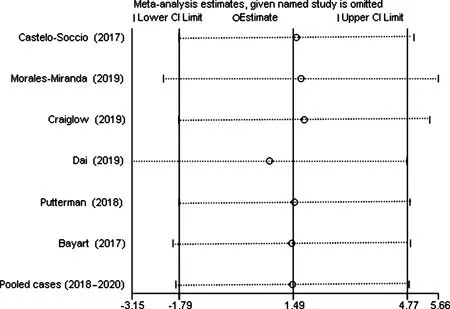
图4 不良反应发生率的敏感性分析图
2.5 发表偏倚分析
以总有效率为指标绘制漏斗图考察本研究是否存在发表偏倚,见图5。更进一步,对漏斗图进行对称性检验,Begg’s Test 的P=0.204,Egger’s Test 的P=0.318,均P>0.05,意味着漏斗图对称,提示本次研究存在发表偏倚可能性小,其余指标所得结果相似。

表3 meta分析结果汇总

图5 总有效率的漏斗图
3 讨 论
AA是一种非疤痕性、炎症性、自身免疫性脱发,其全球发病率为0.57%~3.8%[22],11%~50%的病例发生在儿童时期。其中,约20%的病例始于婴儿期[23]。AA是仅次于特应性皮炎和病毒性疣的第3种儿童最常见皮肤病[24]。儿童和青少年是AA患者中的特殊群体,其发病机制与发病原因较成人患者更加复杂及多样化,可能与遗传、自身免疫、精神因素、EB病毒感染及微量元素缺乏有关[25],其预后不佳。由于儿童和青少年正处于心智尚未足够成熟时期,AA这一毁容性疾病会给患儿造成巨大的精神压力和心理负担,从而影响身心健康。在一项病例对照研究中,BILGIÇ等[26]发现,AA对儿童和青少年心理的影响因头皮受累的严重程度及焦虑和抑郁情绪的存在而加剧。因此一旦确诊为AA,应尽早干预,以避免患者产生过重的心理负担,影响生活质量。目前关于儿童和青少年AA治疗的临床试验数量有限,大多涉及局部应用糖皮质激素[27-29],常与米诺地尔联合提高疗效[30]。系统应用激素及免疫抑制剂可能有效,但长期使用会出现众多不良反应,如生长发育延迟、代谢紊乱及降低骨密度等,故儿童和青少年患者慎用[31-32]。其他疗法包括接触致敏剂、准分子激光和富血小板血浆疗法(PRP)等,但目前研究结果有限[33]。
近年来,靶向治疗在许多免疫性炎症疾病中取得了显著效果。随着对AA分子发病机制进一步的理解,靶向治疗也逐渐在AA领域展开。目前研究表明,AA的发病机制涉及CD8+T淋巴细胞对毛囊的攻击[34]。已知一组细胞因子,包括依赖于JAK-信号转导及激活因子转录(STAT)途径的干扰素(IFN)-γ和白细胞介素(IL)-15,它们可激活CD8+T淋巴细胞的毒性活性,促使其识别、攻击并杀伤毛囊上皮细胞,生长期毛乳头细胞凋亡,提前进入休止期,最终导致脱发。而JAK抑制剂可阻断JAK-STAT信号传导通路,影响T淋巴细胞的免疫反应,抑制CD8+T淋巴细胞产生IFN-γ,减少IL-15的表达,使毛囊免疫反应中止[34],这为AA的治疗提供了新思路。JAK家族中有JAK1、JAK2、JAK3和酪氨酸激酶2(TYK2)4个成员,JAK1主要介导炎症性疾病相关的信号传导,JAK2主要介导造血过程相关的信号传导,而JAK3在免疫炎症性疾病的发生、发展中有着重要的作用[35]。目前,研究较多的JAK抑制剂主要有托法替尼、鲁索替尼、巴瑞替尼,其中托法替尼对JAK1、JAK2和JAK3均有抑制作用,但主要抑制JAK3,而鲁索替尼和巴瑞替尼主要抑制JAK1和JAK2[36]。JABBARI等[37]在小鼠中证明JAK-STAT通路参与了AA的发病,并成功应用JAK抑制剂逆转AA。一项基于成人AA的meta分析显示:JAK抑制剂治疗AA的有效率为72.4%,并发现其疗效与给药途径有关(口服比外用有效率高4倍),而与患者的年龄、性别、病程、AA亚型和JAK抑制剂种类等无明显相关性;复发率较低,复发多与停药有关;不良反应发生率也较低,最常见的是上呼吸道感染和尿路感染[4]。
本文纳入了关于JAK抑制剂治疗儿童和青少年AA的文献,对其疗效和安全性进行meta分析,结果显示:(1)JAK抑制剂治疗儿童和青少年AA显著有效,总有效率为83%,良好反应率为47%,部分反应率为31%,仅有1例患者在治疗过程中出现病情复发,怀疑可能与药物使用剂量不足有关;(2)JAK抑制剂治疗儿童和青少年AA安全性较高,不良反应发生率为18%,主要有上呼吸道感染、肝氨基转移酶升高、嗜酸性粒细胞增多、头痛、胆固醇升高、尿素升高及血钾升高,偶见腹泻、蛋白尿和甘油三酯升高等,一般无需特殊处理,停药后均可好转,不会对患者造成远期伤害。由于JAK抑制剂在免疫抑制的同时削弱了IFN及自然杀伤细胞(NK细胞)的肿瘤监测功能,故长期服用可能会增加肿瘤的发病风险[38]。因此,基于治疗方法的安全性和针对性来考虑,外用JAK抑制剂也可作为AA的理想疗法,尤其是对于轻至中度儿童和青少年AA患者。本研究纳入的患者多为重度AA(包括AT、AU),故多选择口服JAK抑制剂。
本研究虽然说明了JAK抑制剂治疗儿童和青少年AA的疗效及安全性,但仍有以下几点不足:(1)纳入的文献均为单臂研究,缺乏RCT,合并结果可能存在一些异质性;(2)大多数研究样本量小,不能避免选择偏倚;(3)纳入研究均来自国外,这可能导致区域性偏倚;(4)多数研究没有进行较长时间的随访,对于评估JAK抑制剂治疗的远期疗效和安全性还存在不足。因此,未来还需要更多高质量、大样本、多中心RCT来进一步验证本研究结论。

