芋艿蛋白提取工艺的响应面优化及其抗氧化性研究
杨明朗,吴姝洁,董祺祺,赵燕昊,蒋玉蓉*,陆国权
1. 浙江农林大学现代农学院(杭州 311300);2. 桐庐县农业技术推广中心(杭州 311599)
芋艿[Colocasiaesculenta(L.)Schott],又称芋头、毛芋、芋魁等,属天南星科多年生宿根性草本植物[1],原产于印度、马来群岛及中国,现在热带及亚热带地区广泛分布。芋艿富含淀粉、蛋白质以及生物活性大分子,具有美容养颜、润肠滋脾、消痨解毒等作用[2]。芋艿蛋白具有易吸收、降血压等优点,其组分中有一种黏液蛋白,被人体吸收后能产生免疫球蛋白[3]。研究者对国内30余种芋艿品种的蛋白质含量及氨基酸组成分析发现,芋艿的蛋白质含量平均为9.30%,含有18种氨基酸,包括8种人体必需氨基酸,且氨基酸含量与蛋白质含量呈正相关,氨基酸评分(amino acid ascore,ASS)为0.79[4]。国内外对芋艿的研究多集中于种植栽培、淀粉及多糖的粗加工,对芋艿蛋白分离提取及性质方面的研究甚少。国外对芋艿蛋白质的研究开始于1982年,Huang等[5]和Kaushal等[6]测定了芋艿蛋白质含量,结果分别为1.1%~2.5%。常银子等[7]采用正交试验优化酶法提取芋艿蛋白质工艺,其得率为0.52%。黄友如等[8]通过优化碱溶酸沉法制备芋艿分离蛋白,其得率约1.33%。上述两种提取方法得率均较低。奉化芋艿是浙江省主要芋艿品种之一,个大皮薄,糯滑可口,粗蛋白含量可达14.10%,富含钙、磷、镁、铁及VC等多种成分,营养价值丰富,因其独特品质受到消费者的青睐[9]。此次研究以奉化芋艿为材料,采用响应面法对芋艿蛋白的木瓜蛋白酶法提取工艺进行优化,并对芋艿蛋白质的体外抗氧化活性进行评价;同时比较8个芋艿推广品种间蛋白含量差异,为芋艿蛋白的开发和高蛋白芋艿品种筛选提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜奉化芋艿(购于宁波奉化);牛血清蛋白、考马斯亮蓝G-250、抗坏血酸(合肥千盛生物科技有限公司);氢氧化钠、盐酸、磷酸、无水乙醇(分析纯,上海沃凯生物技术有限公司);木瓜蛋白酶(酶活力10万 U/g,南宁庞博生物工程有限公司);DPPH粉末(1, 1-二苯基-2-三硝基苯肼,福州飞净生物有限公司)。
Biosafer-10C台式冷冻干燥机(南京赛飞生物科技有限公司);HH-6恒温水浴锅(常州国华电器有限公司);TG16-WS台式高速离心机(湖南湘仪实验仪器开发有限公司);紫外可见分光光度计(北京普斯通用仪器有限责任公司)。
1.2 试验方法
1.2.1 原料预处理
取新鲜无损的成熟奉化芋艿,削皮并将表面洗净,切片后放入冷冻干燥机冻干72 h,转入恒温鼓风干燥箱烘干3~5 h,磨成粉末,过0.150 mm(100目)孔径筛,得到芋艿干粉,用密封袋保存于4 ℃恒温冰箱。
1.2.2 蛋白标准曲线的绘制
蛋白标准曲线的绘制参考刘玉明等[10]的方法。称取100 mg牛血清蛋白,将其充分溶解于蒸馏水并定容至100 mL,配制成1 mg/mL牛血清蛋白标准溶液。称取0.1 g考马斯亮蓝G-250粉末,溶于50 mL 95%乙醇溶液,并加入100 mL 85%磷酸,加水稀释至1 L,配制成考马斯亮蓝溶液,用棕色瓶保存。用移液枪分别吸取0,0.2,0.4,0.6,0.8和1.0 mL标准蛋白溶液于试管,并加蒸馏水定容至1 mL,加入5 mL考马斯亮蓝溶液,混匀并静置5 min,在波长595 nm处测定吸光度A,以蛋白质量浓度(mg/mL)为横坐标(X),以吸光度A为纵坐标(Y)绘制标准曲线:Y=0.137 3X+0.000 5,R2=0.997 2。
1.2.3 芋艿蛋白质提取酶法提取
称取1 g芋艿干粉,按照1∶20 g/mL的料液比加入蒸馏水溶于离心管,用0.1 mol/L的NaOH和HCl溶液将溶液的pH调到4~8,加入一定量木瓜蛋白酶(0.25%~ 2.5%),于恒温水浴锅(30~70 ℃)加热(0.5~2.5 h)。待反应结束后,将离心管迅速放入95 ℃水浴锅水浴5 min,常温下冷却后以转速5 000 r/min离心20 min,取上清液测定蛋白质得率。用0.5 mol/L的NaOH和HCl溶液将蛋白提取液调至等电点(pH 2.8,由1.2.7可知),于4 ℃恒温冰箱静置24 h,以8 000 r/min的转速离心30 min,去上清液取沉淀,将沉淀冷冻干燥48 h后得到芋艿蛋白质粉。
1.2.4 芋艿蛋白质得率的测定
取1 mL蛋白提取液于试管,加入5 mL考马斯亮蓝溶液,静置5 min后在波长595 nm处测定其吸光度,将吸光度代入蛋白标准曲线的回归方程,得到蛋白提取液的蛋白质量浓度,按照式(1)计算出芋艿蛋白质得率。

式中:Y为蛋白质得率;C为蛋白提取液质量浓度,mg/mL;V为提取液体积,mL;N为稀释倍数;M为芋艿干粉质量,g。
1.2.5 单因素试验
固定各因素水平:料液比1∶20 g/mL,pH 7,酶用量2.0%,反应温度50 ℃,反应时间2 h。分别考察pH(4,5,6,7和8)、酶用量(0.25%,0.5%,1.0%,1.5%,2.0%和2.5%)、反应温度(30,40,50,60和70 ℃)和反应时间(30,60,90,120和150 min)4个因素对芋艿蛋白质得率的影响。
1.2.6 响应面试验
根据单因素水平的结果,利用Design-Expert.V8.0.6.1软件,以pH、酶用量、反应温度、反应时间为自变量,以芋艿蛋白得率为响应值进行四因素三水平的试验设计,优化提取工艺。相关试验因素水平如表1所示。
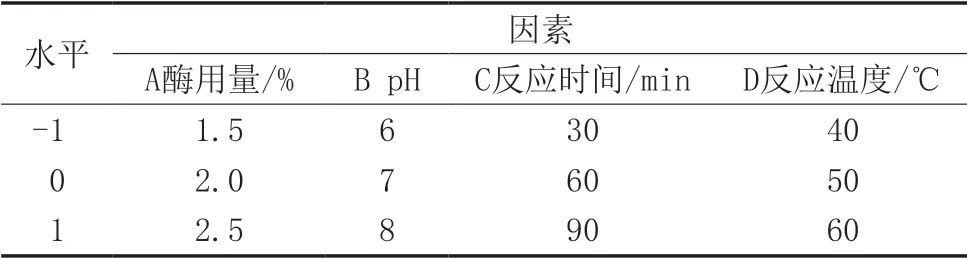
表1 响应面试验因素水平
1.2.7 芋艿蛋白质等电点测定
量取芋艿蛋白提取液分装至离心管,每个离心管10 mL提取液,用0.5 mol/L的盐酸和0.5 mol/L的NaOH调节pH分别为2.0,2.2,2.4,2.6,2.8,3.0,3.2,3.4,3.6,3.8和4.0,将离心管置于4 ℃恒温冰箱箱沉淀24 h后,以8 000 r/min的转速离心30 min,去除离心管中的沉淀,取上清液,采用考马斯亮蓝法在波长595 nm处测定吸光度,吸光度最低时的pH为芋艿蛋白质的等电点。
1.2.8 芋艿蛋白质抗氧化活性测定
将芋艿蛋白质粉分别配制成质量浓度为0.2,0.4,0.6,0.8和1.0 mg/mL的蛋白溶液。VC可以清除自由基、促进细胞再生,具有很强的抗氧化活性,常被用来作为抗氧化性试验的对照。配制对应浓度的VC溶液,比较芋艿蛋白与VC的抗氧化活性。
分别量取2 mL不同质量浓度芋艿蛋白溶液于棕色试管,加入2 mL现配制的0.2 mmol/L的DPPH溶液,充分振荡混匀,在避光的条件下静置30 min后,在波长517 nm处测定其吸光度,按照式(2)计算DPPH清除率,VC溶液测定方法同上。
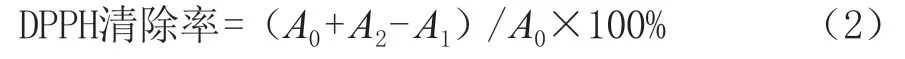
式中:A0为蒸馏水与DPPH混合溶液的吸光度;A1为样品与DPPH混合溶液的吸光度;A2为样品与无水乙醇混合溶液的吸光度。
分别量取2 mL不同质量浓度的芋艿蛋白溶液于试管,加入2 mL 6 mmol/L的FeSO4溶液和6 mmol/L的双氧水,摇匀并静置100 min;加入2 mL 6 mmol/L的水杨酸溶液,静置20 min后在波长510 nm处测定其吸光度,按照式(3)计算羟自由基清除率。
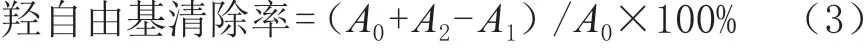
式中:A0为蒸馏水替换样品溶液的吸光度;A1为样品溶液与混合液的吸光度;A2为蒸馏水替换双氧水溶液的吸光度。
1.2.9 不同品种间蛋白质含量差异的研究
在优化提取工艺条件下对海南芋艿、马山芋艿、靖江香沙芋、鸡爪芋等共8种不同品种芋艿进行蛋白质提取,测定其得率,研究其品种间差异。
1.3 数据处理
所有试验重复3次,取平均值;响应面设计采用Design-Expert. V8.0.6软件;统计学分析采用Excel 2016软件。
2 结果与分析
2.1 单因素试验
2.1.1 酶用量对芋艿蛋白质得率的影响
随着酶用量的增加,芋艿蛋白质得率逐渐增大,酶用量2.0%时达最大值3.66%,酶用量继续增加时,蛋白得率略微下降(图1)。出现此现象的原因是:当芋艿干粉浓度固定时,酶用量的增加使底物与木瓜蛋白酶的接触面积和接触概率增大,从而提高芋艿蛋白质得率;酶用量继续增加时,酶浓度处于过饱和状态,酶与底物发生竞争,导致部分酶分子不能和底物接触,从而影响蛋白质得率[11]。综合上述试验现象,确定最佳酶用量为2%。
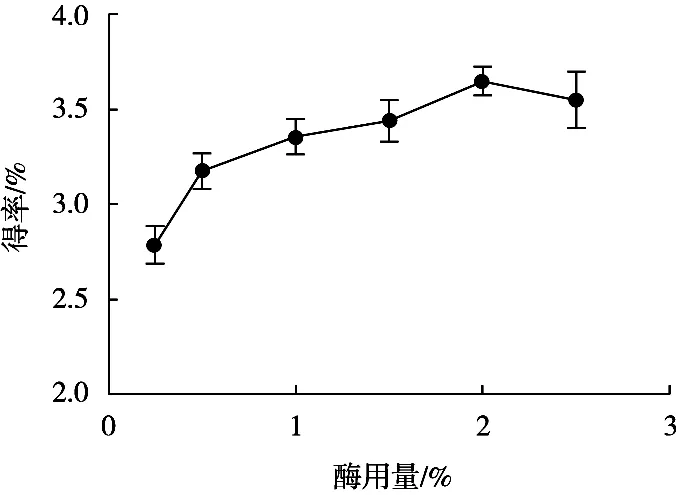
图1 酶用量对芋艿蛋白质得率的影响
2.1.2 pH对芋艿蛋白质得率的影响
随着pH逐渐增大,芋艿蛋白质得率随之增大,pH 7时达最大值3.04%,当pH继续增大时,蛋白质得率开始下降(图2)。出现此现象的原因是:酶分子是特殊的蛋白分子,由1个或若干个活性部位组成酶的活性部位只有保持一定空间构象才能存在,其催化功能才能实现[12]。pH较低时,木瓜蛋白酶的空间构象受到破坏,活性较低;pH达到适宜条件后,酶具有较高的催化水解活性,从而提高蛋白质得率。综合上述试验现象,确定最佳pH为7。
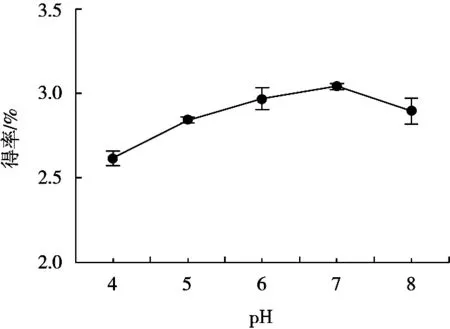
图2 pH对芋艿蛋白质得率的影响
2.1.3 反应时间对芋艿蛋白质得率的影响
随着反应时间的增加,芋艿蛋白质得率随之增加,反应时间60 min时达最大值3.37%,反应时间继续增加时,蛋白得率下降(图3)。出现此现象的原因是:酶与底物随时间推移逐渐反应完全,在60 min时反应基本完成;反应时间继续增加时,蛋白质可能会出现凝聚沉淀现象,在离心时与残渣一同被去除,从而影响蛋白质得率[13]。故确定最佳反应时间为60 min。

图3 反应时间对芋艿蛋白质得率的影响
2.1.4 反应温度对芋艿蛋白质得率的影响
随着反应温度的上升,芋艿蛋白质得率随之增加,反应温度50 ℃时达最大值3.74%,当温度继续上升时,蛋白得率下降(图4)。出现此现象的原因是:反应温度低于酶反应最适温度时,随着温度的上升,酶的反应速度提高,从而提高蛋白质得率;过高的温度可能会导致酶的活性降低及蛋白质的变性[14],使蛋白质得率降低。所以确定最佳反应温度为50 ℃。
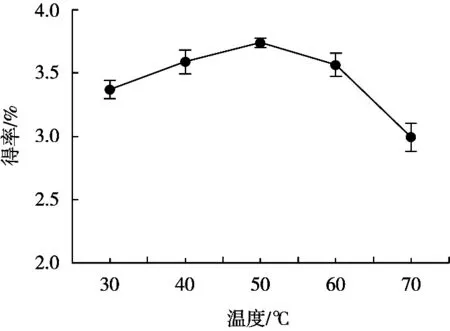
图4 反应温度对芋艿蛋白质得率的影响
2.2 响应面优化试验
2.2.1 响应面设计及结果
分析单因素试验的结果,综合考虑试验要求,决定以酶用量2%、pH 7、反应时间60 min、反应温度50 ℃为中心点,设计四因素三水平中心组合试验。响应面设计方案及结果如表2所示。
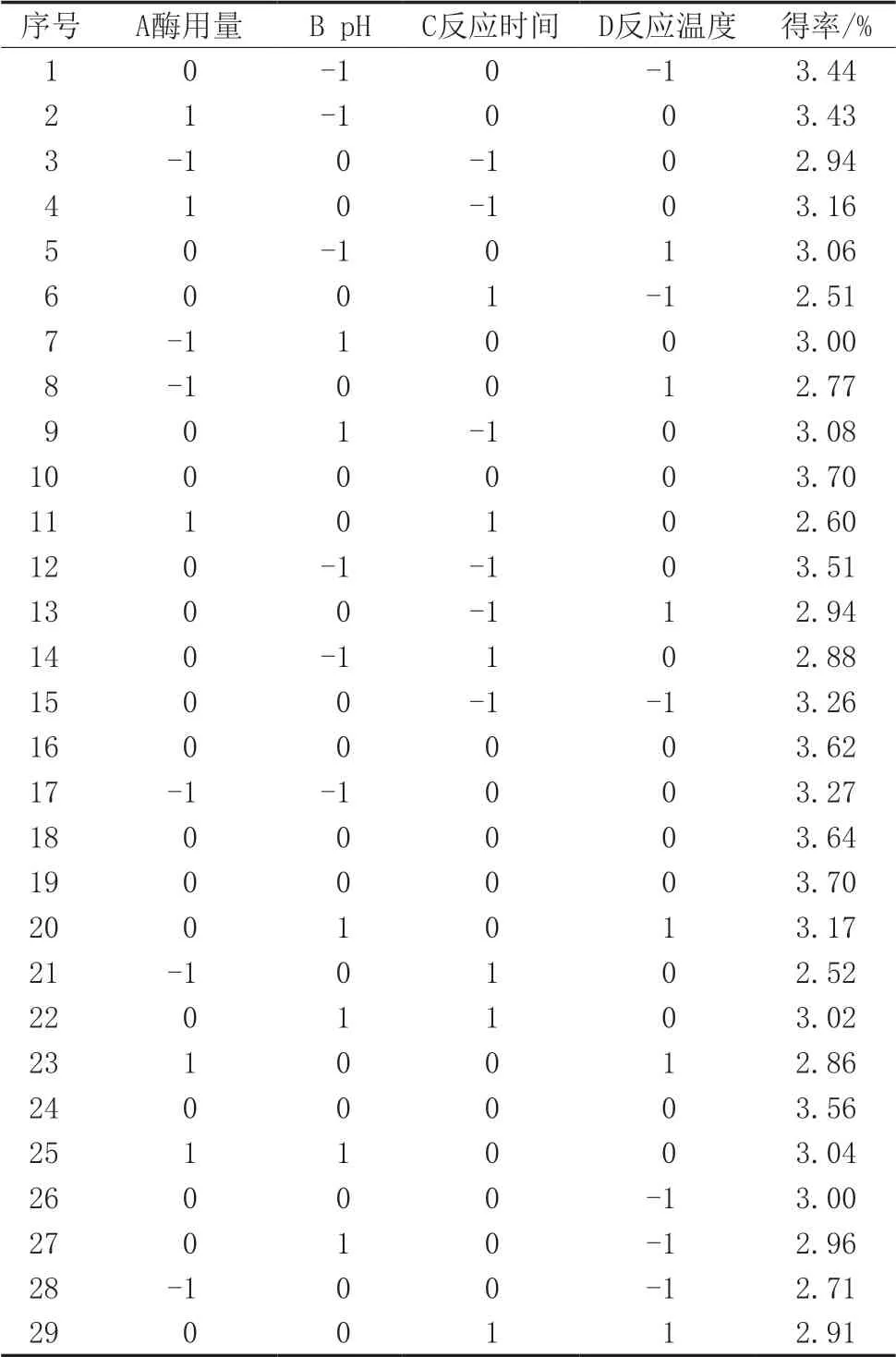
表2 响应面试验优化设计及结果
2.2.2 响应面模型的分析
利用Design-Expert. V8.0.6.1软件分析表2数据的响应面回归参数,以芋艿蛋白质得率为响应值,得到回归方程:Y=-10.611 08+7.785 33A+0.263 83B- 0.011 067C+0.254 25D-0.6AB-2.333 33×10-3AC-0.1AD+4.75×10-3BC+0.014 750BD+6×10-4CD- 1.644 67A2-0.091 167B2-4.526 85×10-4C2-3.749 17× 10-3D2。模型的方差分析结果如表3所示。
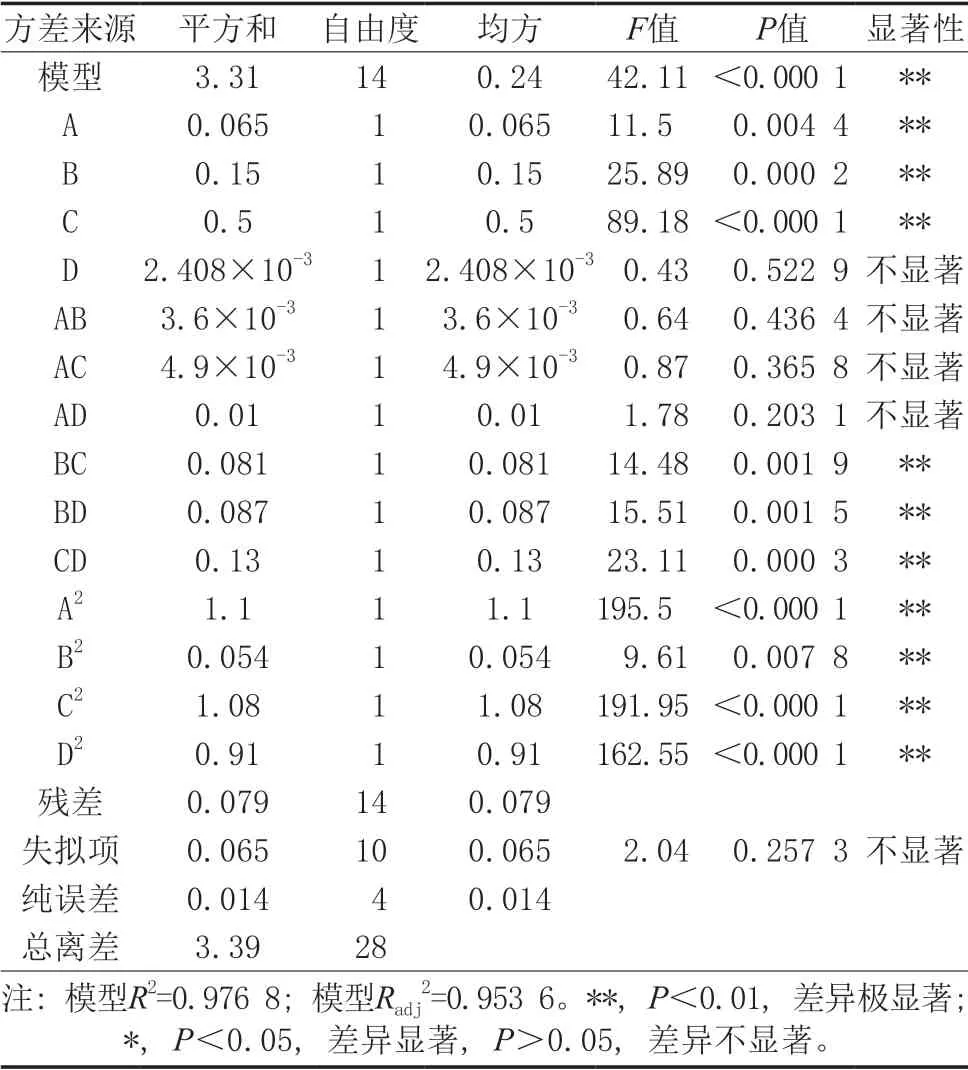
表3 回归模型方差分析
由表3可知,该回归模型极显著(P<0.000 1),失拟差不显著(P>0.05),说明其他未知干扰因子对试验结果影响较小,模型与实际情况拟合较好。模型决定系数R2=0.976 8,模型校正系数Radj2=0.953 6,说明模型能解释95.36%响应值的变化,试验值与预测值在试验范围内的一致性较高,可用于对芋艿蛋白质的得率进行结果分析和预测。在模型中,一次项A(酶用量)、B(pH)、C(反应时间)对芋艿蛋白质得率影响极显著(P<0.01),D(反应温度)对蛋白质得率影响不显著(P>0.05);交互项中,BC、BD、CD对蛋白质得率影响极显著,其余对蛋白质得率影响不显著;二次项均为极显著。根据4个单因素F值判断,影响芋艿蛋白质得率因素的顺序为反应时间>pH>酶用量>反应温度。
2.2.3 响应面各因素交互作用分析
为更直观地反映pH与反应时间(BC)、pH与反应温度(BD)、反应时间与反应温度(CD)3个两因素交互作用对蛋白质得率的影响规律,分别将模型中其他两个因素水平固定为0,绘制相应的等高线图及三维曲面图。通过观察等高线图椭圆的曲线水平及三维曲面图坡度情况,反映两因素交互作用的显著性。椭圆形程度越高,表明交互作用越显著;响应面图的坡面越陡,表示交互作用的影响程度越深。结果如图5~图7所示。
图5表示在固定酶用量2.0%、反应温度50 ℃时,pH与反应时间交互作用对芋艿蛋白质得率的影响。pH一定时,蛋白质得率随反应时间先上升后下降;当反应时间一定时,pH为7可以得到较高的蛋白质得率。由响应面图中可知,坡面在反应时间一侧更为陡峭,等高线相对密集,表明反应时间对蛋白质得率的影响大于pH。
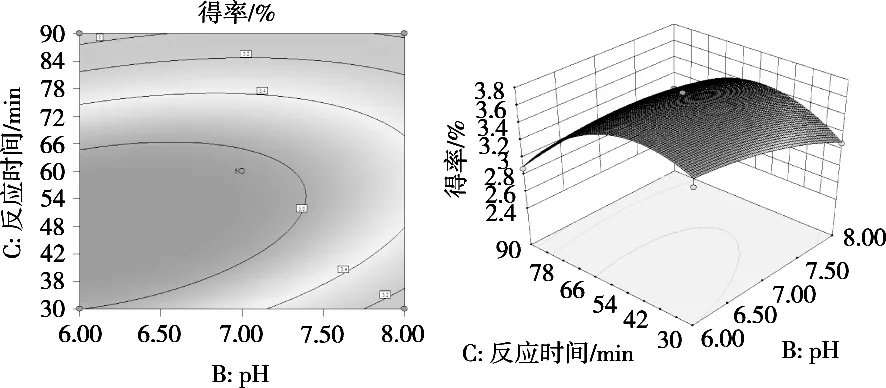
图5 pH与反应时间交互作用等高线和响应面图
图6表示在固定酶用量2.0%、反应时间60 min时,pH与反应温度交互作用对芋艿蛋白质得率的影响。在pH一定时,蛋白质得率随反应温度先上升后下降;当反应温度一定时,pH为7可以得到较高的蛋白质得率。由响应面图中可知,坡面在pH一侧更为陡峭,等高线相对密集,表明pH对蛋白质得率的影响大于反应温度。
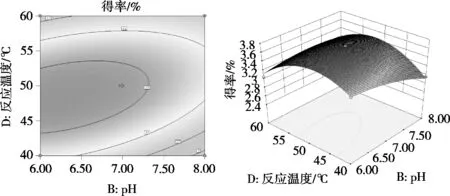
图6 pH与反应温度交互作用等高线和响应面图
图7表示在固定酶用量2.0%、pH 7时,反应时间与反应温度交互作用对芋艿蛋白质得率的影响。在反应时间一定时,蛋白质得率随反应温度先上升后下降;当反应温度一定时,反应时间60 min可以得到较高的蛋白质得率。由响应面图中可知,坡面在反应时间一侧更为陡峭,等高线相对密集,表明反应时间对蛋白质得率的影响大于反应温度。

图7 反应时间与反应温度交互作用等高线和响应面图
2.2.4 工艺验证试验
利用Design-Expert. V8.0.6软件对回归模型的参数进行优化,确定芋艿蛋白质得率的最佳工艺条件:酶用量2.08%、pH 6、反应时间44.72 min、反应温度46.51 ℃。预测的蛋白质得率为3.788%。为证明响应面优化工艺的可靠性,进行验证试验,结合实际操作合理性,将工艺参数确定为酶用量2.1%、pH 6、反应时间45 min、反应温度46.5 ℃。进行3次重复试验取平均数,芋艿蛋白质得率为3.78%,与预测值偏差0.3%,说明优化后的提取参数条件可靠,可用于实际生产操作。
2.3 芋艿蛋白质等电点
当蛋白质处于等电点时,蛋白质分子所携带的正负电荷数相同,电荷作用力抵消[15],蛋白质颗粒容易发生碰撞,并因失去电荷和脱水而析出。如图9所示,当pH在2.8附近,芋艿蛋白上清液的吸光度最低。说明在pH 2.8时溶液中含有的蛋白质含量最少,为该芋艿蛋白的等电点。
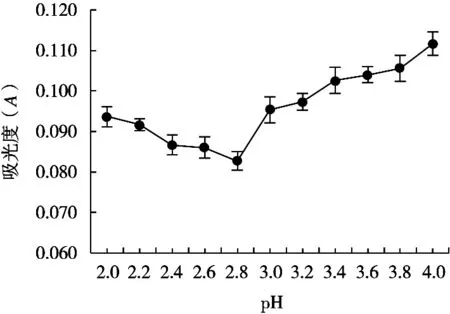
图9 芋艿蛋白质等电点
2.4 芋艿蛋白质抗氧化活性
抗氧化剂能使DPPH溶液发生自由基清除现象,作用表现为溶液紫色削弱或消失,同时在波长517 nm处吸光度变小,表示抗氧化作用较强[16]。如图10所示:在0.2~0.6 mg/mL的质量浓度范围内,随着质量浓度上升,芋艿蛋白溶液对DPPH的清除率迅速增大;在0.6~1.0 mg/mL质量浓度范围时,蛋白质对DPPH的清除率上升缓慢并趋于稳定。利用prism 8.0软件对数据进行分析,得出芋艿蛋白质对DPPH·的IC50=0.398 7 mg/mL,其IC50值小于10 mg/mL,这表明芋艿蛋白质具有较为良好的抗氧化活性[16]。而VC溶液对DPPH的清除能力稳定在95%~95.5%的范围内,且波动很小,说明芋艿蛋白质对DPPH自由基的清除能力小于VC。
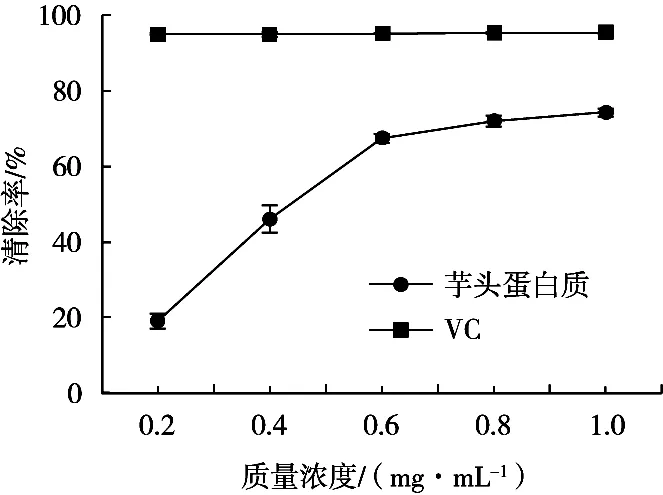
图10 芋艿蛋白质与VC对DPPH自由基的清除能力
羟基是极其活跃的自由基,可与活细胞内的分子进行反应,致细胞分子组织的过氧化,从而引发疾病,而游离的氨基酸可以较快地与·OH结合,从而达到清除作用[17]。如图11所示,在0.2~1.0 mg/mL的质量浓度范围内,芋艿蛋白对羟自由基的清除能力逐渐增强。利用prism 8.0软件对数据进行分析,芋艿蛋白质对·OH的IC50为0.496 3 mg/mL,表明芋艿蛋白对羟自由基具有良好的清除能力。
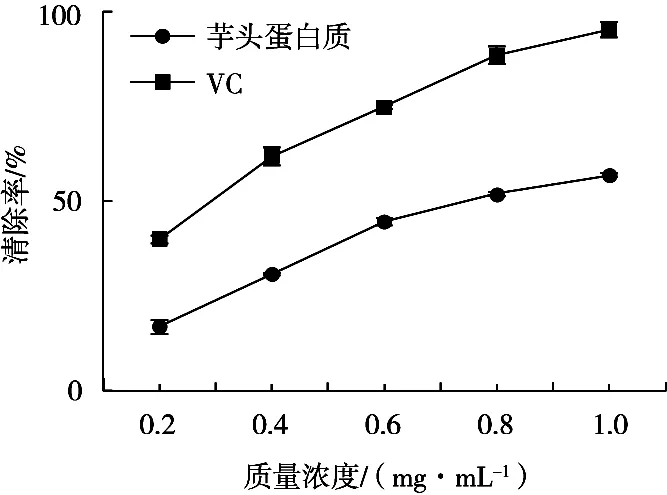
图11 芋艿蛋白质与VC对羟自由基的清除能力
2.5 芋艿蛋白质含量的品种间差异
采用最佳工艺条件,对不同芋艿品种蛋白质得率测定,结果如表4所示。芋艿蛋白质得率在不同品种间具有较大差异,变异幅度在1.58%~3.96%,平均得率为3.13%,变异系数为26.2%。说明不同品种的蛋白质含量有较大差异,通过合适的育种途径,可以筛选到高蛋白的芋艿品种。

表4 不同种芋艿蛋白质得率
3 结论
采用响应面分析法对酶法提取芋艿蛋白质的工艺进行优化,最佳提取工艺条件为酶用量2.1%,pH 6,反应时间45 min,反应温度46.5 ℃。在此条件下,芋艿蛋白质得率为3.78%,与预测值3.79%拟合程度极高,相较于同类研究[8-9]提取工艺得率分别提高6.2倍和1.8倍。同时,抗氧化性的分析表明,芋艿的蛋白质对DPPH·和·OH均具备较强的清除能力,其IC50分别为0.398 7和0.496 3 mg/mL。此外,不同品种的芋艿之间蛋白质含量差异明显,其中鸡爪芋的蛋白质含量最高,得率达3.96%,而海南芋艿得率最低,为1.58%。试验结果为高蛋白芋艿品种的选育提供理论基础。

