吩嗪合成蛋白PhzA和PhzB的功能比较
孔德毓, 王 正, 聂晨曦, 张雪洪
(上海交通大学生命科学技术学院微生物代谢国家重点实验室, 上海200240)
天然吩嗪类化合物是一类广谱且高效的抗生素,目前已报道了180多种,由于其卓越的生物学活性,在医药和农业领域具有良好的应用潜力[1-2]。吩嗪的生物合成机制已基本清晰,假单胞菌中包含7个吩嗪合成蛋白PhzABCDEFG,以磷酸烯醇式丙酮酸(PEP)和赤藓糖-4-磷酸(E4P)为前体逐步催化生成吩嗪-1-羧酸(PCA),进而合成其他衍生物,如吩嗪-1-酰胺、内吩嗪A[3]等。然而以链霉菌为主的放线菌中仅有PhzBCDEFG等6个蛋白,推测PhzA与PhzB两者的功能可能由PhzB单独完成。同时,与假单胞菌不同的是,放线菌中吩嗪类化合物主要以吩嗪-1,6-二羧酸(PDC)及其衍生物为主[3-4]。目前已知的绝大多数复杂吩嗪类化合物都是以PDC作为前体进行合成的,如洛蒙真菌素(Lomofungin)、灰藤黄菌素(Griseolutein)、Esmeraldins、Saphenamycin等[5-7]。
目前对PhzA/B蛋白催化合成PDC与PCA的具体机制仍不清楚,有研究推测:PhzB蛋白可能在聚合两分子的6-氨基-5-氧代环己基-2-烯-1-羧酸(AOCHC)后,对其进行分子内结构重排生成PCA与PDC的前体二亚胺六氢-吩嗪-1,6-二羧酸(HHPDC)[8];而PhzA蛋白可能不参与吩嗪的直接催化合成,具体的功能仍然不清楚[9]。同时有研究发现在绿针假单胞菌HT66中对基因phzA的敲除发现了PDC的合成[10],而含有基因phzA的铜绿假单胞菌HRW.1-S3[11]、Y12与P18[12]也能天然合成PDC,尽管产量极少。我们推测PhzA/B蛋白在前体向PDC和PCA的分化合成中可能具有重要的作用,PhzA/B的功能阐述对定向合成PDC或PCA具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
本研究所用到的菌株参照表 1,质粒与引物未显示。

1.1.2 培养基及菌株生长条件
绿针假单胞菌GP72,为本实验室于甜椒根际分离的一株能够天然合成吩嗪类化合物的菌株;GP72AN是敲除负调控基因repA的吩嗪类化合物高产菌株。LB培养基(g/L):蛋白胨 10,酵母提取物 5,NaCl 10,pH 7.0。KMB培养基(g/L):蛋白胨 20,MgSO40.732,K2HPO4·3H2O 0.514,pH 7.5;甘油15 mL[13]。固体培养基中每升添加12 g琼脂粉。培养基中抗生素添加量(mg/L):卡那霉素(Km) 50、硫酸氨苄青霉素(Amp) 100。大肠杆菌37 ℃培养;假单胞菌28 ℃、200 r/min振荡培养。
1.1.3 主要试剂及仪器
LATaqDNA聚合酶,Solution I DNA连接酶购自TaKaRa公司;KOD Plus Neo DNA 高保真聚合酶购自Toyobo公司;EasyTaqDNA聚合酶购自全式金公司;DNA限制性内切酶购自NEB公司;DNA Marker购自全式金公司。质粒提取采用TaKaRa Mini BEST Plasmid Purification Kit (Ver.4.0);基因组提取采用全式金基因组DNA快速纯化试剂盒;DNA回收采用的TaKaRa Mini BEST DNA片段纯化试剂盒(ver.4.0)。通过金斯瑞生物科技股份有限公司进行基因合成及亚克隆。通过深圳华大公司进行测序和引物的合成。安捷伦HPLC分析柱为反相C18色谱柱(4.6 mm i. d.×250 mm, 5 μm)。
1.2 引物和PCR反应
依照绿针假单胞菌GP72的全基因组序列设计引物。以GP72基因组为模板扩增用于phzA基因敲除的上游与下游DNA片段。
PCR反应体系(50 μL):2×KOD Plus Neo buffer 25 μL,dNTPs(2.5 mmol/L) 5 μL, Mg2+(25 mmol/L) 3 μL,KOD Plus Neo DNA聚合酶1 μL,引物(10 μmol/L)各1.5 μL,DNA模板0.5 μL,ddH2O 12.5 μL。PCR反应条件:98 ℃ 预变性 5 min;98 ℃ 变性 30 s,55 ℃~65 ℃ 退火 30 s,72 ℃ 延伸 0.5~3 min, 共30个循环;72 ℃ 再延伸10 min。
用于phzB与phzAB基因敲除、异源phzA与phzB基因替换的上游与下游片段的扩增和异源phzA与phzB基因片段的扩增方法,与上述扩增方法一致。
1.3 目的基因敲除与替换
DNA片段纯化、质粒抽提、酶切、酶连等均参照试剂盒说明书进行操作,重组质粒及突变株的测序验证委托华大基因科技股份有限公司。
采用同源重组方法将phzA、phzB与phzAB基因分别敲除,将异源同源phzA与phzB基因分别替换,具体方法参照文献[14]。以敲除phzA基因为例,首先以GP72AN基因组为模板, 利用phzA-P1/phzA-P2和phzA-P3/phzA-P4两对引物分别扩增phzA基因上、下游片段,然后通过融合PCR连接上、下游片段。采用EcoR I/Hind Ⅲ双酶切融合片段,将酶切好的目的片段克隆到pK18mobsacB质粒中,测序验证得到pK18-phzA重组质粒。将重组质粒转化到E.coliS17中,将其作为供体菌,GP72AN作为受体菌,在无抗平板上共培养。质粒pK18-phzA转入GP72AN菌株后,不能在染色体外自主复制,可与GP72AN基因组发生同源重组。用含Amp和Km抗生素的平板筛选单交换菌株。然后将在双抗性平板上生长的菌体涂布在含10%蔗糖的LB平板上,促使其完成双交换,将该平板上生长的单克隆分别影印在含Amp和Km抗生素的平板上,在Amp平板上生长而不能在Km平板生长,则发生双交换,使用引物phzA-P1与phzA-P4进行PCR筛选,最后使用检测引物进行基因测序,正确的为GP72ANphzA突变株。
1.4 吩嗪类化合物产量测定
每隔12 h取样一次,每个菌株每次实验中设3个平行样,测定吩嗪类化合物产量及细胞生长密度(OD600)。独立重复实验2~3次。吩嗪类化合物测定方法均参照文献[15],将发酵液酸化处理后,加入乙酸乙酯振荡萃取,离心取上清液,风干后重溶、过滤待测。经测定,在24 h时绿针假单胞菌GP72的吩嗪类化合物产量最高。
1.5 蛋白同源建模
使用SWISS-MODEL软件对不同来源的PhzA/B蛋白进行同源建模,根据覆盖率、同源性、模型置信值、匹配度等进行筛选,以最适宜的已知蛋白结构模型为模板,完成蛋白模型的构建[16]。
2 结果与分析
2.1 不同菌株吩嗪合成基因簇的筛选对比
基于文献和NCBI数据库,分别筛选主要合成PCA的菌株与能天然合成PDC的菌株,再根据其PhzA/B蛋白之间的同源性进行复筛,最后对吩嗪合成基因簇进行对比分析。结果(图 1)显示, PDC主要在链霉菌等放线菌中合成,在假单胞菌中很少发现PDC的合成。而假单胞菌的吩嗪合成基因簇中有一个独特的phzA基因,同时在绿针假单胞菌HT66中敲除基因phzA发现了PDC的合成,推测PhzA蛋白可能是阻碍假单胞菌合成PDC的原因[10];但最近有研究发现含有基因phzA的铜绿假单胞菌HRW.1-S3[11]、Y12与P18[12]都能天然合成极其微量的PDC。PhzA蛋白不具有PhzB的催化活性[8],其在PDC合成中的作用需要后续实验验证,同时推测吩嗪合成前体HHPDC向PDC和PCA的分化合成与PhzA/B蛋白有关。
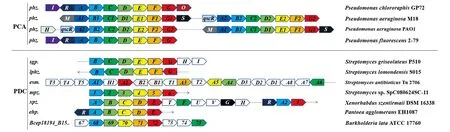
以Pseudomonas chlororaphis GP72的7个基因为对照;同样颜色的基因拥有相同功能。图1 不同种属吩嗪产生菌的吩嗪生物合成操纵子和基因簇Figure 1 Phenazine biosynthetic operons and gene clusters in different species of phenazine-producing bacteria
选取2个异源phzA与7个异源phzB进行基因合成,分别来源于:PseudomonasaeruginosaM18的phzA1(GenBank accession number:FJ494908.1,后文同);phzA2(FJ494909.1)与StreptomycesgriseoluteusP510的sgpB(HM363127.1);StreptomyceslomondensisS015的lphzB(KP721214.1);StreptomycesantibioticusTu 2706的esmA1(JF417969.1);Streptomycessp. SpC080624SC-11的mpz1(KF808339.1);XenorhabdusszentirmaiiDSM 16338的xpzA(CM002327.2);PantoeaagglomeransEH1087的ehpA(AF451953.1);BurkholderialataATCC 17760的Bcep18194_B1568(ephzB, CP000152.1)。针对绿针假单胞菌进行密码子优化。
2.2 对GP72AN内源phzA和phzB基因的敲除
使用同源重组方法敲除phzA、phzB及双敲phzAB基因,分别命名为GP72ANphzA、GP72ANphzB及GP72ANphzAB。
对phzA与phzB的敲除结果显示,phzB基因的敲除对菌体的生长有一定影响[图 2(a)]。3株突变株都能合成吩嗪-1,6-二羧酸(PDC),但PCA与其他吩嗪的产量却大大降低[图 2(b)];其中单敲基因phzA能使PDC产量显著提升,这与Guo等[10]在绿针假单胞菌HT66中敲除phzA基因的结果一致,PhzA蛋白对PDC的合成可能有一定阻碍作用;同时菌株虽然仍能合成PCA,但PCA及其衍生物的产量大大降低,表明PhzA对PCA的合成有重要的正调控作用。推测PhzA蛋白能将吩嗪合成前体优先流向PCA,并促进PCA的合成。此外,缺少PhzA/B蛋白的突变株都能合成少量的PDC与PCA,表明PDC与PCA的合成不一定需要PhzA/B蛋白的参与,但双敲phzAB的突变株PDC产量比单敲phzA的产量低,推测PhzB蛋白可能加速了PDC的合成。
2.3 异源phzA与phzB基因的替换
2.3.1 异源phzB基因对内源phzA与phzB基因的共同替换
通过同源重组的方法将1个sgpB基因替换至内源phzA与phzB两个基因的所处位点,将其命名为GP72ANsgpB。其他6个异源基因同样替换后分别命名为GP72ANlphzB、GP72ANesmA、GP72ANmpz1、GP72ANxpzA、GP72ANehpA和GP72ANephzB。
生长曲线和发酵产物测定结果显示:异源phzB基因替换对细菌生长影响很小[图 3(a)],而GP72ANphzB和GP72ANphzAB两个突变株的细胞生长密度都有所降低(图 2),由此可看出:PhzB蛋白对绿针假单胞菌GP72AN的生长有重要作用。7个突变株都能合成PDC[图 3(b)],证实PhzB蛋白确实有促进PDC合成的能力;同时在体外催化实验中,发现与不添加PhzB的对照组相比,添加不同来源的PhzB蛋白都能催化合成更多的PDC,这与体内实验结论一致。但7个突变株PDC的产量都不及GP72ANphzA,可能的原因:第一,异源的PhzB蛋白催化生成PDC的能力不如绿针假单胞菌GP72中的PhzB蛋白;第二,异源的PhzB蛋白在绿针假单胞菌GP72内未能很好地表达,活性受到一定限制。同时,7个突变株的PCA及其衍生物产量显著降低,说明PhzA蛋白在PCA高效合成中具有重要作用。
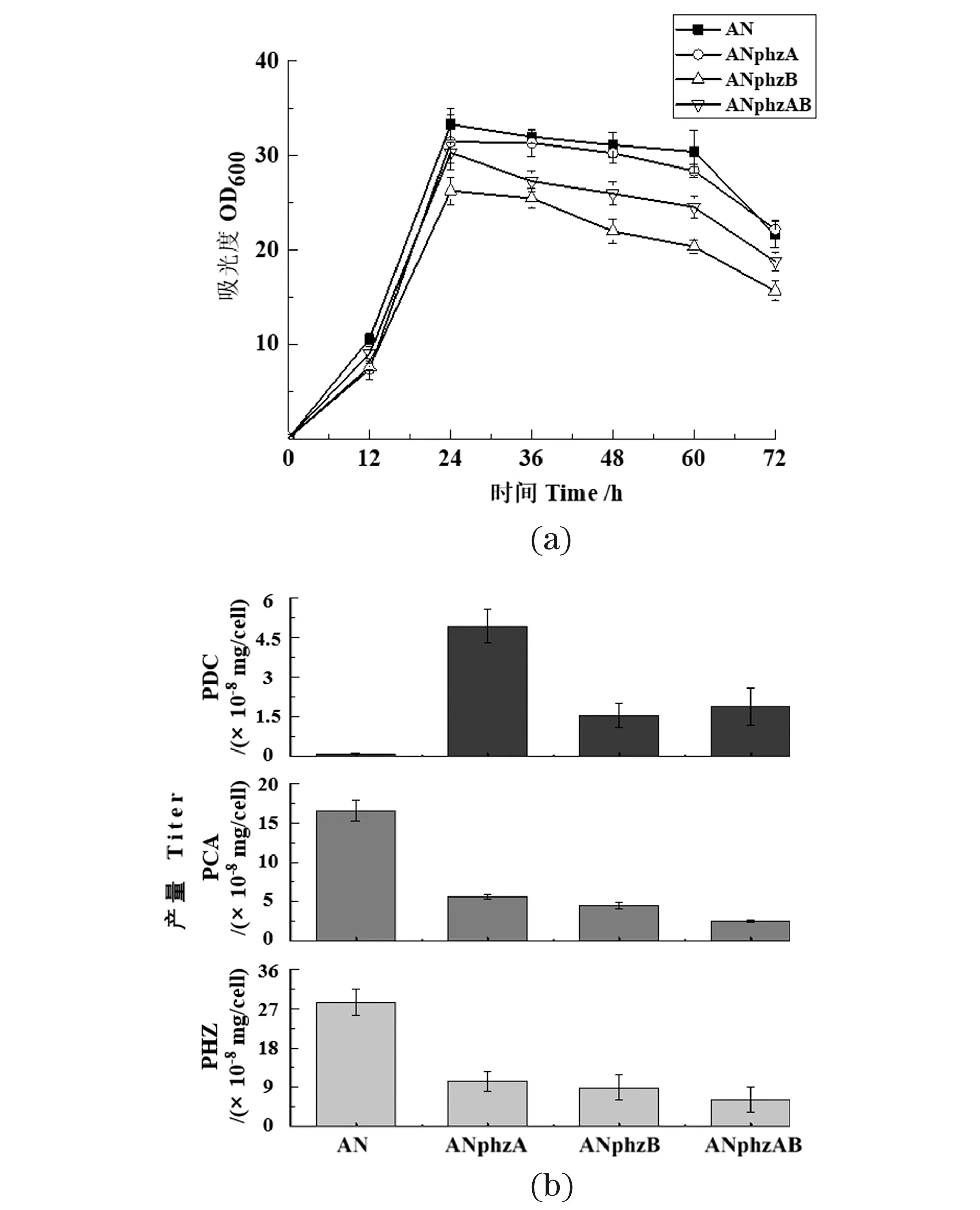
(a)敲除株的细胞生长密度;(b)敲除株在24 h单位细胞下吩嗪类化合物的产量测定(PHZ: 吩嗪类化合物总和)。图2 Pseudomonas chlororaphis GP72AN中phzA和phzB基因的敲除Figure 2 The deletion of phzA and phzB gene in Pseudomonaschlororaphis GP72
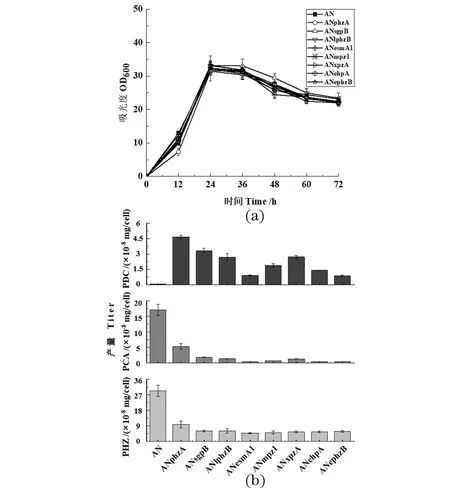
(a)敲除株的细胞生长密度;(b)敲除株在24 h单位细胞下吩嗪类化合物的产量测定(PHZ: 吩嗪类化合物总和)。图3 Pseudomonas chlororaphis GP72AN中其他来源phzB同时替换phzAB基因Figure 3 Other phzB gene replaced phzAB at the same time in Pseudomonas chlororaphis GP72AN
2.3.2 异源同源基因phzA对内源phzA基因的单独替换
通过同源重组的方法将phzA1与phzA2基因分别替换至内源phzA基因的所处位点,将其命名为GP72ANphzA1与GP72ANphzA2。生长曲线和发酵产物测定结果显示,异源phzA基因替换对细菌生长影响很小[图 4(a)]。突变株GP72ANphzA1与GP72ANphzA2都不能合成PDC,而其他吩嗪类化合物产量则有一定提升[图 4(b)]。此外,虽然PhzA不具备PhzB蛋白相同的催化活性[8],但为验证PhzA蛋白是否参与催化PDC进而生成PCA,通过体外实验在PDC中加入PhzA蛋白,结果表明,PhzA并不具备催化PDC转化为PCA的能力。总之,不同来源的PhzA蛋白功能相似,在吩嗪类化合物合成中起调控作用,促进前体流向PCA的合成。

(a)敲除株的细胞生长密度;(b)敲除株在24 h单位细胞下吩嗪类化合物的产量测定(Other PHZ: 除PCA外其他吩嗪类化合物总和)。图4 Pseudomonas chlororaphis GP72AN中其他来源phzA单独替换phzA基因Figure 4 Other phzA gene replaced phzA in Pseudomonaschlororaphis GP72AN
2.3.3 异源phzB基因对内源phzB基因的单独替换
GP72ANsgpB、GP72ANlphzB与GP72ANxpzA等3株突变株的PDC产量(图 3)较高,故将sgpB、lphzB与xpzA基因分别替换至phzB基因所处位点,命名为GP72ANsgpB-1、GP72ANlphzB-1和GP72ANxpzA-1。
生长曲线和发酵产物测定结果显示,异源phzB基因替换对细菌生长影响小[图 5(a)]。GP72ANsgpB-1、GP72ANlphzB-1和GP72ANxpzA-1等3株突变株的发酵产物中都未检测到PDC的合成[图 5(b)],表明在存在PhzA蛋白的前提下,不同来源的PhzB蛋白都不能催化合成PDC,这再次证实PhzA蛋白能促使优先合成PCA,而这3株突变株PCA及其衍生物产量的显著降低可能是异源PhzB蛋白的活性不足所导致的。
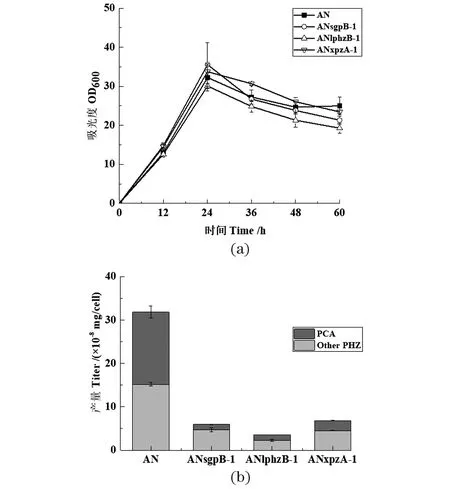
(a)敲除株的细胞生长密度;(b)敲除株在24 h单位细胞下吩嗪类化合物的产量测定(Other PHZ: 除PCA外其他吩嗪类化合物总和)。图5 Pseudomonas chlororaphis GP72AN中其他来源phzB单独替换phzB基因Figure 5 Other phzB gene replaced phzB in Pseudomonaschlororaphis GP72AN
2.4 PhzA和PhzB蛋白结构分析
为验证体内敲除与替换实验的结果,将不同来源的PhzA/B蛋白氨基酸序列进行比对(图 6)。通过分析已知PhzB蛋白结构,确定可能参与催化过程的16个氨基酸[8],其中有9个位点在不同的PhzA/B蛋白之间完全相同。在剩余的7个氨基酸中,第83位PhzA蛋白都是亮氨酸而PhzB蛋白都是组氨酸,第87位PhzA蛋白都是亮氨酸而PhzB蛋白都是丝氨酸,第122位PhzA蛋白都是缬氨酸而PhzB蛋白都是苯丙氨酸,第130位PhzA蛋白都是半胱氨酸而PhzB蛋白都是酪氨酸,第134位PhzA蛋白都是酪氨酸而PhzB蛋白都是苯丙氨酸;第157位PhzA蛋白有谷氨酰胺与赖氨酸两种而PhzB蛋白都是谷氨酰胺,第175位PhzA蛋白有丙氨酸与苏氨酸两种而PhzB蛋白有苏氨酸与丝氨酸两种。比对结果表明:不同的PhzA蛋白之间,不同的PhzB蛋白之间,PhzA与PhzB之间的同源性都较高,差异都非常小。不同来源的PhzB蛋白只有在第175位的氨基酸有较小差异,不同来源的PhzA也仅在第157位与第175位的氨基酸有区别,这表明PhzA与PhzB两个蛋白各自的保守性都较高,催化反应的能力相似。第83、87、122、130、134和157位氨基酸的不同可能是导致PhzA蛋白不具有PhzB相同催化活性的原因。
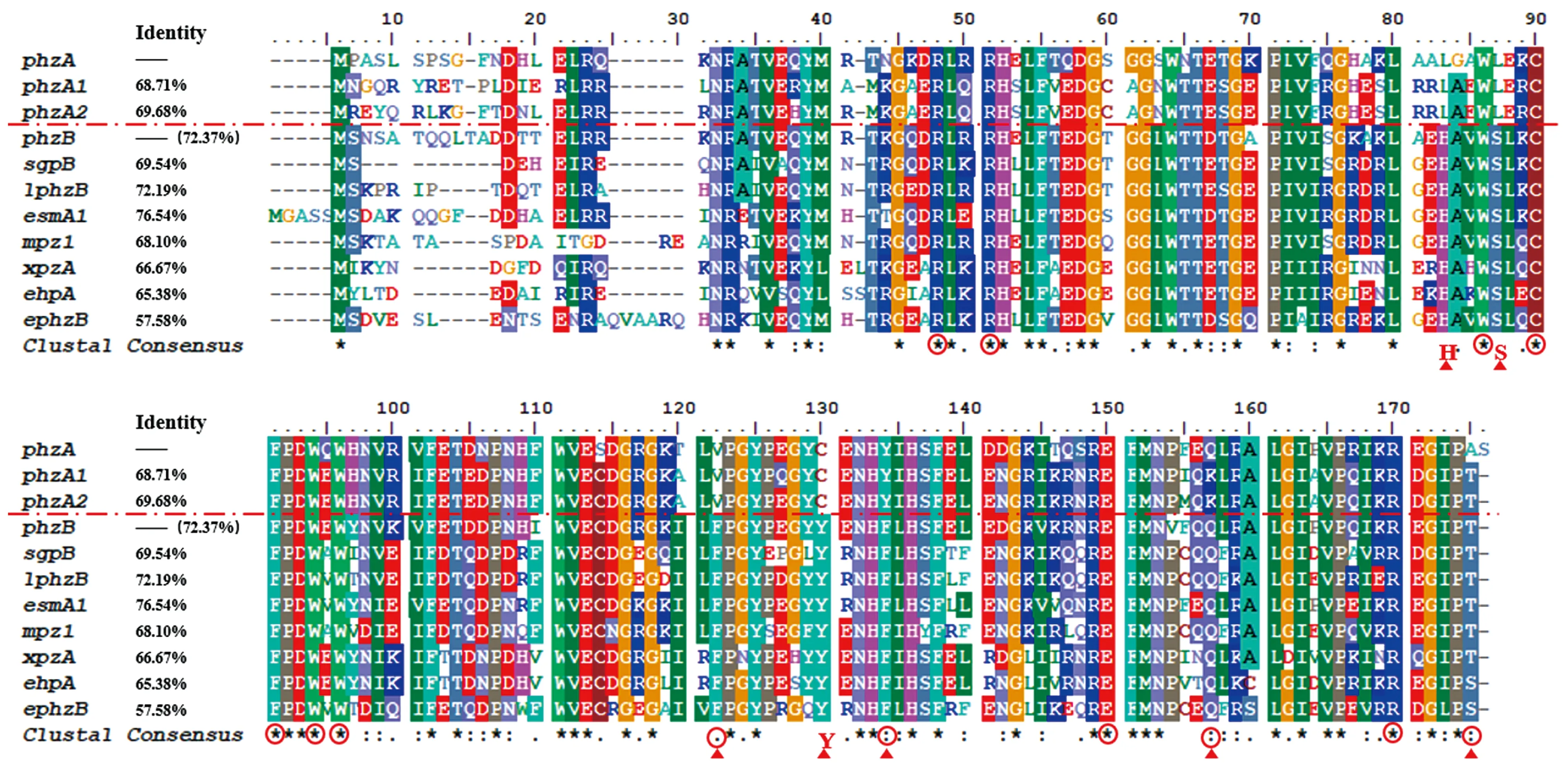
Identity为不同来源PhzA/B蛋白之间的同源性;16个活性氨基酸用红色字符表示;★为不同来源的PhzA/B在此处氨基酸完全相同;▲为不同来源的PhzA/B在此处氨基酸存在差异。图6 不同来源PhzA/B蛋白的氨基酸组成分析Figure 6 Analysis of amino acid composition of PhzA/B from different bacteria
使用SWISS-MODEL进行蛋白同源建模,其中,PhzA、PhzA1、PhzA2、PhzB、SgpB、EsmA1、XpzA和EhpA以3FF0[17]为模板,LphzB、Mpz1和EphzB以3JUQ[18]为模板,分别对这些PhzA和PhzB蛋白进行结构模拟。通过将建立好的蛋白模型进行比对分析发现:不同来源PhzB蛋白的模拟结构模型在一些位点或结构域存在差异[图 7(a)],可能导致不同PhzB蛋白之间催化合成PDC的活性存在差异。PhzA和PhzB蛋白的结构对比发现,PhzA缺少相应的活性氨基酸位点[图 7(b)],导致其虽然与PhzB结构高度相似,但却没有PhzB蛋白相同的催化活性。
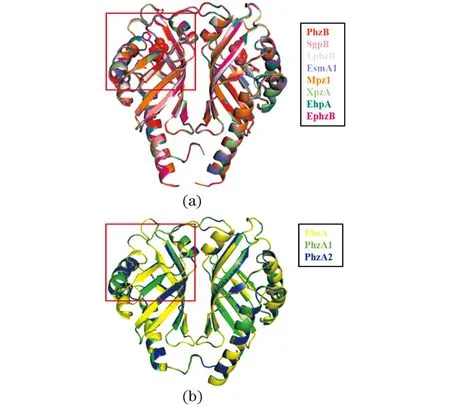
(a)不同来源的PhzB蛋白;(b)不同来源的PhzA蛋白。图7 不同来源PhzA和PhzB蛋白模拟结构模型比对Figure 7 Comparison of simulated structure model of PhzA and PhzB proteins from different bacteria
3 讨论与结论
目前,参与吩嗪类化合物合成的一系列基因与酶已基本确定,但吩嗪-1,6-二羧酸(PDC)和吩嗪-1-羧酸(PCA)最终的合成机制仍然未有明确的阐释,为何类似的合成基因簇,有的合成PCA,有的合成PDC。有研究推测:PhzB蛋白可能在聚合两分子的6-氨基-5-氧代环己基-2-烯-1-羧酸(AOCHC)后,对其进行分子内结构重排生成PCA与PDC的前体二亚胺六氢-吩嗪-1,6-二羧酸(HHPDC)[8]。此外,也有研究推测,PhzA、PhzB与PhzG 3个蛋白共同参与了PDC与PCA的最终合成[15,19],三者之间不同的蛋白比例可能影响PDC或PCA的产量[8]。同时,PhzA蛋白虽然与PhzB的同源性很高,但没有与PhzB相同的催化能力,其具体功能仍需深入研究。
通过比对筛选并合成不同来源的phzA与phzB基因,再通过代谢工程手段对不同phzA/B基因进行敲除与异源同源基因替换,分析其合成的吩嗪类化合物组成及产量,最后比对分析对应蛋白的活性位点之间差异并进行系统分析。我们发现敲除phzA能使PDC产量显著提升,且远高于双敲phzAB的突变株,但同时缺少PhzA与PhzB仍然能发现少量PCA和PDC的合成,这表明在PCA或PDC的合成中PhzA/B蛋白并不是必需的,两个吩嗪前体有自发合成的可能。其中,PhzA和PhzB均对吩嗪类化合物的合成具有明显的正调控作用,而PhzB可能对PDC的合成有更好的增效。通过同源重组的方法分别将7个异源的phzB基因替换内源的phzAB基因,7株突变株的次级代谢产物中都检测到PDC的合成,表明不同来源的PhzB蛋白都具有相似的活性,能催化PDC的合成,体外PhzB酶促反应的结果也验证了不同PhzB蛋白都能够促进PDC的合成。单独将两个异源phzA基因分别替换内源phzA基因,并用3个异源phzB基因分别替换内源phzB基因,5株突变株的次级代谢产物中都未能检测到PDC的合成,表明不同来源的PhzA蛋白都具有相同的调控作用:使中间代谢产物流向PCA的合成,这与Guo等[10]的研究结果一致。在关键的16个活性氨基酸位点处,PhzA/B蛋白之间的差异都较小,不同来源的PhzB蛋白只有在第175位的氨基酸有较小差异,不同来源的PhzA蛋白也仅在第157位与第175位的氨基酸有区别。同时,在第83、87、122、130、134和157位氨基酸的不同可能是导致PhzA与PhzB蛋白之间功能有差异的原因,这为后续PhzA的功能阐述指明了方向。通过蛋白结构模型的模拟,发现不同来源的PhzB蛋白结构中部分区域存在一定差异,这也解释了为什么不同PhzB蛋白催化合成PDC的活性之间存在差异。研究为后续阐明PCA和PDC的合成机制,并定向合成PDC或PCA奠定了一定的基础。

