循环轴向压缩应力增强基质依赖型组织工程骨骨再生能力的研究*
梁万元 胡文辉 丁海滨 李建美 董世武
目前,缺乏理想的成骨微环境和高成骨活性的骨修复材料是制约大段骨缺损治疗的瓶颈问题[1]。为解决该难点问题,本课题组前期建立了一种新的组织工程骨策略——基质依赖型组织工程骨(matrix-based tissue engineering bone,M-TEB),该方法是采用冻干的方式去除生长在骨支架材料上的种子细胞的活性,但保留种子细胞来源的基质成分的方式,构建得到功能化的组织工程骨材料[2]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是M-TEB中最常用的种子细胞,其在向成骨分化的过程中会伴随着骨保护素、骨形成蛋白2、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)等的变化,这些蛋白在骨重建过程中发挥着重要的作用[3-4]。同时,BMSCs已经被证实为一种机械敏感性细胞,调控其所处的力学微环境可以指导其定向谱系分化[5-8]。因此,构建适宜BMSCs 成骨分化所需的应力环境来促进其成骨分化,进而调控其基质蛋白的表达和分泌,最终改变M-TEB的骨再生能力是一种可行的途径。结合现有研究,本文选取幅度10 kPa、频率1 Hz的循环轴向压缩应力(cyclic axial compression stress,CACS)来模拟适宜BMSCs成骨分化的应力微环境,并设计了一种在CACS条件下制备M-TEB的方法,通过构建大鼠股骨缺损模型以评价在CACS 条件下制备的新型M-TEB 在骨再生方面的优势,再利用转录组测序和条件培养基体外诱导实验研究促成这一变化的具体机制。
1 材料与方法
1.1 实验动物
实验用到的C57BL/6小鼠(4 ~6周,30只)和SD大鼠(200 ~250 g,12只)均由陆军军医大学动物实验中心提供,实验过程中对动物的处置得到陆军军医大学动物伦理委员会的批准[SCXK(渝)20170002]。
1.2 主要仪器与试剂
细胞培养箱(Series ⅡWater Jacket,美国Thermo 公司);三维组织培养测试系统(ElectroForce 7000,美国TA仪器公司);扫描电镜(Crossbeam 340,德国蔡司公司);Micro-CT(SkyScan1276,美国Bruker 公司);骨支架材料(主要成分为羟基磷灰石和Ⅰ型胶原蛋白,型号:Re-2,奥精医疗科技股份有限公司);EGM-2MV培养基(美国Lonza公司);Quant-iT PicoGreen dsDNA试剂盒(美国Thermo公司);VEGFA Elisa试剂盒、CCK-8试剂盒、茜素红染色试剂盒(上海碧云天生物技术有限公司);ALP 染色试剂盒(北京索莱宝科技有限公司);贝伐单抗(美国MCE公司)。
1.3 实验方法
1.3.1 循环轴向压缩应力条件下M-TEB的构建与表征
(1)构建方法。课题组前期构建M-TEB是在静态条件下进行的,具体流程如图1C 上半部分所示,即将从C57BL/6小鼠骨髓腔内分离得到的BMSCs作为种子细胞[9],种植到骨支架材料(尺寸:3 mm×3 mm×3 mm)上,在静态条件下进行14 d共培养,再经过冻干处理后获得[10]。本文为了研究循环轴向压缩应力对M-TEB 骨再生能力的影响,将上述方法中14 d的静态培养过程改为14 d的动态培养,其他条件和操作保持不变。具体操作方法如下:每天将细胞支架复合体放入三维组织培养测试系统的组织培养仓内(见图1A),连续加载4 h、幅度10 kPa、频率1 Hz的CACS 刺激,其余时间放回细胞培养箱内的培养皿中进行培养。将静态条件下和动态条件下构建的M-TEB分别记为静态M-TEB和动态M-TEB。
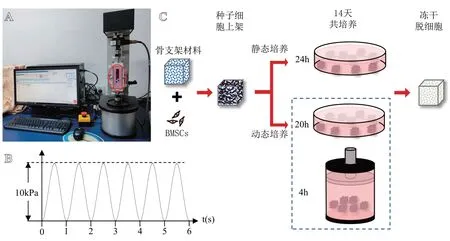
图1 三维组织培养测试系统及M-TEB构建流程图:A.三维组织培养测试系统(红色椭圆标示区域为组织培养仓);B.循环轴向压缩应力波形图;C.M-TEB的具体构建流程图
(2)M-TEB 表征。①DNA 残留量:用Quant-iT Pico‐Green dsDNA 试剂盒定量检测各组M-TEB 脱细胞前后的DNA浓度,以评价冻干法灭活细胞的效果;②基质沉积:用金靶溅射镀膜后,在扫描电镜下观察并记录材料表面的显微图片;③VEGFA蛋白浓度:根据VEGFA ELISA检测试剂盒说明对静态M-TEB和动态M-TEB中VEGFA浓度进行定量。
1.3.2 大鼠股骨缺损模型的构建与修复
(1)模型的构建与修复:在大鼠的股骨中上段钻出直径5 mm、深至髓腔的圆柱状骨缺损,随机分为3组,每组4 只进行干预。分别为:假手术组,在骨缺损处不植入任何材料;静态M-TEB 组,在骨缺损处植入静态M-TEB 材料(3 mm×3 mm×3 mm);动态M-TEB 组,在骨缺损处植入动态M-TEB材料(3 mm×3 mm×3 mm)。
(2)观察指标:术后8 周,进行Micro-CT扫描,观察缺损修复情况并计算骨密度(g/cm3)、骨体积百分比(%);并进行组织学检查(Masson 染色),观察骨缺损处新骨生成情况。
1.3.3 转录组测序(RNA-sequencing,RNA-Seq)
为研究CACS刺激对BMSCs生长、分化的影响,提取未经过脱细胞程序处理的静态M-TEB 和动态M-TEB 构建体中BMSCs 的RNA 进行RNA-Seq 分析[11],筛选出差异基因,并基于基因本体论(gene ontology,GO)数据库进行富集分析[12]。
1.3.4 条件培养基体外诱导实验
(1)条件培养基制备与分组:本部分实验共设置4 个组。利用静态M-TEB 和动态M-TEB 样品制备条件培养基[10],分别记为静态条件培养基组(即静态CM 组)和动态条件培养基组(即动态CM 组)。同时为了验证VEGFA是否在条件培养基中发挥关键作用,从上述两组条件培养基各取出一半并加入50 μg/mL 贝伐单抗(VEGFA 阻断剂),分别记为静态CM+Anti 组和动态CM+Anti 组。以下实验中,每组条件培养基均设置3个重复。
(2)内皮祖细胞(endothelial progenitor cells,EPCs)迁移和增殖实验。①迁移实验:将EPCs用EGM-2MV培养基重悬后接种到24孔Transwell小室上腔内,并在下腔加入条件培养基。24 h 后,利用DAPI 荧光染色检测迁移到Transwell小室滤膜下侧的细胞数。②增殖实验:分别用各组条件培养基对EPCs进行诱导培养,并在第1、3、7 d利用CCK-8法检测各组EPCs的增殖情况。
(3)BMSCs成骨诱导实验:分别用各组条件培养基对BMSCs进行诱导培养,并在第7 d检测碱性磷酸酶(ALP)活性和第21 d观察钙质沉积(茜素红染色法)水平,以评价BMSCs的成骨分化情况。
1.4 统计学方法
数据使用SPSS 18.0软件进行统计学分析。所有定量数据均以均数±标准差表示。两组差异比较采用t检验,多组差异比较采用单因素方差分析,组间两两比较采用Newman-Keuls法。P<0.05为差异有统计学意义。
2 结果
2.1 “冻干法”灭活细胞效果
DNA中携带大量的遗传信息,是造成组织工程移植物出现排斥反应的主要物质[13]。如图2所示,经过“冻干法”处理后,静态M-TEB和动态M-TEB中DNA的浓度相对于脱细胞前均显著降低(P均<0.001),说明本实验中采用的“冻干法”能较好地降解细胞中的DNA,达到了灭活细胞的目的,降低了后续体内移植免疫排斥的风险。
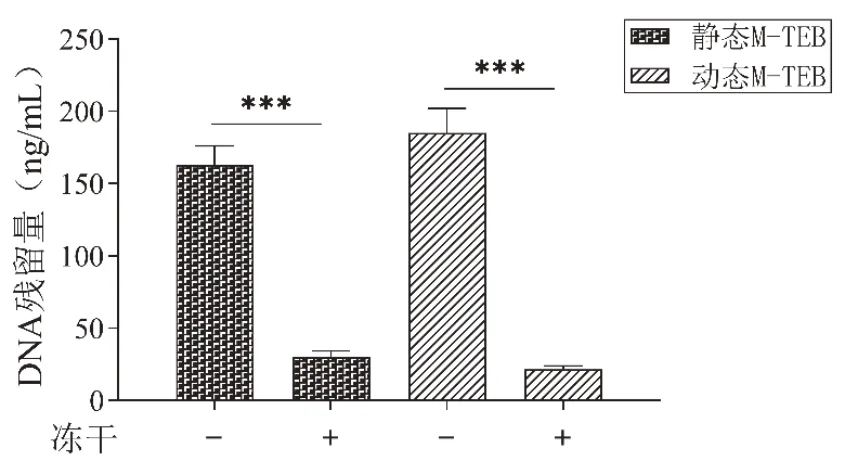
图2 各组M-TEB冻干前后DNA浓度定量结果
2.2 M-TEB电镜扫描结果
电镜扫描结果显示,动态M-TEB相比骨支架材料和静态M-TEB在材料表面明显覆盖有更为丰富膜片状细胞外基质结构(见图3),提示CACS刺激能够促进BMSCs在M-TEB 表面分泌和沉积更多的细胞外基质。

图3 M-TEB材料表面电镜扫描结果:A.骨支架材料(×500);B.静态M-TEB(×500);C.动态M-TEB(×500)
2.3 Micro-CT扫描结果
如图4所示,术后8周,假手术组新骨生成较少,骨缺损恢复情况较差;静态M-TEB组可见较多的新骨生成,但仍有小部分区域未被修复;动态M-TEB组则基本看不见明显的骨缺损,骨结构比较完整。分析骨体积分数和骨密度,动态MTEB组也明显优于假手术组和静态M-TEB组(骨体积分数分别为P<0.001,P<0.01;骨密度分别为P<0.001,P<0.01)。
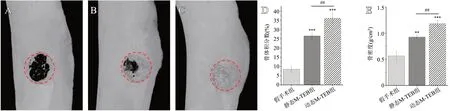
图4 股骨缺损处3D重建图像及参数分析:A-C.分别为假手术组、静态M-TEB组和动态M-TEB组3D重建图像,红色虚线区为原始骨缺损范围;D.三组的骨体积分数;E.三组的骨密度
2.4 组织学检查结果
Masson染色结果显示(见图5),假手术组骨缺损处多为纤维状组织,几乎没有新骨生成;静态M-TEB 组有一定量的新骨生成,但大部分仍为纤维状组织;动态M-TEB组中新生骨数量最多,仅有小部分的纤维状组织。实验结果证明,动态M-TEB 相比静态M-TEB 具有更强的新骨生成能力。
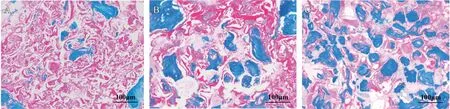
图5 骨缺损处组织切片Masson染色结果(×100):A.假手术组;B.静态M-TEB组;C.动态M-TEB组
2.5 转录组测序结果
对转录组测序结果进行分析,选择P<0.01 且|log2(FoldChange)|≥1 作为差异基因筛选阈值,如图6A 所示,动态M-TEB中BMSCs相较静态M-TEB有163个差异基因,其中123 个基因上调,40 个基因下调。聚类热图(见图6B)展示了排名前50 的差异基因在各个样本中的分布情况,结果显示差异基因的表达取决于BMSCs 是否受到CACS刺激。将差异基因进行GO富集分析,共富集出175个差异(q<0.01)GO 术语,观察前30 个差异GO 术语(见图6C)发现主要涉及MAPK 通路、细胞凋亡、血管生成等。统计各差异基因在前30 个差异GO 术语(见图6C)中出现的频次,发现VEGFA 出现28 次,位于所有差异基因中第1位,出现频次前10的差异基因分别为VEGFA(28次)、HMOX1(15次)、HSPH1(13次)、GDNF(12次)、HBEGF(11 次)、EPHA4(11 次)、SERPINE1(9 次)、FBXW7(9次)、GADD45B(8次)、MDM2(8次)。
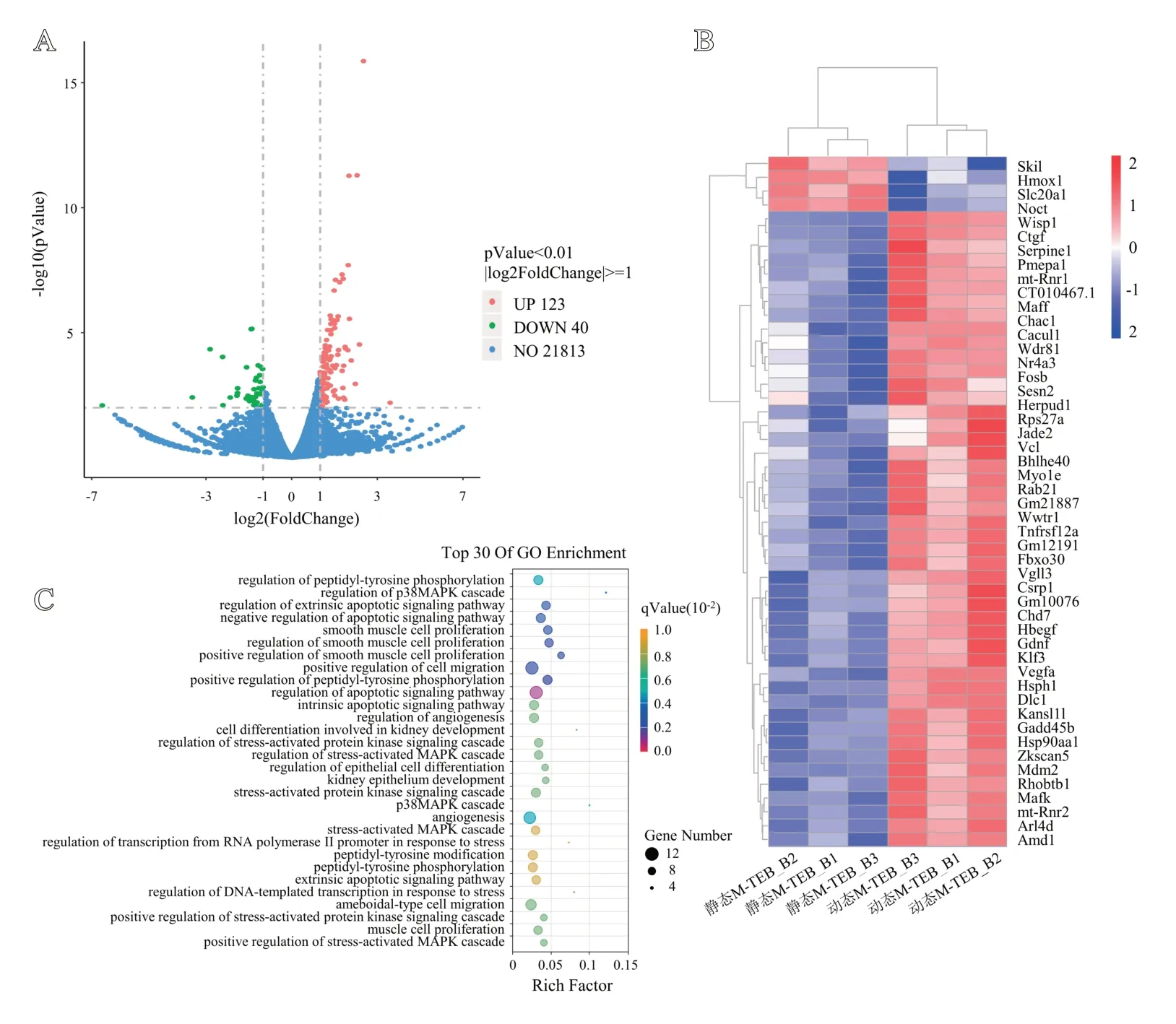
图6 转录组差异基因分析结果:A.差异基因火山图,红色点代表上调基因,绿色点代表下调基因,蓝色点代表没有显著改变的基因;B.前50个差异基因聚类热图,红色代表上调基因,蓝色代表下调基因;C.前30个具有显著性差异的GO术语
2.6 VEGFA的基因和蛋白表达水平
转录组测序结果显示,动态M-TEB中BMSCs的VEGFA基因表达量水平显著高于静态M-TEB中BMSCs(P<0.01);与之对应的Elisa检测结果显示,动态M-TEB中VEGFA蛋白浓度也显著高于静态M-TEB(P<0.01)(见图7)。
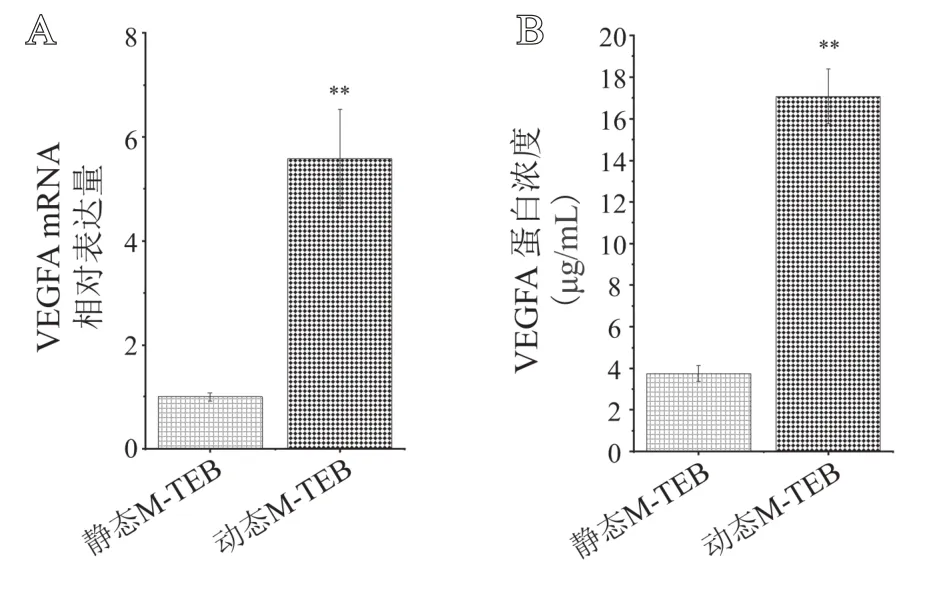
图7 VEGFA 的基因和蛋白表达水平:A.未经脱细胞的各组MTEB 中BMSCs 的VEGFA 基因表达水平(来源于转录组测序结果);B.两组M-TEB中VEGFA蛋白浓度
2.7 条件培养基体外诱导EPCs迁移和增殖
DAPI 荧光染色结果显示(见图8),动态CM 组诱导EPCs的迁移数相较静态CM组显著增加(P<0.05)。在诱导EPCs增殖的实验中,除了第1 d各组比较差异无统计学意义外(P均>0.05),在第4、7 d,动态CM组生长速率显著高于静态CM组(P均<0.001)。静态CM+Anti组和动态CM+Anti 组两组培养基诱导EPCs 迁移的能力相较静态CM 组显著降低(P均<0.05),但两组间差异无统计学意义(P>0.05),两组条件培养基诱导EPCs增殖的能力呈现出上述相同的趋势。实验结果表明,动态CM 组诱导的EPCs 相比静态CM 组具有更强的迁移和增殖能力,主要原因在于前者VEGFA浓度更高。
2.8 条件培养基体外诱导BMSCs成骨分化
如图9所示,动态CM组ALP染色阳性面积显著高于静态CM 组(P<0.05),茜素红染色结果呈相同趋势。而加入VEGFA抑制剂的两组,ALP染色阳性面积比较差异无统计学意义(P>0.05),且显著低于静态CM组(P均<0.05),茜素红染色结果呈现出一致的结果。实验结果表明,动态M-TEB组相比静态M-TEB组具有相对更高浓度的VEGFA,因而表现出更强的促进BMSCs成骨分化的能力。
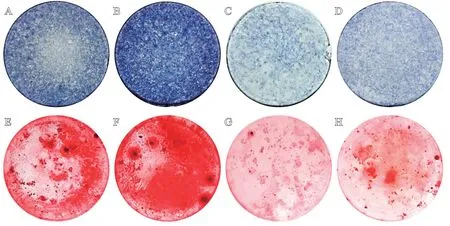
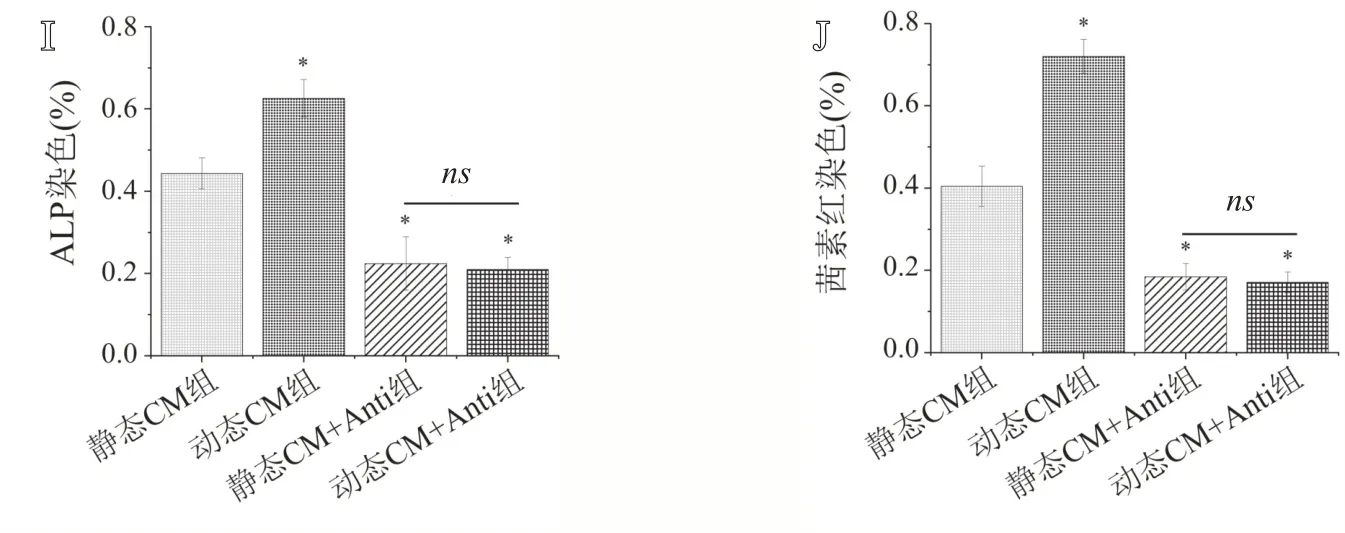
图9 条件培养基体外诱导BMSC成骨分化结果:A-D.分别为静态CM组、动态CM组、静态CM+Anti组和动态CM+Anti组条件培养基诱导的BMSCs成骨分化7 d后的ALP染色结果;E-H.分别为上述4组条件培养基诱导的BMSCs成骨分化21 d后的茜素红染色结果;I.ALP染色阳性区域百分比统计结果;J.茜素红染色阳性区域百分比统计结果
3 讨论
本文主要研究循环轴向压缩应力对M-TEB骨再生能力的影响。构建M-TEB 所使用的骨支架材料具有较强的刚性,直接对其加压会破坏其稳定结构,达不到对BMSCs进行应力刺激的目的。本研究采用CACS 对密闭仓内液体加压的形式,在不影响骨支架材料结构的前提下,可将应力通过液体传递到骨支架材料上的BMSCs。10 kPa是人体在无负荷情况下肌肉收缩引起的骨髓腔内最大的生理压力,已被证实可促进BMSCs 成骨分化[14];而1 Hz 是正常人体生理活动所生产的频率[15],有利于细胞保持正常的增殖活性。故本文最终选择10 kPa 幅度、1 Hz 频率的CACS 作为M-TEB构建过程中的应力刺激条件。
现有的研究表明,适当的机械负荷刺激对骨组织工程功能化的实现是有益的。Luo 等[16]将人骨髓间充质干细胞接种到脱钙骨支架材料上进行流体动力学培养,发现相比于传统的静态培养,前者的细胞密度、ALP活性更高且生成更多的细胞外基质,植入裸鼠皮下后,有更多的新骨生成和更高的骨密度。Duty等[17]则是对植入大鼠体内的骨移植物加载间歇性压缩应力(每周3 次,每次30 min,幅度为13.3 N,频率为1 Hz),6周后发现,相比未进行力学干预的组,力学干预组的骨矿化量明显更高。本文在CACS条件下构建得到动态M-TEB,相比静态M-TEB,前者在材料表面包裹有更为丰富的膜片状细胞外基质结构,且在大鼠股骨缺损模型中表现出更强的骨再生能力,说明在M-TEB构建过程中CACS刺激的加入增强了M-TEB骨再生能力。
MAPK 通路在细胞感受外界机械刺激中发挥着重要作用,静水压力、流体剪切力等通过激活MAPK 通路触发MSCs成骨分化相关基因表达[18-19]。同时,生理水平的层流剪切应力刺激会抑制MSCs 的凋亡[20],而周期性机械拉伸则通过增加抗凋亡相关基因的表达显著阻止细胞数量的减少[21]。本文GO 富集结果显示,BMSCS 受到CACS 刺激后,在MAPK 通路、细胞凋亡方面发生显著改变,提示CACS在调控BMSCs成骨分化、抗凋亡等方面与其他形式机械负荷具有同等的作用。
BMSCs 在成骨分化过程中可以通过旁分泌VEGFA 的形式促进血管内皮细胞的增殖、存活和迁移,从而促进血管生成[22-23]。本文GO 富集分析结果显示,BMSCs 受到CACS 刺激后在血管生成等方面发生改变,与上述报道相符合。进一步分析发现,VEGFA是前30个差异GO术语中出现频次最高的上调差异基因,且动态M-TEB 中VEGFA的蛋白浓度显著高于静态M-TEB,证实CACS 通过促进BMSCs 中VEGFA 基因和蛋白的表达,进而提高动态MTEB 中VEGFA 蛋白浓度。VEGFA 作为一种高度特异性的促血管内皮细胞生长因子,具有促进血管内皮细胞迁移、增殖和血管形成等作用[24-25]。本实验中,动态M-TEB 中VEGFA 的浓度更高,预示其具有更强的促血管生成能力,条件培养基体外诱导实验证明了这一猜想。血管生成和骨生成这两个过程的耦合在骨再生中发挥了重要的作用[26-27]。在实验中还发现动态M-TEB来源的条件培养基具备更强的促进BMSCs 成骨分化的能力,阻断实验证明VEGFA 在其中发挥关键作用。综上可以推断,动态M-TEB中具有更高浓度的VEGFA,因而在植入大鼠股骨缺损处后,其释放的VEGFA以促进血管生成和骨生成过程的耦合,最终促进了骨缺损处的骨重建。
综上所述,CACS 刺激促进BMSCs 中VEGFA 的表达和分泌,提高了M-TEB 材料中VEGFA 浓度,最终使动态M-TEB在大鼠股骨缺损模型中表现出更强的骨再生力。本文提出的基于CACS的M-TEB构建方法既是增强组织工程骨的骨再生能力的一种可行方式,也为解决组织工程骨血管化难题提供了一种新的思路。

