4种中药单体与丁酸钠诱导猪宿主防御肽表达的协同效果研究
储 蓄,张军霞,王 晶
(1.北京市农林科学院畜牧兽医研究所,北京 100097;2.青海大学农牧学院,西宁 810016;3.北京市农林科学院-美国俄克拉荷马州立大学动物科学联合实验室,北京 100097)
动物生产中抗生素的滥用已成为重大公共安全问题,严重危害动物和人类健康。因此,通过营养手段提高机体免疫力和抗病毒能力成为目前畜禽替抗研究的热点之一。宿主防御肽(host defense peptides,HDPs)又称抗菌肽(antimicrobial peptides,AMPs),是一种具有抗菌、抗病毒和调节机体免疫力等多种功能的小分子肽[1]。猪源HDPs发现较早,主要分为Cathelicidin和Defensin两大家族。研究发现,HDPs具有抗炎抑炎[2]和抑制细菌真菌增殖[3]等能力,且HDPs不易产生耐药性[4],这些特性使得HDPs成为一种潜在的抗生素替代物,用以增加动物机体免疫力。目前体外合成HDPs价格较昂贵,还存在稳定性差、易酶解等问题,而通过营养物质调控机体产生内源HDPs是提高机体免疫的可能途径之一。近年来研究发现,维生素、脂肪酸、益生菌、氨基酸、矿物质等均能诱导内源性HDPs的表达[5-6]。
丁酸是一种挥发性脂肪酸,主要由机体肠道中一些特定的微生物发酵产生[7]。研究发现,丁酸钠可显著增加猪肾细胞(PK-15)中pBD3、pBD128、pBD123、pBD115和pEP2C基因的表达,且不引起炎症反应[8];而在仔猪饲粮中添加0.2%的丁酸钠,也可显著增加仔猪回肠和结肠pBD2和pBD3基因的表达,减轻仔猪炎症反应,并降低粪便中产肠毒素性大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)含量[9]。丁酸钠与某些HDPs诱导剂之间存在一定的协同效应,如丁酸钠与渥曼青霉素、橡精和粉防己碱可协同诱导鸡巨噬细胞β防御素9(AvBD9)基因的表达[10];同时饲喂毛喉素和丁酸钠也可协同诱导鸡嗉囊和空肠中AvBD9基因的表达[11]。北京市农林科学院畜牧兽医研究所动物营养研究室在前期开展的高通量筛选研究中,从1 261个天然产物化合物中筛选出黄腐酚(xanthohumol)、异丹叶大黄素(isorhapontigenin)、去氧紫草素(deoxyshikonin)和毛蕊异黄酮(calycosin)4种可明显诱导猪肠上皮细胞IPEC-J2和猪肺泡巨噬细胞3D4/31 HDPs表达的中药单体[12]。然而,这些中药单体与丁酸钠在诱导猪细胞HDPs表达方面是否具有潜在的协同作用尚不清楚。因此,为获得更多提高猪HDPs表达的可能,本研究拟对上述4种中药单体成分与丁酸钠在IPEC-J2和3D4/31细胞中是否对HDPs表达具有协同作用进行进一步研究,以期为动物生产实践中提高机体防御功能提供新方法和新思路。
1 材料与方法
1.1 材料
猪肠道上皮细胞IPEC-J2和猪肺泡巨噬细胞3D4/31均由美国俄克拉荷马州立大学馈赠;ETEC(F4+ETEC),血清型O149∶K91,购自国家兽医微生物菌种保藏中心。丁酸钠(sodium butyrate)购自Sigma公司;黄腐酚(C21H22O5)、异丹叶大黄素(C15H14O4)、去氧紫草素(C16H16O4)、毛蕊异黄酮(C16H12O6)均购自Target Molecule公司;胎牛血清、DMEM/F12、RPMI 1640培养基均购自Gibco公司;RNAzol RT购自Molecular Research Center公司;iScriptTMcDNA试剂盒和iTapTMUniversal SYBR@Green Supermix试剂盒均购自Bio-Rad公司;Trypticase soy培养基购自Thermo公司。超净工作台、台式离心机、DS-11超微量光度计、QuantStudio 3 Real-Time PCR仪、超声细胞破碎仪、酶标仪。
1.2 IPEC-J2和3D4/31细胞培养
将IPEC-J2细胞接种于含有10%胎牛血清、1%双抗(100 μg/mL链霉素和100 U/mL青霉素)的DMEM/F12完全培养基,于37 ℃、5% CO2恒温培养箱内进行培养,待细胞汇合度为70%~80%时消化传代,并进行后续试验。
将3D4/31细胞接种于含有10%胎牛血清、1%双抗和1%丙酮酸钠的RPMI 1640完全培养基中,37 ℃、5% CO2恒温培养,待细胞汇合度为70%~80%时消化传代,并进行后续试验。
1.3 不同中药单体和丁酸处理对IPEC-J2和3D4/31细胞HDPs和细胞因子表达的影响
取生长状态良好的IPEC-J2和3D4/31细胞分别按1.25×105和4×105/孔接种到12孔板中,在37 ℃、5% CO2培养箱中过夜培养,待细胞贴壁后处理细胞,37 ℃培养。试验所用化合物浓度均基于前期试验结果[12],均为诱导HDPs表达的最佳处理浓度。试验分为10组,具体分组信息见表1,每组3个复孔,试验重复3次。
培养24 h后,每孔加入250 μL RNAzol RT裂解细胞,提取总RNA,置于冰上保存。使用DS-11超微量光度计检测RNA浓度与纯度,A260 nm/A280 nm值在1.8~2.0,A260 nm/A230 nm值>2时,表明RNA纯度较高。按iScriptTMcDNA试剂盒说明书反转录获得cDNA。以GAPDH为内参基因,进行实时荧光定量PCR,测定HDPspBD2、pEP2C、pBD3、PG1-5基因及细胞因子白细胞介素-6(IL-6)、IL-1β基因的表达。实时荧光定量PCR所用引物序列参照前期研究结果[12],引物信息见表2。反应体系10 μL:iTaqUniversal SYBR Green Supermix 5 μL,cDNA 4 μL,上、下游引物各0.3 μL,无RNA酶H2O 0.4 μL。反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸20 s,共40个循环。反应结束后,用2-ΔΔCt法计算目的基因的相对表达量。
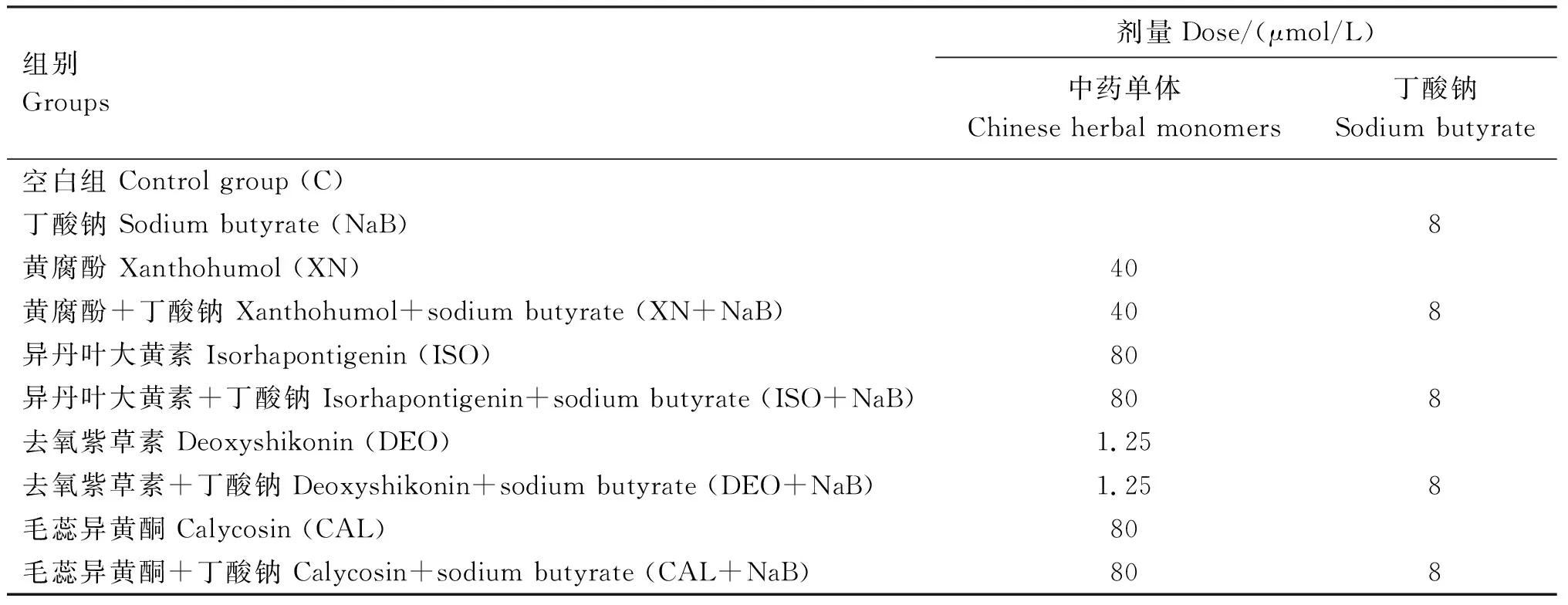
表1 试验设计及分组Table 1 Experimental design and grouping
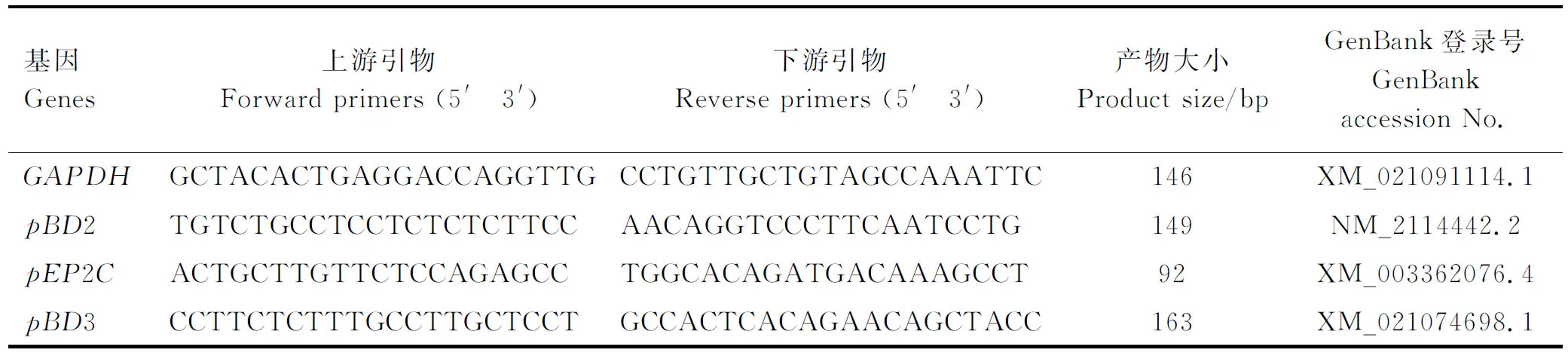
表2 实时荧光定量PCR引物信息Table 2 Primer information for Real-time PCR
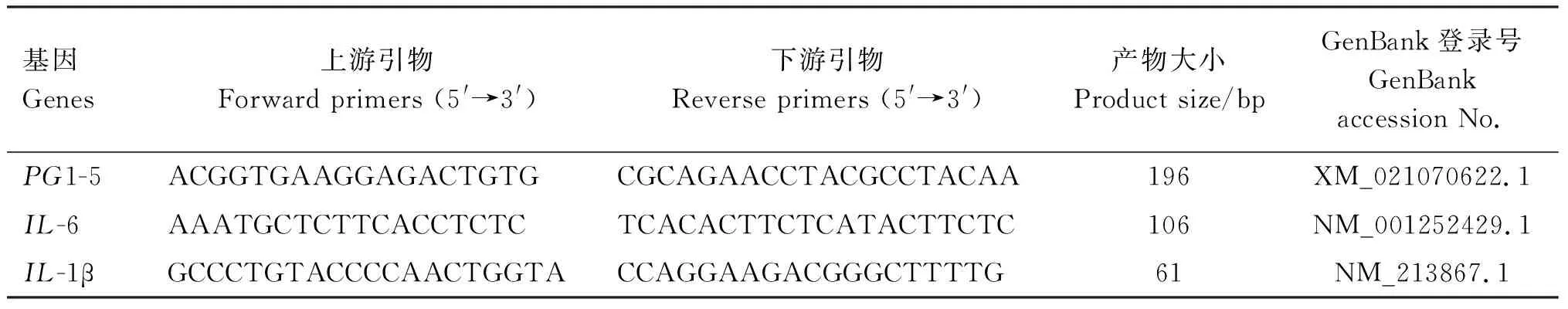
续表
1.4 不同中药单体和丁酸钠处理对3D4/31细胞抑菌活性的影响
将ETEC划线接种于Trypticase soy琼脂平板上,于37 ℃培养箱中过夜活化。挑取单菌落至液体Trypticase soy培养基中,37 ℃、250 r/min摇晃培养至对数生长期。配制含1 mmol/L NaH2PO4和25 mmol/L NaHCO3的溶液,并与Trypticase soy液体培养基1∶4混匀制备成稀释液,将ETEC稀释到2.5×105CFU/mL备用。
取生长状态良好的3D4/31细胞以每孔8×105个细胞均匀接种到6孔板中,37 ℃、5% CO2培养箱中过夜培养。按1.3方法处理细胞,培养24 h后,用HBSS平衡液清洗细胞,之后刮取细胞转移至1.5 mL离心管中,1 000 r/min离心10 min,弃上清,加入120 μL纯水重悬,于-80 ℃静置20 min,随后置于冰上5 min以裂解细胞。用超声细胞破碎仪对细胞进行再次裂解后,离心取50 μL上清裂解液与50 μL上述制备的ETEC菌液分别共同培养3、6、9和24 h,用酶标仪测定D600 nm值。
1.5 统计分析
试验数据采用Excel和SPSS 21.0软件进行统计分析,采用独立样本t检验法比较共同处理组与单独处理组间的差异。结果用平均值±标准误表示。P<0.05表示差异显著,P<0.01表示差异极显著。使用Origin 2019进行图表绘制。
2 结 果
2.1 不同中药单体和丁酸钠共同处理对IPEC-J2细胞HDPs表达的影响
由图1可知,黄腐酚与丁酸钠共同处理组的pEP2C基因表达量显著高于黄腐酚单独处理组(P<0.05),与丁酸钠单独处理组差异不显著(P>0.05);pBD2、pBD3和pG1-5基因表达量在黄腐酚与丁酸钠共同处理组与单独处理组间差异不显著(P>0.05)。异丹叶大黄素与丁酸钠共同处理组pBD3和pEP2C基因表达量极显著高于异丹叶大黄素及丁酸钠单独处理组(P<0.01);pBD2和PG1-5基因表达量极显著高于异丹叶大黄素单独处理组(P<0.01),但与丁酸钠单独处理组相比差异不显著(P>0.05)。去氧紫草素和丁酸钠共同处理组PG1-5基因表达量极显著高于去氧紫草素和丁酸钠单独处理组(P<0.01);pBD3基因表达量显著高于去氧紫草素和丁酸钠单独处理组(P<0.05);pBD2和pEP2C基因表达量均极显著高于去氧紫草素单独处理组(P<0.01),但与丁酸钠单独处理组差异不显著(P>0.05)。毛蕊异黄酮和丁酸钠共同处理组pBD2、pEP2C、pBD3和PG1-5基因的表达均显著或极显著高于毛蕊异黄酮和丁酸钠单独处理组(P<0.05;P<0.01)。
2.2 不同中药单体和丁酸钠共同处理对3D4/31细胞HDPs表达的影响
由图2可知,黄腐酚和丁酸钠共同处理组与黄腐酚单独处理组相比,pEP2C和pBD3基因表达均差异不显著(P>0.05)。异丹叶大黄素和丁酸钠共同处理组pBD2和pEP2C基因表达量均显著高于异丹叶大黄素单独处理组(P<0.05);pBD3基因表达量极显著高于异丹叶大黄素单独处理组(P<0.01),但与丁酸钠单独处理组相比差异不显著(P>0.05)。去氧紫草素和丁酸钠共同处理组各基因表达差异均不显著(P>0.05),其他基因未表现增强效果。毛蕊异黄酮与丁酸钠共同处理组pBD3基因表达量分别极显著和显著高于毛蕊异黄酮单独处理组(P<0.01)和丁酸钠单独处理组(P<0.05);pBD2基因表达量极显著高于毛蕊异黄酮单独处理组(P<0.01),但与丁酸钠单独处理组差异不显著(P>0.05);PG1-5和pEP2C基因的表达与丁酸钠或毛蕊异黄酮单独处理组差异不显著(P>0.05)。
2.3 不同中药单体和丁酸钠共同处理对IPEC-J2细胞因子表达的影响
由图3可知,黄腐酚、异丹叶大黄素、去氧紫草素和毛蕊异黄酮与丁酸钠共同处理组IPEC-J2细胞IL-6基因表达量与对应的中药单体及丁酸钠单独处理组差异均不显著(P>0.05)。黄腐酚、毛蕊异黄酮与丁酸钠共同处理组IPEC-J2细胞IL-1β基因表达量较对应中药单体单独处理组显著升高(P<0.05),但与丁酸钠单独处理组差异不显著(P>0.05)。
2.4 不同中药单体和丁酸钠共同处理对3D4/31细胞因子表达的影响
由图4可知,黄腐酚和丁酸钠共同处理组3D4/31细胞IL-6基因表达量显著高于丁酸钠单独处理组(P<0.05),但与黄腐酚单独处理差异不显著(P>0.05);异丹叶大黄素、毛蕊异黄酮和丁酸钠共同处理后3D4/31细胞IL-6基因含量显著低于各自单独处理组(P<0.05),但与丁酸钠单独处理组差异不显著(P>0.05)。黄腐酚、异丹叶大黄素、去氧紫草素、毛蕊异黄酮和丁酸钠共同处理组3D4/31细胞IL-1β基因表达量与各自单独处理组差异均不显著(P>0.05)。

①C,空白组;NaB,丁酸钠;XN,黄腐酚;ISO,异丹叶大黄素;DEO,去氧紫草素;CAL,毛蕊异黄酮。图2~4同。②共同处理组与丁酸钠组相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。共同处理组与对应的中药单体组相比,#,差异显著(P<0.05);##,差异极显著(P<0.01);无#,差异不显著(P>0.05)。图2~4及表3同 ①C,Control group;NaB,Sodium butyrate;XN,Xanthohumol;ISO,Isorhapontigenin;DEO,Deoxyshikonin;CAL,Calycosin.The same as fig.2-fig.4.②Compared with the sodium butyrate group,*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);No *,No significant difference (P>0.05).Compared with the corresponding Chinese herbal monomers group,#,Significant difference (P<0.05);##,Extremely significant difference (P<0.01);No #,No significant difference (P>0.05).The same as fig.2-fig.4,and table 3图1 中药单体与丁酸钠处理对IPEC-J2细胞HDPs表达的影响Fig.1 Effects of Chinese herbal monomers and sodium butyrate on expression of HDPs in IPEC-J2 cells

图2 中药单体与丁酸钠处理对3D4/31细胞HDPs表达的影响Fig.2 Effects of Chinese herbal monomers and sodium butyrate treatment on expression of HDPs in 3D4/31 cells

图3 中药单体与丁酸钠处理对IPEC-J2细胞因子表达的影响Fig.3 Effects of Chinese herbal monomers and sodium butyrate treatment on cytokines expression in IPEC-J2 cells

图4 中药单体与丁酸钠处理对3D4/31细胞因子表达的影响Fig.4 Effects of Chinese herbal monomers and sodium butyrate treatment on cytokine expression in 3D4/31 cells
2.5 不同中药单体和丁酸钠共同处理对3D4/31细胞抑制ETEC活性的影响
不同中药单体和丁酸钠共同处理对3D4/31细胞抑制ETEC活性的影响见表3。处理3 h时,去氧紫草素、毛蕊异黄酮和丁酸钠共同处理组与丁酸钠及对应中药单体单独处理组相比,ETEC存活率显著降低(P<0.05)。处理6 h时,异丹叶大黄素与丁酸钠共同处理组ETEC存活率显著低于丁酸钠单独处理组(P<0.05),但与异丹叶大黄素单独处理组差异不显著(P>0.05);毛蕊异黄酮与丁酸钠共同处理组较毛蕊异黄酮和丁酸钠单独处理组ETEC存活率分别显著和极显著下降(P<0.05;P<0.01)。处理9 h时,异丹叶大黄素、去氧紫草素、毛蕊异黄酮与丁酸钠共同处理组ETEC存活率均显著或极显著低于丁酸钠单独处理组(P<0.05;P<0.01),但与对应中药单体单独处理组没有显著差异(P>0.05)。处理24 h时,毛蕊异黄酮与丁酸钠共同处理组ETEC存活率分别显著和极显著低于毛蕊异黄酮和丁酸钠单独处理组(P<0.05;P<0.01);异丹叶大黄素、去氧紫草素与丁酸钠共同处理组ETEC存活率极显著低于丁酸钠单独处理组(P<0.01),但与对应中药单体单独处理组无显著差异(P>0.05)。

表3 不同中药单体和丁酸钠处理对3D4/31细胞抑制ETEC活性的影响Table 3 Effects of different Chinese herbal monomers and sodium butyrate treatment on the antibacterial activity of porcine 3D4/31 cells to ETEC
3 讨 论
3~8个碳的短链脂肪酸盐中,丁酸钠对IPEC-J2细胞HDPs调控作用最强,对pBD2、pBD3和pEP2C基因表达有明显诱导作用,长链脂肪酸盐的调控作用较弱[13]。低浓度丁酸钠(0.2~0.4 mmol/L)会促进IPEC-J2细胞的分化,而高浓度(0.5 mmol/L或更高)时则可能通过p38丝裂原活化蛋白激酶(MAPK)信号通路降低细胞活性并引发细胞凋亡[14]。窦秀静等[15]研究发现,丁酸钠对IPEC-J2细胞和PK-15细胞pBD3和pEP2C基因表达呈浓度和时间依赖效应,IPEC-J2细胞最佳浓度为4 mmol/L,最佳时间为24 h。实验室前期预试验结果表明,丁酸钠浓度为8 mmol/L时,诱导HDPs表达效果最优,因此后续试验中采用该浓度。此外,研究发现一些中草药活性成分与丁酸钠在人和鸡的相关研究中对HDPs表达有协同诱导作用[16-17],然而在猪上的协同表达效果鲜见文献报道。
本试验所用黄腐酚是一种从啤酒花中提取的戊基化类黄酮[18],具有抗病毒[19]、抗炎和抗氧化[20]等作用。研究发现,黄腐酚可与人乳腺癌细胞(MCF-7/6)中组蛋白H2A、H28和H4等靶点结合进而发挥抗癌作用,并推测黄腐酚可调节组蛋白的翻译后修饰,然而具体机制尚不清楚[21]。丁酸盐主要通过促进组蛋白H3乙酰化激活MAPK、JNK和Erk1/2信号通路,表达促炎细胞因子、趋化因子和β防御素[22]。本研究中,黄腐酚与丁酸钠单独处理可诱导猪IPEC-J2细胞HDPs表达,但并不表现协同效应,这是否和它们作用于不同的组蛋白位点有关还需进一步研究。
异丹叶大黄素是一类二苯乙烯类化合物,是白芦藜醇的甲氧基化类似物[23],具有抗炎和抗氧化的功能[24-26]。本试验结果表明,异丹叶大黄素与丁酸钠共同处理细胞对pBD2、pBD3和pEP2C基因的表达具有明显的协同效应。研究发现,丁酸盐和白芦藜醇均具有抑制癌细胞增殖和诱导癌细胞分化作用,两者同时作用可协同增强结肠腺癌细胞(Caco2)的分化,但没有协同抑制增殖的能力[27]。此外,研究人员还发现白芦藜醇4-羟基上修饰丁酸酯可更好地增强其抗癌活性[28]。另外,通过包被的方法,丁酸盐-白芦藜醇酯表现更稳定且有着更强的过氧化氢清除能力[29]。因此,推测异丹叶大黄素和丁酸盐也存在类似的协同作用,其中也包括对猪HDPs的诱导。此外,研究发现白芦藜醇可通过SIRT1(一种NF-κB的抑制剂)诱导人原发髓细胞HDPs基因的表达[30],王鑫[31]研究发现,丁酸钠通过NF-κB途径促进牛乳腺上皮细胞(MAC-T)宿主防御肽BMAP-34和DEFB1基因的表达。因此推测异丹叶大黄素与丁酸钠的协同表达作用也可能是通过调节NF-κB信号通路实现的,但这一推测还有待进一步证实。
去氧紫草素是一类天然萘醌类化合物,有较强抑制肿瘤细胞增殖和促进肿瘤细胞凋亡的功能[32]。本研究结果表明,去氧紫草素和丁酸钠共同处理IPEC-J2细胞可协同诱导PG1-5基因表达,共同处理3D4/31细胞时pEP2C基因的表达呈现协同效应。Yang等[33]发现去氧紫草素可增加组蛋白乙酰化水平,而熊海涛[34]也发现丁酸钠可通过抑制组蛋白去乙酰化酶活性以增加组蛋白乙酰化程度,进而诱导猪HDPs表达。因此,推测去氧紫草素和丁酸钠共同促进组蛋白乙酰化程度进而诱导细胞HDPs表达,并呈现协同效应。
毛蕊异黄酮是黄芪的主要药效成份,具有抗炎、抗氧化和抗肿瘤等作用[35-36]。Deng等[37]发现毛蕊异黄酮可通过调控IGF1R/PI3K/Akt、NF-κB和MAPK等信号通路,促进成骨细胞分化或抑制成骨细胞凋亡。而Dai等[22]发现丁酸盐可通过上调MAPK信号通路促进牛乳腺上皮细胞β防御素的表达。本试验结果表明,毛蕊异黄酮与丁酸钠可协同诱导IPEC-J2细胞pEP2C、pBD2、pBD3和PG1-5基因表达和3D4/31细胞pBD3和pEP2C基因的表达,但毛蕊异黄酮和丁酸钠是否通过同时作用于MAPK信号通路促进了HDPs的表达还需进一步验证。
丁酸钠和20 μmol/L维生素D3共同使用时可使IPEC-J2细胞pBD3 基因表达提高30倍[38],而丁酸钠和1,25二羟基VD3可使鸡AvBD9基因的表达量提高4 900倍[16],因此,不同物种可能影响HDPs的协同表达效果。本研究所涉及的4种化合物与丁酸钠的协同效果是否能在其他物种体现还需进行更多的研究。此外,化合物在诱导相同物种不同类型细胞HDPs的表达中也表现显著差异[39-40]。Zeng等[13]发现8 mmol/L丁酸处理后IPEC-J2细胞pBD2基因表达量提高了84倍,而在3D4/31细胞中仅为6.6倍。本试验前期研究也发现,本研究所涉及的4种化合物在不同细胞之间的表达量也存在差异。
丁酸不仅可给细胞提供能量,还对机体免疫反应具有调节作用。丁酸盐可调控新生仔猪回肠炎症因子IL-8、干扰素-γ(IFN-γ)和IL-1β基因的表达,对肠道健康有潜在的保护作用[41]。前期试验结果表明,本研究所用4种中药单体在诱导HDPs表达时,不会引起细胞明显的炎症反应[12]。本试验结果显示,丁酸钠与中药单体共同处理IPEC-J2细胞时与中药单体处理相比未引起IL-6基因表达的明显变化,但IL-1β基因表达量的变化可能由于丁酸钠的诱导效应发生相应的变化。IL-1β是细胞因子IL-1超家族成员,与IL-18结构相似[42]。研究发现,丁酸盐可激活IPEC-J2细胞中GPR109A(一种结肠中丁酸盐的受体)使得NOD样受体热蛋白结构域相关蛋白3(NLRP3)活化,进而诱导IL-1β基因表达[43-44],而NLRP3基因的表达产物正是IL-1β和IL-18的激活剂[45]。本研究中,中药单体与丁酸钠共同处理后IL-1β基因表达量与丁酸钠单独处理相近,因此,推测丁酸钠和中药单体共同处理IPEC-J2细胞时可能主要通过丁酸钠激活NLRP3诱导细胞因子表达。此外,研究结果显示,异丹叶大黄素、毛蕊异黄酮与丁酸钠共同处理3D4/31细胞,IL-6基因表达量显著低于异丹叶大黄素、毛蕊异黄酮单独处理;IL-1β基因的表达量也呈现类似趋势,但差异不显著。因此,推测异丹叶大黄素、毛蕊异黄酮和丁酸钠共同处理可一定程度缓解3D4/31细胞的炎性反应,但其作用效果和机制还需进一步探索。
由于缺乏猪HDPs的有效抗体,无法直接验证丁酸钠与中药单体是否在蛋白水平上对猪细胞有协同诱导HDPs的能力,本研究通过细胞抑菌能力的提升,间接证实丁酸钠与中药单体诱导细胞产生HDPs从而发挥抑菌作用的能力。ETEC是导致仔猪黄痢、白痢、水肿甚至死亡的主要原因,国内约有35%的仔猪因感染ETEC而导致腹泻,给养殖业带来了重大经济损失[46]。研究表明,丁酸钠可通过抑制组蛋白乙酰化酶活性,上调内源HDPs的表达,增强巨噬细胞3D4/2清除ETEC的能力[34],这表明丁酸钠可诱导细胞产生HDPs以抑制细菌生长。4种中药单体促进3D4/31细胞抑菌能力提升也已被前期研究结果证明[12]。本研究结果表明,除黄腐酚外,其他中药单体和丁酸钠单独或共同处理均可抑制ETEC的活性,其中毛蕊异黄酮与丁酸钠具有最佳协同效果,这与HDPs基因表达的结果趋势相同,说明中药单体与丁酸钠可通过协同诱导细胞产生HDPs以提高机体抗菌能力。
4 结 论
本研究结果表明,中药单体与丁酸钠可在一定程度上协同促进机体细胞产生HDPs以抑制ETEC等致病菌的生长,可为抗生素替代品的研究提供新的思路,并可为动物生产实践提供参考。需要注意的是,不同细胞系、不同物种对中药单体与丁酸钠的敏感程度有所不同,实际应用中需综合考虑并进行进一步的验证,此外,中药单体与丁酸钠发挥协同作用的内在机制也需进一步研究。

