辣木叶总黄酮对小鼠溃疡性结肠炎防治作用的研究
彭伟龙,HOSAMELDEEN Mohamed Husien,2,伯若楠,刘明江,杨海峰,李金贵
(1.扬州大学兽医学院,江苏省高校动物重要疫病与人畜共患病防控协同中心,扬州 225009;2.布尔塔那大学兽医学院,Rufaa 999129;3.江苏农牧科技职业学院,泰州 225300)
溃疡性结肠炎(ulcerative colitis,UC)是一种发生在人、犬、猫等物种中的非特异性、复发性结肠炎症疾病[1]。由于高脂饮食和不规律的生活作息,UC在发达国家人群发病率超过0.3%[2-3],据统计,近三十年中国UC发病率增加了近3倍[4]。目前UC的病因尚未完全阐明,但普遍认为其发病原因是基因、肠道菌群、宿主免疫和环境等多种因素造成的[5]。王瑞生等[6]研究表明,UC发病机制与肠屏障功能障碍和免疫异常密切相关。当肠黏膜屏障受损,肠道内有害菌及其代谢产物内毒素(LPS)进入血液,加剧机体炎症反应,上调白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、高迁移率族蛋白B1(HMGB1)等促炎因子的表达,此类因子激活后可与相应肠上皮细胞表面特异性受体结合,通过Caspase级联反应引起肠上皮细胞的异常凋亡,进而导致肠黏膜相关细胞数量变少[7]。同时,闭锁连接蛋白-1(ZO-1)和闭合蛋白(Occludin)等紧密连接蛋白与肠上皮细胞是肠黏膜屏障的关键组成部分,当肠上皮细胞数量减少时,紧密连接蛋白分泌量下降[8],进而导致肠屏障功能障碍。这提示针对炎性因子和肠黏膜屏障进行干预是防治UC的有效靶点。
辣木(Moringaoleifera)原产于印度,于2012年被中国卫生部批准认定为新资源食品,也是中国药食两用的食品资源,与灵芝和西洋参并称“世界三宝”[9],近年来大面积种植于中国云南地区。辣木叶在印度传统医学中主要用作消炎止痛药物,辣木叶膏药在印度被用来治疗腮腺炎[10],其水提取物在角叉菜胶诱导的大鼠足肿胀模型中有显著的抗炎和镇痛效果[11]。辣木叶中的主要活性成分是硫苷和黄酮[12],并且黄酮类成分发挥着显著的抗炎效果[13],但辣木叶对肠炎的防治效果却鲜有报道。本试验以葡聚糖硫酸钠(DSS)诱导的UC小鼠为模型,提取辣木叶总黄酮(Moringaoleiferaleaf flavonoids,MOLF)作为防治药物,通过对小鼠一般症状观察、测定血清与组织中炎性因子含量、检测肠黏膜蛋白表达量和肠上皮细胞凋亡蛋白表达情况来综合评估MOLF对UC小鼠体内炎症反应和肠黏膜屏障的改善效果,为MOLF的进一步开发利用提供思路。
1 材料与方法
1.1 MOLF的制备
辣木叶购自云南宁泽生物科技有限公司,取干燥辣木叶100 g研磨粉碎,石油醚40 ℃回流8 h,过滤后的辣木叶粉60 ℃烘干1 h后加入70%乙醇,料液比20∶1,超声功率300 W,提取时间25 min,提取液滤过后经旋转蒸发仪减压浓缩,回收乙醇至干,除去蛋白质、多糖等水溶性杂质,冷冻干燥48 h得MOLF。经大孔树脂分离纯化后以芦丁标准法测得MOLF含量为32.7 mg/g,配制成25、50、100 mg/kg MOLF提取液备用。
1.2 试验动物与处理
1.2.1 试验动物及饲养管理 体重为(20±2)g清洁级雄性BALB/c小鼠50只,购于扬州大学比较医学中心,许可证号为SYXK[苏]2017-0044,试验过程中小鼠均饲喂专用鼠粮(购自江苏协同医药生物工程有限责任公司),自由采食与饮水,环境温度为(24±2)℃,相对湿度为(60±10)%。试验程序均符合扬州大学动物福利委员会的标准。
1.2.2 试验动物分组与处理 试验小鼠称重并随机分成5组,每组10只,分别为对照组(control)、DSS组(模型组)、MOLF-L组(25 mg/kg)、MOLF-M组(50 mg/kg)、MOLF-H组(100 mg/kg)。小鼠连续7 d自由饮用4% DSS(W/V)诱导UC模型,期间药物处理组每天1次灌服0.2 mL不同浓度的MOLF提取液,对照组和模型组灌服无菌生理盐水给予相同刺激。
1.3 主要试剂及仪器
1.3.1 主要试剂 DSS(MW:36000-50000)购自MP Biomedicals公司;PAS染色试剂盒购自北京索莱宝科技有限公司;小鼠IL-1β、IL-10、TNF-α、HMGB1 ELISA试剂盒均购自上海酶联生物科技有限公司;LPS检测鲎试剂盒购自厦门鲎试剂生物科技有限公司;抗体ZO-1(40-2200)、Occludin(40-4700)均购自Invitrogen公司;Cleaved-caspase 3(Asp175,9661)、Bcl-2(3498)、Bax(2772)、β-actin(4970)均购自CST公司;FITC标记山羊抗兔二抗和Cy3标记山羊抗兔二抗均购自北京碧云天生物技术有限公司。
1.3.2 主要仪器 石蜡切片机(RM2125RTS)和正置荧光显微镜(DM2500)均购自Leica公司;Epoch 酶标仪购自Biotak公司;荧光定量PCR仪购自Bio-Rad公司;ChemiScope化学发光成像系统购自上海勤翔科学仪器有限公司。
1.4 测定指标及方法
1.4.1 小鼠体重变化、疾病活动指数(DAI)评分与结肠长度的测定 每天在小鼠进行药物处理前称重,计算末次给药前体重与初始体重的比值,得到小鼠平均体重变化率(%);每天观察小鼠的粪便黏稠程度并用联苯胺冰醋酸法检测粪便是否隐血或者带血,进行DAI评分(DAI评分是对动物体重减轻情况、粪便黏稠度和直肠出血情况的综合评价,通常作为评估结肠炎患者临床进展的指标[14]),评分标准见表1。试验结束后用脱颈椎的方式处死小鼠,剪取距盲肠0.5 cm至距肛门1 cm处完整的结肠并测量其长度。

表1 疾病活动指数评分标准Table 1 The criterion for judgement of disease activity index
1.4.2 组织病理学观察 取小鼠结肠组织,在4%多聚甲醛溶液中固定48 h后,再经脱水、透明、浸蜡、包埋、修蜡、切片,一部分经HE染色后置于显微镜下拍照观察;另一部分按照PAS染色试剂盒说明书步骤进行操作,中性树胶封固后置于显微镜下观察。
1.4.3 血清中IL-1β、IL-10、TNF-α、HMGB1和LPS含量 处死小鼠前从眼眶静脉丛采集血液,在室温条件下自然凝固10~20 min,4 ℃、3000 r/min离心10 min,收集上清,采用ELISA方法测定小鼠血清中IL-1β、IL-10、TNF-α、HMGB1含量,使用鲎试剂盒(试管定量显色基质法)检测小鼠血清中LPS含量。
1.4.4 结肠组织中IL-1β、IL-10、TNF-α和HMGB1 mRNA表达水平 剪取100 mg冻存的结肠组织置于EP管中,采用Trizol试剂提取总RNA,调整浓度至75 μg/μL。随后用反转录试剂盒制备cDNA,以其为模板进行实时荧光定量PCR扩增,引物序列见表2。按照荧光定量试剂盒说明书预混20 μL反应体系进行检测,反应程序:95 ℃ 2 min;95 ℃ 10 s,58 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以β-actin为内参基因,采用2-△△Ct法进行相对定量分析。

表2 引物信息Table 2 Primer information
1.4.5 结肠组织中ZO-1和Occludin表达水平测定 利用免疫荧光法检测小鼠结肠中ZO-1和Occludin表达水平。取固定的小鼠结肠组织样本制备冰冻切片,脱蜡后使用修复液(枸橼酸缓冲液,pH 6.0)进行抗原修复,5% BSA 37 ℃封闭1 h,对不同组织切片滴加稀释后的一抗ZO-1(1∶100)和Occludin(1∶100),4 ℃孵育过夜,次日加入绿色荧光标记二抗(1∶200)和红色荧光标记二抗(1∶200),37 ℃避光孵育2 h;最后DAPI染核5 min,封片后置于倒置荧光显微镜下观察并拍照。
1.4.6 肠上皮细胞凋亡相关蛋白相对表达量检测 将组织剪碎后加入裂解液裂解,充分匀浆后离心收集上清液,以BCA定量法测定上清液蛋白浓度,然后将上清液置于沸水中10 min使蛋白变性,取10 μL液体进行凝胶电泳,电转至PVDF膜,封闭后分别使用Cleaved-caspase 3、Bcl-2、Bax抗体(1∶1 000)4 ℃过夜孵育;加入二抗(1∶5 000)室温孵育2 h,PBST洗3遍后使用ECL显影检测蛋白表达,以β-actin为内参,利用Image J软件分析蛋白条带灰度值,目的蛋白相对表达量以目的蛋白条带灰度值/β-actin条带灰度值表示。
1.5 数据统计分析
采用Graphpad 8.0.2软件统计分析,采用独立t检验进行组间差异分析,试验结果用平均值±标准误表示,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 MOLF对UC小鼠体重、疾病活动指数和结肠长度的影响
由表3可知,在试验结束时,除对照组小鼠体重稳定增加外,DSS组小鼠体重较初始体重明显降低,与对照组相比差异极显著(P<0.01);MOLF-M和MOLF-H组小鼠体重接近于初始体重,体重变化率均显著高于DSS组(P<0.05)。
同时,除对照组小鼠DAI指数始终处于低水平外,其他组小鼠DAI指数均有不同程度增加,尤其是DSS组小鼠DAI评分极显著高于对照组(P<0.01);MOLF处理降低了DSS诱导的DAI评分,其中MOLF-H组的DAI评分与DSS组相比差异极显著(P<0.01)。
剖检发现,DSS组小鼠的结肠发生明显萎缩,长度极显著低于对照组(P<0.01);相较于DSS组,MOLF处理后小鼠结肠长度得到明显改善,尤其是MOLF-M和MOLF-H组的结肠长度极显著增加(P<0.01)。

表3 各组小鼠平均体重变化率、疾病活动指数和结肠长度Table 3 Average weight change rate,DAI and colon length of UC mice in each group
2.2 MOLF对小鼠结肠组织病变和杯状细胞数量及其形态结构的影响
由图1A可知,对照组结肠组织未观察到明显坏死,其黏膜上皮结构和肠隐窝等结构完整,中性粒细胞呈散在性分布。DSS组小鼠黏膜下层明显水肿(▲所示位置),肠隐窝结构被破坏、变形、排序紊乱,黏膜层和黏膜下层有大量炎性细胞浸润(※所示位置),少数可达肌层,并伴有上皮细胞坏死和脱落;MOLF-L组肌层出现水肿,有较多炎性细胞浸润,肠隐窝结构不规则;MOLF-M组肠腺结构正常,肠绒毛形态完整,少量中性粒细胞浸润;MOLF-H组腺体层次清晰可见,固有层结构正常,肌层也无明显异常。
由图1B可知,对照组结肠组织杯状细胞数量充足,形态结构正常;DSS组杯状细胞数量极少(→所示位置),形态发生变化,出现空泡状结构;与DSS组相比,MOLF-L组杯状细胞数量较少并呈无规则分布;MOLF-M组杯状细胞数量较多且形态得到改善;MOLF-H组杯状细胞形态结构接近对照组,数量较多且分布均匀。
2.3 MOLF对小鼠血清中IL-1β、TNF-α、IL-10、HMGB1和LPS含量的影响
由表4可知,与对照组相比,DSS组小鼠血清中IL-1β、TNF-α、HMGB1和LPS含量均极显著上升(P<0.01),IL-10含量极显著降低(P<0.01);与DSS组相比,MOLF-M组小鼠血清中IL-1β、TNF-α、HMGB1和LPS含量均显著下降(P<0.05),MOLF-H组IL-1β、TNF-α、HMGB1和LPS含量均极显著降低(P<0.01),MOLF-M和MOLF-H组IL-10含量均极显著增加(P<0.01)。
2.4 MOLF对小鼠结肠组织炎性细胞因子mRNA相对表达量的影响
由表5可知,与对照组相比,DSS组小鼠结肠组织中IL-1β、TNF-α、HMGB1 mRNA相对表达量均极显著升高(P<0.01),IL-10 mRNA的相对表达量显著降低(P<0.05);与DSS组相比,MOLF-M组IL-1β、TNF-α、HMGB1 mRNA的表达均显著降低(P<0.05),MOLF-H组IL-1β、TNF-α、HMGB1 mRNA表达量均极显著降低(P<0.01),IL-10 mRNA的表达极显著上调(P<0.01)。
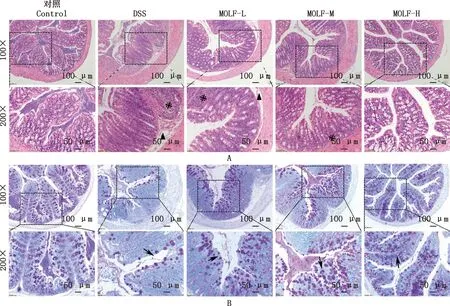
A,小鼠结肠HE染色图;B,小鼠结肠PAS染色图 A,HE staining of mice colon;B,PAS staining of mice colon图1 各组小鼠结肠组织病理学观察Fig.1 Histopathological observation of colon in mice of each group
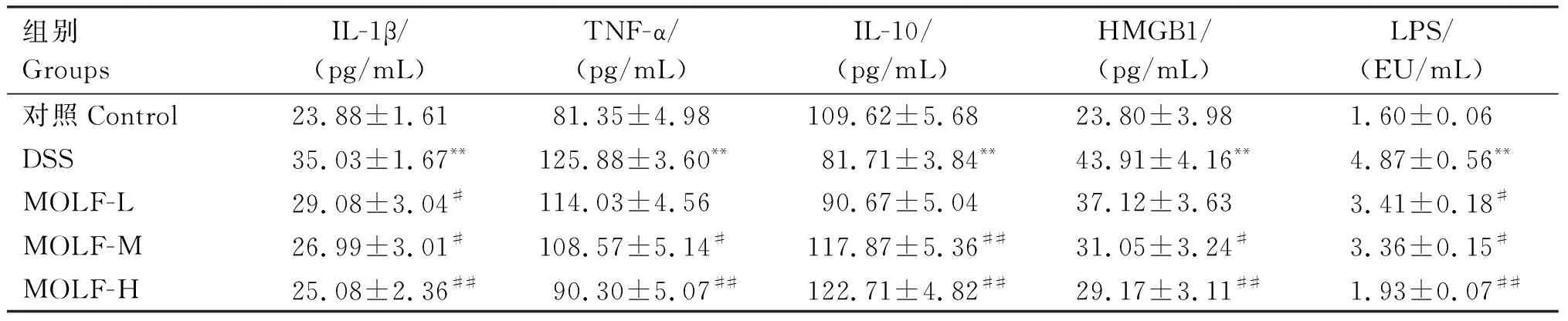
表4 各组小鼠血清中IL-1β、TNF-α、IL-10、HMGB1和LPS水平Table 4 Serum levels of IL-1β,TNF-α,IL-10,HMGB1 and LPS in mice of each group
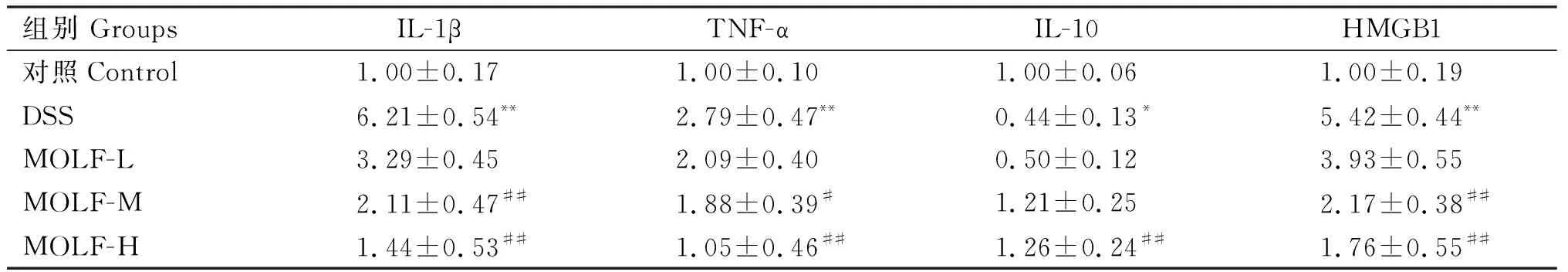
表5 各组小鼠结肠组织IL-1β、TNF-α、IL-10、HMGB1 mRNA表达量Table 5 The mRNA expression of IL-1β,TNF-α,IL-10 and HMGB1 of colon in mice of each group
2.5 MOLF对小鼠结肠ZO-1和Occludin表达水平的影响
免疫荧光检测获得了较为直观的蛋白表达结果,见图2。由图2可知,与对照组相比,DSS组小鼠结肠中ZO-1和Occludin荧光强度降低;经MOLF处理后ZO-1和Occludin荧光强度增加,其中MOLF-H组接近对照组。
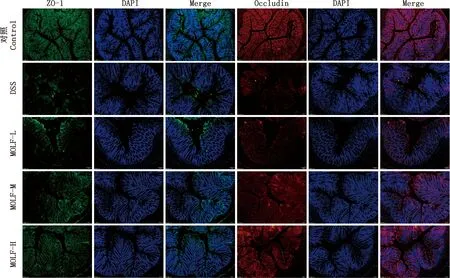
图2 各组小鼠结肠组织免疫荧光染色(100×)Fig.2 Immunofluorescence staining of colon in mice of each group (100×)
2.6 MOLF对小鼠结肠组织中cleaved-caspase 3、Bcl-2、Bax蛋白表达的影响
由图3可知,与对照组相比,DSS组小鼠结肠组织中cleaved-caspase 3的表达极显著增加(P<0.01);与DSS组相比,随着MOLF浓度的增加,小鼠结肠组织中cleaved-caspase 3的表达显著或极显著下降(P<0.05;P<0.01);同时,在DSS的刺激下,小鼠结肠组织中的Bcl-2表达下降,Bax表达增加,与对照组差异极显著(P<0.01);相比于DSS组,MOLF-H处理极显著缓解了Bcl-2表达下降和Bax表达增加(P<0.01)。
3 讨 论
辣木叶中的黄酮类化合物已被证实在缓解氧化应激和抗炎方面发挥重要作用[15],本试验利用DSS建立UC模型,该模型效果明显,临床症状与病理学改变与人体溃疡性结肠炎类似,适用于针对溃疡性结肠炎药物作用的研究[16],并且DSS对肠上皮细胞有直接毒性,会破坏肠黏膜屏障的完整性[17],适合用于研究药物对肠黏膜屏障修复的保护机制。本试验结果显示,模型组小鼠DAI指数明显高于对照组,并伴有腹泻、血便黏连、体重急剧下降、结肠明显缩短等UC典型的临床症状,证明成功诱导出UC模型,效果明显。并且MOLF可以显著缓解UC小鼠体重减轻状况,改善DAI评分,抑制结肠缩短。对结肠组织进行病理组织学研究发现,MOLF可以改善DSS诱导的肠结构破坏、杯状细胞减少和炎性细胞浸润情况,这些结果都表明MOLF对UC临床症状和结肠病理变化具有良好的改善效果。
炎性细胞因子在UC发病过程中扮演着重要角色,当肠道发生炎症时,肠黏膜的免疫功能受到破坏,使肠道内条件致病菌容易在肠道内定植并产生毒素[18],有害菌及其代谢产物如LPS等会进入血液[19],造成单核细胞与常驻肥大细胞的额外募集,刺激促炎和促纤维化介质IL-1β、TNF-α、HMGB1等因子的产生[20-21],进而通过多种途径引起机体局部乃至全身炎症反应。本研究通过对小鼠血清中IL-1β、TNF-α、IL-10、HMGB1炎症因子和LPS检测发现,MOLF会明显抑制促炎因子的表达,上调抗炎因子,降低血清中LPS水平。同时用实时荧光定量PCR技术对相关细胞因子进行检测,结果显示,MOLF处理会显著降低促炎因子IL-1β、TNF-α和HMGB1 mRNA的表达,增加抗炎因子IL-10 mRNA的表达。
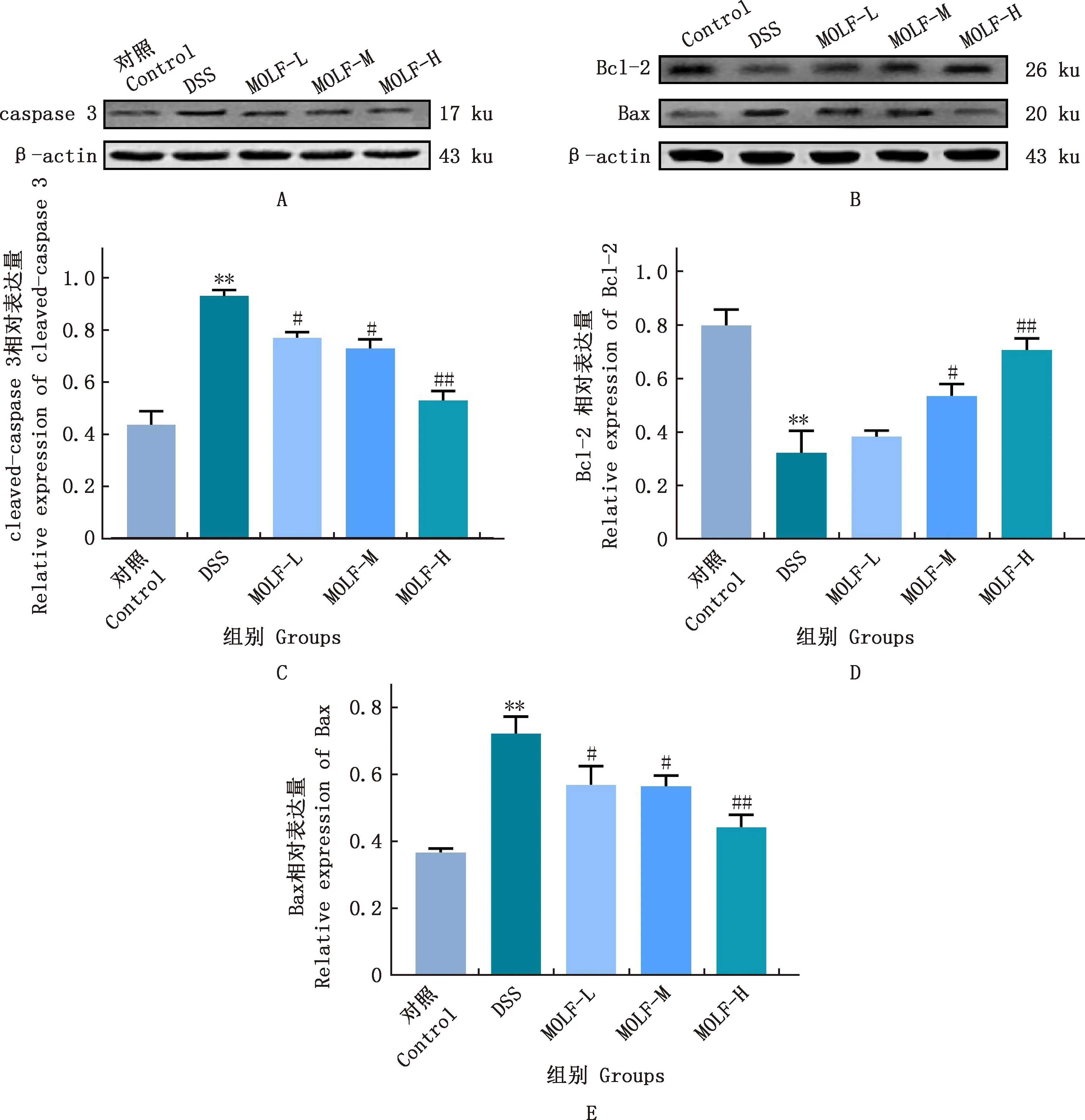
A、B,分别为Cleaved-caspase 3、Bcl-2、Bax蛋白Western blotting条带图;C、D、E,分别为Cleaved-caspase 3、Bcl-2、Bax蛋白表达量 A and B,Western blotting strip charts of cleaved-caspase 3,Bcl-2 and Bax proteins;C,D and E,Protein expression levels of cleaved-caspase 3,Bcl-2 and Bax图3 各组小鼠结肠组织cleaved-caspase 3、Bcl-2、Bax蛋白表达量Fig.3 Expression of cleaved-caspase 3,Bcl-2 and Bax proteins in colon of mice in each group
紧密连接作为肠黏膜机械屏障的核心结构,广泛存在于相邻的肠上皮细胞之间[22],其中ZO-1和Occludin等蛋白共同组成紧密连接的主体,完整的紧密连接结构可封闭细胞间隙,防止有害物质侵袭,对维持肠黏膜屏障完整性发挥重要的作用[23]。本研究通过免疫荧光试验检测ZO-1和Occludin的变化,结果显示,与对照组相比,DSS组小鼠结肠组织中ZO-1和Occludin荧光强度明显降低,提示紧密连接关键蛋白低表达可能是UC发生的关键因素之一;MOLF处理则减轻了DSS诱导损伤导致的紧密连接关键蛋白ZO-1和Occludin的表达降低。此外,紧密连接还有固定上皮细胞维持细胞间极性的作用,正常生理情况下,肠上皮细胞中的Bcl-2和Bax蛋白以适当的比例存在,两者功能相反,若Bax占优势,可促进细胞凋亡;若Bcl-2占优势,则抑制细胞凋亡[24]。当肠道发生炎症时,Bax表达增多,形成的Bax/Bax同二聚体增加,使线粒体膜通透性增加,导致caspase家族蛋白被激活,特别是caspase 3[25]。本研究结果表明,MOLF处理可以显著增加UC小鼠结肠中Bcl-2的表达,同时降低cleaved-caspase 3和Bax的表达,高剂量组效果最明显。这提示MOLF保护UC的机制可能与其维护肠紧密连接蛋白ZO-1和Occludin的表达、调控肠上皮细胞凋亡cleaved-caspase 3/Bcl-2/Bax信号通路有关,从而达到防治UC的作用。
4 结 论
本试验结果表明,在小鼠UC模型中,MOLF可以明显缓解DSS诱导的结肠长度缩短、血清和组织中促炎因子水平升高、肠黏膜紧密连接蛋白损失,并抑制促凋亡蛋白的表达,从而发挥预防保护作用,其中以100 mg/kg MOLF处理效果最好。本研究可为辣木的开发利用以及MOLF防治UC提供新的思路。

