猪圆环病毒2型和3型混合感染引起的母猪繁殖障碍诊治
孙庆帅,陈燕虹,姚 伦,孙 琪,于学祥,吴 昊,阮胜男,雷铭楷,严伟东,何启盖
(1.华中农业大学动物科技学院/动物医学院,武汉 430070;2.农业微生物学国家重点实验室,武汉 430070;3.武汉科前生物股份有限公司,武汉 430072)
20世纪90年代中期在患有仔猪断奶后多系统衰竭综合征(post-weaning multisystemic wasting syndrome,PMWS)的猪病料中发现猪圆环病毒2型(Porcine circovirus 2,PCV2),2016年在患有猪皮炎和肾病综合征(porcine dermatitis and nephrotic syndrome,PDNS)的猪病料中发现PCV3,这2种基因型的PCV均可引起严重的繁殖障碍性疾病,造成母猪流产、产死胎、木乃伊胎、屡配不孕等临床症状,对全球养猪业造成了重大的经济损失[1]。
PCV2自发现以来一直是引起猪繁殖障碍性疾病的主要病原体,可引起母猪的繁殖障碍和仔猪生长迟缓等。在PCV2发现以来,国内外都有关于在流产胎儿和死胎的病料中检测到PCV2核酸的报道[2-7]。2015年,在北卡罗莱纳州的某个猪场发现了PCV3的存在,该场母猪死亡率升高、受胎率降低、流产、产木乃伊胎,临床特征表现为厌食、多灶性丘疹、斑疹及浅表皮炎,经检测仅发现PCV3核酸存在[8]。Saporiti等[9]检测53份流产胎儿和死胎病料中的PCV3核酸,发现PCV3单独感染的样品量为33.9%。Alomar等[10]在葡萄牙某患病猪场仔猪(4~10周龄)病料中发现了PCV3的核酸,且无PCV2、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)及其他病原体感染,仔猪临床特征表现为生长迟缓、被毛粗糙、耳朵后倾。提示继PCV2后,PCV3也可能成为危害养猪业的主要繁殖障碍性病原体。
已有研究表明,PCV2、PCV3可跨物种传播,具有高传播性,加大了规模化养殖场的防控难度[1]。2020年8月-2020年12月期间,湖北地区某存栏220头约克夏母猪的规模化猪场出现受胎率和产仔率低的现象。人工授精170头母猪,受胎率在10%左右;43头怀孕母猪共产268头健康仔猪,53头弱仔,4头死胎,平均每头猪产仔6~7头。为寻找该场屡配不孕、持续返情的病因,本研究通过观察该场母猪临床表现,并采集母猪的口鼻腔拭子、肛拭子、组织及饲料样品进行实验室诊断,根据结果提供治疗与防控策略,以期使得该猪场能恢复正常生产,为广大养猪业防控和诊治此类繁殖障碍性疾病提供借鉴与参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 采集该场后备母猪、怀孕母猪、哺乳母猪饲料槽中的全价配合饲料;采集10头返情母猪口鼻腔拭子、肛门拭子、前腔静脉血液;随机剖检13头返情母猪,采集脾脏、腹股沟淋巴结、脊髓等免疫系统组织及子宫、卵巢等生殖器官组织;采集的所有样品均在低温保存条件下24 h内迅速带回实验室进行检测。
1.1.2 主要试剂及仪器 血液/细胞/组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;Simply P 总RNA提取试剂盒购自杭州博日科技有限公司;2×TaqMasterMix购自北京康为世纪生物科技有限公司;PremixTaqTM(Probe qPCR)、RNA反转录酶均购自TaKaRa公司;无水乙醇、氯化钠(NaCl)、氯化钾(KCl)、磷酸氢二钠(Na2HPO4)、磷酸二氢钾(KH2PO4)等均购自国药集团化学制药有限公司。恒温水浴锅购自富华仪器有限公司;匀浆振荡仪购自QIAGEN公司;实时荧光定量PCR仪(Bio-Rad CFX96TM)购自Bio-Rad公司;常温或冷冻离心机购自Eppendorf公司。
1.2 方法
1.2.1 饲料中黄曲霉素B1检测 将采集的全价配合饲料在湖北省饲料质量监督检验站按照GB/T 17480-2008方法进行检测。
1.2.2 病原检测 将该场采集的母猪口鼻腔拭子、肛门拭子进行处理后,按照试剂盒说明书提取DNA和RNA;取各母猪的脾脏、腹股沟淋巴结、脊髓、子宫、卵巢各10 mg,混合放入无酶EP管中,进行处理后按照试剂盒说明书提取DNA和RNA;RNA反转录为cDNA后使用,反转录体系20 μL:反转录酶4 μL,RNA 16 μL。反应条件:37 ℃ 15 min;85 ℃ 50 s;4 ℃ 2 min。以得到的DNA和cDNA为模板使用常规PCR进行PCV2、PCV3、猪细小病毒(Porcine parvovirus,PPV)、PRRSV、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪瘟病毒(Classic swine fever virus,CSFV)检测。根据各个病毒的保守基因序列,使用Primer Premier 5.0软件设计引物,引物均由生工生物工程(上海)股份有限公司合成。引物信息见表1。各病毒检测PCR反应体系均为20 μL:2×TaqMasterMix 10 μL,上、下游引物(10 μmol/L)各0.4 μL,DNA或cDNA模板3 μL,ddH2O 6.2 μL。

表1 病原检测所用引物信息Table 1 Primer information for pathogen detection
1.2.3 各组织中病毒分布情况 在脾脏、腹股沟淋巴结、脊髓、子宫、卵巢各组织的病变和健康交界处取50 mg组织块置于灭菌EP管中,经处理后,用于提取DNA。使用实时荧光定量PCR检测各组织中PCV2、PCV3病毒载量,检测所用引物与探针信息见表2。引物均由生工生物工程(上海)股份有限公司合成。

表2 实时荧光定量PCR引物和探针信息Table 2 Primer and probe information for Real-time quantitative PCR
1.2.4 PCV2、PCV3ORF2基因序列分析 选取部分PCV2、PCV3 PCR检测结果为阳性的样品DNA,进行PCV2、PCV3ORF2基因的扩增并测序。从GenBank中搜集国内外PCV2、PCV3的全基因组或ORF2基因序列,使用SnapGene软件进行序列比对,使用Mega 11.0软件采用邻接法(Neighbor-Joining)构建遗传进化树 (Bootstrap 重复计算1 000次),使用DNAStar软件包中的MegAlign进行核苷酸序列相似性分析。PCV2、PCV3ORF2基因扩增引物均由生工生物工程(上海)股份有限公司合成。引物信息见表3。PCV2、PCV3全基因组或ORF2基因参考序列见表4、5。

表3 ORF2基因扩增所用引物信息Table 3 Primer information for ORF2 gene amplification
表4 PCV2国内外毒株参考毒株信息Table 4 Information of domestic and foreign PCV2 reference strains

续表

表5 PCV3国内外毒株参考信息Table 5 Information of domestic and foreign PCV3 reference strains
1.2.5 卵巢病理切片观察 采集母猪卵巢组织样品,放入多聚甲醛中固定,按照常规方法制作石蜡切片并使用HE染色,将制作好的切片置于普通倒置显微镜下进行观察。
1.2.6 诊断结论、防控建议及回访 结合该场母猪临床表现及实验室病原检测结果,确定引起该场母猪屡次返情的病因,并根据结果进行相应的急救措施,在采取措施2个月后对该场进行回访调查,询问其是否恢复生产。
2 结 果
2.1 饲料中的黄曲霉素B1检测
从该场采集的后备、怀孕、哺乳母猪的全价配合饲料中黄曲霉素B1的含量分别为9.0、4.5和4.5 μg/kg。GB 13078-2017规定猪用饲料中黄曲霉素B1允许量为<20 μg/kg。表明该场饲料的黄曲霉素B1含量均在允许范围内。
2.2 病原检测
将处理好的样品进行DNA/RNA提取,使用PCR、RT-PCR方法检测病原,结果显示,口鼻腔拭子、肛门拭子及血清等样品PCV2、PCV3、PPV、PRRSV、PRV、CSFV检测结果均为阴性。母猪混合组织样检测结果发现,PCV2阳性率为69.23%(9/13),PCV3阳性率为38.46%(5/13)(表6)。13头母猪中PCV2和PCV3混合感染率为30.76%(4/13)。PCV2和PCV3部分阳性样品核酸电泳结果见图1。

表6 各样品中病原检测结果Table 6 Pathogen detection results in each sample
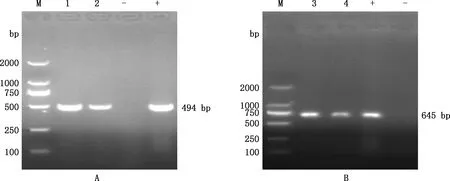
M,DL2000 DNA Marker;1、2,PCV2混合组织阳性样品;-,阴性对照;+,阳性对照;3、4,PCV3混合组织阳性样品 M,DL2000 DNA Marker;1 and 2,PCV2 positive samples;-,Negative control;+,Positive control;3 and 4,PCV3 positive samples图1 PCV2(A)和PCV3(B)部分样品PCR结果电泳图Fig.1 Electrophoresis of PCR results of some samples of PCV2 (A) and PCV3 (B)
2.3 各组织中病毒分布情况
实时荧光定量PCR方法检测各组织中PCV2、PCV3载量结果显示,PCV2在脊髓中的病毒载量最高,脾脏次之,淋巴结中最少;PCV3在脾脏中病毒载量最高,脊髓次之,卵巢中载量最少(表7)。
2.4 PCV2、PCV3 ORF2基因序列分析
由图2、3可知,本次测序的3个PCV2阳性样品(分别为QJ/HB/CN/201、QJ/HB/CN/202和QJ/HB/CN/203)均为PCV2d亚型,与国内的2009SD株(KX904945.1)、SXYLA-05株(KC800642.1)、JX0801株(GQ359009.1)、SDld02M株(HM755880.1)、M/2010株(JF927988.1)、HBwh-24株(FJ870971.1)等毒株属于同一分支,亲缘关系较近,核苷酸序列相似性在99.1%~99.9%之间;与比利时的ii11a株(EU909686.1)、国内的09SX123株(HQ395044.1)、GXWM株(EF675241.1)等处于不同分支,亲缘关系较远,核苷酸序列的相似性在97.8%左右;与其他亚型的PCV2毒株核苷酸序列相似性在89.0%~94.4%之间。

表7 各组织中PCV2、PCV3病毒载量Table 7 Viral load in each tissue 拷贝/μL
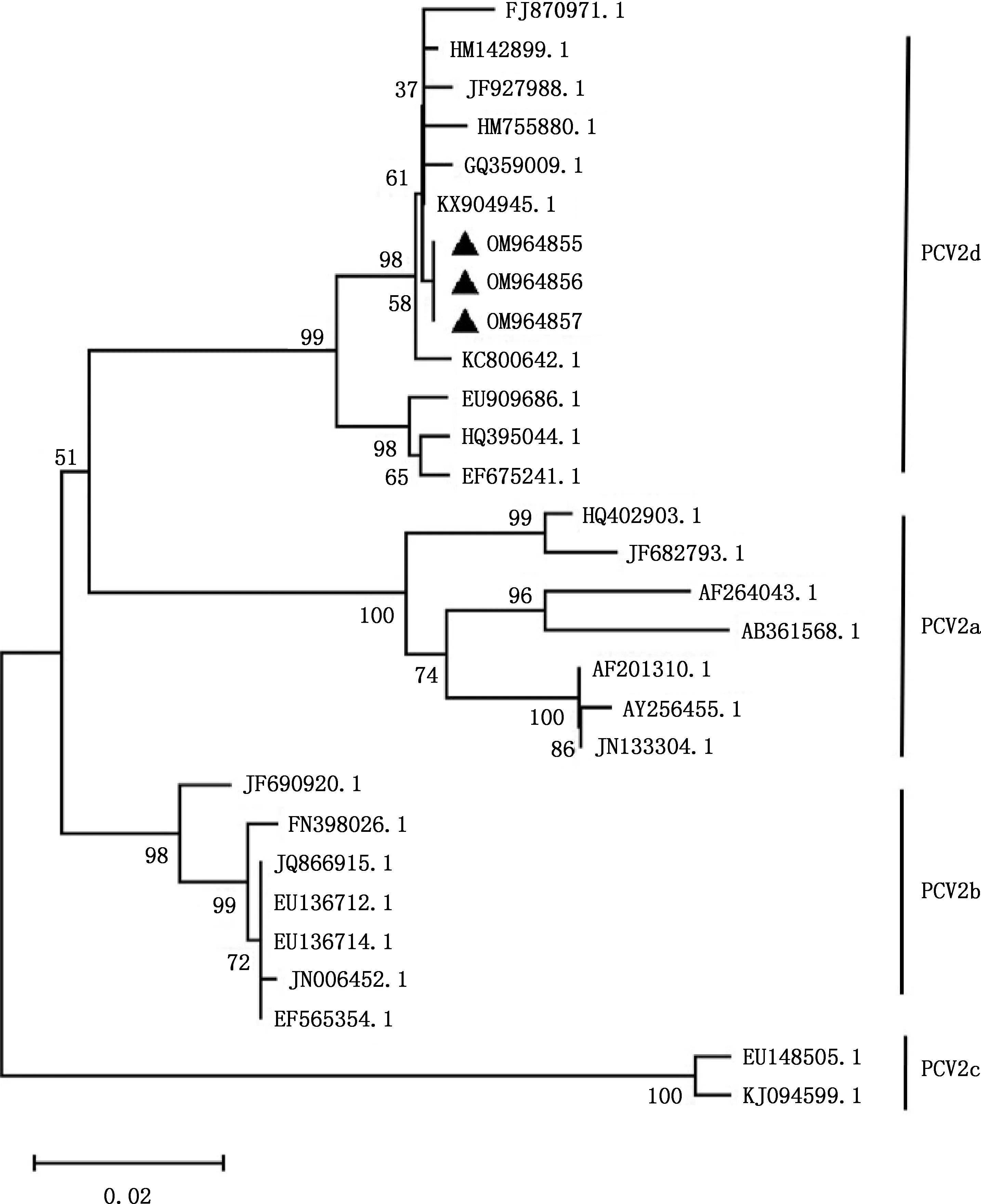
图2 PCV2 ORF2基因遗传进化分析Fig.2 Genetic evolution analysis of PCV2 ORF2 gene
由图4、5可知,PCV3阳性样品均为PCV3a亚型(分别为QJ/HB/CN/204、QJ/HB/CN/205和QJ/HB/CN/206),与国内PCV3-CN-HLG-2株(MH277108.1)、QHD1株(MT711857.1)、JX-2/CH/2017株(MF677839.1)属于同一分支,亲缘关系较近,核苷酸序列相似性在99.5%~100%之间;与同是PCV3a亚型的国内PCV3-CN-HLJ-2018株(MK178315.1)、PCV3/CN/GX/GX12/2018株(MN788149.1)、PCV3-CN2018HLG-5株(MH277111.1)、CN/Hubei-610/2016株(KY354038.1)、PCV3-CN-JL28-2018株(MK178315.1)、LN56株(MK347416.1)及美国KSU-MO-2017-PCV3-45株(MH603550.1)、韩国PCV3/KU-1601株(KY996337.1)处于不同分支,核苷酸序列相似性在98.9%~99.5%之间;与PCV3b亚型的毒株核苷酸相似性在97.3%~98.9%之间。
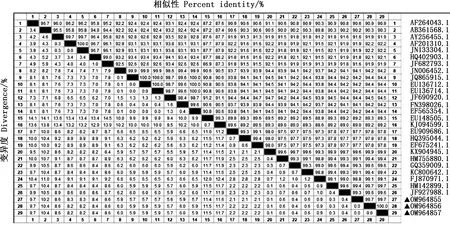
图3 PCV2 ORF2基因核苷酸序列相似性分析Fig.3 Nucleotide sequence similarity analysis of PCV2 ORF2 gene
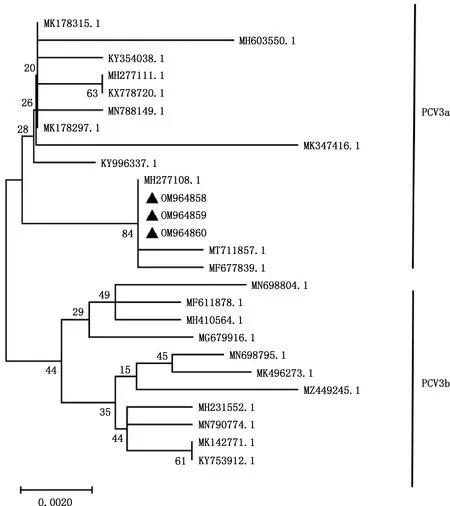
图4 PCV3 ORF2基因遗传进化分析Fig.4 Genetic evolution analysis of PCV3 ORF2 gene

图5 PCV3 ORF2基因核苷酸序列相似性分析Fig.5 Nucleotide sequence similarity analysis of PCV3 ORF2 gene
本次测序PCV2、PCV3阳性样品所得序列均已提交NCBI,登录号分别为:OM964855、OM964856和OM964857,以及OM964858、OM964859和OM964860。
2.5 卵巢病理切片观察
卵巢病理切片HE染色整体结果显示,卵泡细胞数量减少;卵母细胞细胞核皱缩、变形,发育不正常;次级生长卵泡形态呈梭形,颗粒细胞数量减少,颗粒细胞膜和卵泡腔变形;初级生长卵泡透明带瓦解,会导致无法正常排卵;有中性粒细胞和淋巴细胞浸润导致的炎症反应。观察单独感染PCV2、单独感染PCV3及PCV2和PCV3混合感染的母猪卵巢组织,都有瘀血的病理现象发生,且卵泡腔发育不规则甚至塌陷、扁平。部分卵巢病理切片见图6。
2.6 诊断结论、防控建议及回访结果
根据该猪场临床症状和实验室检测结果综合诊断,确定该猪场配种失败持续返情、生产效益低下为PCV2和PCV3混合感染所致。
对全群进行PCV2疫苗接种,同时,对猪场内外环境彻底消毒,由原来的3 d一次消毒增加到每天2次,加强通风,控制好湿度与温度,改善饲养环境,尽量减少猪的应激反应。
2个月后对其回访,猪场内现有约克夏母猪200头,受胎率均达到90%以上,仔猪也无颤抖的临床症状发生。
3 讨 论
繁殖障碍性疾病对养猪业危害极大,是日常生产中较为常见的一类疾病。母猪在日常饲喂过程中不会有明显的异常表现,但在母猪配种时会表现出多次发情、配种多次而无法怀孕的现象,在妊娠过程中发生流产,所产仔猪体弱多病或为畸形[11-12],增加了规模化猪场的饲养压力,减少了经济效益。在本案例中,母猪外观与表现均无明显的异常情况,却表现出多次发情、屡配不孕、妊娠母猪产仔率低下等情况,为典型的繁殖障碍表现。
黄曲霉素B1是目前发现的最丰富的毒菌霉素,主要生物学效应是致癌性、免疫抑制、导致突变、饲料效率低、肝脏受损等,会导致母猪不孕、流产等情况[13-14]。中国及欧盟规定猪饲料中最高黄曲霉素B1的含量为20 μg/kg,从该场所带回的饲料检测结果显示黄曲霉素B1的含量符合国家标准,说明并非因饲料储存不当导致饲料发霉变质,引起黄曲霉素B1超标而导致的母猪屡配不孕。
PCV可感染各个日龄的猪,可经过垂直传播或者水平传播,会导致仔猪出现震颤、多系统衰竭、消瘦,母猪不孕、流产等症状。本研究在猪的口腔、鼻腔、肛门拭子及血清中均未检测到可引起猪繁殖障碍的病毒核酸存在,如PRV、PRRSV等。通过进一步的对该场母猪进行解剖,眼观可发现淋巴结肿大。经检测,在该场母猪的脾脏、淋巴结、脊髓、子宫及卵巢中均发现PCV2、PCV3核酸,表明引起该场繁殖障碍的原因为感染PCV2和PCV3。本研究还发现PCV2和PCV3的病毒载量均在免疫系统中(脾脏和脊髓)较高,因此,在检测PCV2、PCV3时可优先选择采集脊髓和脾脏等免疫系统组织。薛霜等[15]检测猪的各个组织中的PCV3核酸,发现其在脾脏、淋巴结和肺脏中病毒含量最高,与本研究结果相符。
衣壳蛋白(Cap蛋白)是PCV主要的结构蛋白,决定毒株的免疫原性。对该场所检测到的部分PCV2、PCV3阳性样品扩增ORF2基因,基于ORF2基因与国内外的参考序列进行比对,分析其遗传进化以及核苷酸序列相似性。结果表明本研究中测序的3个PCV2阳性样品均为PCV2d亚型,本次PCV3测序的3个阳性样品均为PCV3a亚型,通过分析国内外PCV3参考毒株序列的ORF2基因,发现本研究测序的3个PCV3阳性样品与国内地区多个毒株相似性为100%,整体在97.3%~99.9%之间。Ku等[16]对国内的33株PCV3进行ORF2基因序列分析发现,其与国内外参考毒株核苷酸相似性在98.4%~100%之间;李蕊等[17]对国内12株PCV3进行ORF2基因序列分析发现,其所获得的PCV3与国内外多个参考毒株的核苷酸相似性为100%;郭影成等[18]对所获得4株PCV3进行ORF2基因核苷酸序列分析发现,其核苷酸相似性在97.7%~99.7%之间;这些结果都表明目前PCV3的遗传变异较小,与本研究结果一致。
目前关于PCV2和PCV3感染母猪后母猪卵巢的病理变化情况相关研究甚少。雌性动物怀孕的前提是其卵子的正常排出,卵巢是卵泡从开始发育到排卵的场所,为雌性哺乳动物的重要生殖腺器官[19]。本研究中,卵巢表现为卵泡细胞数量少,原始卵泡发育不正常,卵母细胞细胞核皱缩,卵泡腔发育不规则、塌陷扁平,并存在中性粒细胞和淋巴细胞浸润而引起的炎症现象,具有散在出血点和淤血。表明母猪感染PCV2和PCV3后可造成卵泡发育不良,导致其无法排卵,最终造成母猪在配种时出现屡配不孕的现象。
PCV的传播途径十分广泛,当猪群中有猪感染了PCV时,带毒猪在群内走动,就会传播病毒,且饲养员与携带病毒的猪接触后,饲养员的设备或衣服也可变成病毒传播的一种媒介。当母猪在妊娠时期感染了PCV,其所产仔猪可能会通过胎盘垂直传播的方式,在出生时就携带PCV。目前PCV2已有灭活疫苗和亚单位疫苗,可预防PCV2所带来的相关临床症状。自2012年以后,PCV2d基因亚型已逐渐替代PCV2b基因亚型,成为主流的PCV2基因亚型。国内外均有研究表明,PCV2a或PCV2b疫苗均可为PCV2d提供一定的交叉免疫保护力[20-22]。本研究中,确诊该场繁殖障碍母猪为感染PCV2、PCV3所致,该猪场母猪在接种PCV2b疫苗后,成功控制疫情,使得该场成功恢复了生产。提示PCV2的控制对PCV3可能也起到一定的控制作用。在猪场日常管理中,为预防各种繁殖障碍性疾病的感染,应当对常见病毒如PCV、PRRSV、PRV等设定相应的免疫程序,在不同的免疫日龄使用一致的基因型疫苗,避免病毒的重组。此外,要做好生物安全防控,严格控制车流、物流、人员流动等,做好消毒防护措施;不同圈舍各自准备一套衣服,圈舍门口也应准备消毒脚盆、酒精灯等进行充分消毒,把病毒传播的几率降到最低,做好生物安全防控,加大对繁殖障碍性疾病的防控[23]。
4 结 论
通过对临床症状的判断,结合实验室检测结果,最终判定该场母猪屡配不孕的原因为感染PCV2、PCV3。对部分PCV2、PCV3阳性样品进行ORF2基因序列分析,得知该场感染PCV2为2d亚型,PCV3为3a亚型,全群接种PCV2疫苗,加强生物安全防控,2021年4月对其回访,该猪场已成功恢复生产。本研究结果为规模化养殖场在防控或诊治繁殖障碍类疾病提供借鉴。

