化脂复肝颗粒通过抑制TLR4/NF-κB/NLRP3减轻Kupffer细胞炎症改善非酒精性脂肪性肝病机制研究
唐颖慧,叶苗青,何瑾瑜,刘皎皎,李粉萍,薛敬东,杨跃青
(陕西省中医医院,陕西 西安 710003)
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是指除酒精和其他明确损肝因素外所致的肝细胞内脂肪过度沉积、肝脏弥漫性脂肪浸润为主要临床特征的疾病[1]。NAFLD病程包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝纤维化、肝硬化、肝癌。实践提示,这种疾病后期通常会向肝硬化乃至肝癌进行演变,对人们的身体健康已经构成严重威胁[2]。国内有1/3的人群患有非酒精性脂肪性肝病,随着生活方式的迅速转变,我国非酒精性脂肪性肝病发展日益加重[3-4]。因此,NAFLD的发病机制和药物防治已经成为当前中医研究热点。
化脂复肝颗粒是根据陕西省中医医院名中医张瑞霞治疗脂肪肝的经验方制成的中成药,其可减轻四氯化碳诱导的小鼠急性肝损伤,可明显降低乙硫氨酸诱导的脂肪肝大鼠的总胆红素和TG含量,减轻脂肪肝重量和肝脏病理损伤[5]。张欣等[6]和李小瑞等[7]报道采用化脂复肝颗粒治疗脂肪肝患者的总有效率分别达到 86.9% 和 86.7%,证实化脂复肝颗粒具有降低血脂、保肝降酶及改善脂肪肝临床表现的作用,但目前化脂复肝颗粒治疗非酒精性脂肪性肝病的机制并不十分明确。
近年相关研究发现巨噬细胞是肝脏内含量最丰富的非实质细胞,肝脏中的巨噬细胞Kupffer细胞(KCs)是肝脏中炎症因子的最主要来源,KCs被激活后,其分泌的各种细胞因子会直接作用于肝脏内的其他细胞,能够直接影响肝脏内的脂质代谢而诱发脂肪肝[8],在NAFLD进展及肝脏炎症损伤中发挥不可或缺的作用[9-10]。本研究分离培养SD大鼠原代肝脏KCs,通过设置不同实验组别,观察LPS、高糖对肝脏KCs炎症通路的刺激作用,并以化脂复肝颗粒含药血清干预,进一步解释化脂复肝颗粒通过改善内毒素血症治疗NAFLD的分子机制。
1 材料与方法
1.1 原代SD大鼠KCs分离与培养 4周龄雄性SD大鼠禁食不禁水48 h,断颈处死。肝内灌注预热灌注液,待肝脏脂肪变软后以37 ℃预热0.5%Ⅳ型胶原酶灌注,剔除肝包膜及结缔组织,剪碎至2 mm×2 mm×2 mm小块,酶解消化,200目筛网过滤。离心取上清后再次离心,沉淀细胞行Percoll 密度梯度离心,收集KCs,制备1×106个/ml细胞悬液,接种6孔培养板,37 ℃温箱内孵育20 min,PBS洗去未贴壁细胞,继续培养备用。
1.2 KCs分组及处理 分离培养KCs 48 h后,随机将其分为空白组、LPS干预组、LPS+空白血清组、LPS+化脂复肝组、高糖+对照组、高糖+LPS干预组、高糖+LPS+空白血清组、高糖+LPS+化脂复肝组,LPS干预浓度为100 ng/ml,高糖干预为于KCs培养基中另加入葡萄糖30 mmol/L。
1.3 药物及试剂、仪器 化脂复肝颗粒,陕西省中医医院提供;CCK-8试剂盒,碧云天生物公司;ELISA试剂盒,CUSABIO公司;RNA抽提试剂盒、逆转录试剂盒、SYBR Green 实时荧光定量试剂盒,TAKARA公司;酶标仪(MK3),THERMO 公司;CO2恒温培养箱,Sanyo公司。
1.4 检测指标及方法
1.4.1 促炎因子指标:收集培养基,离心取上清,ELISA法测定肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)含量。
1.4.2 RT-qPCR测定KCs中Toll 样受体4(TLR4)、髓样分化因子(MyD88)、核转录因子-κB p65(NF-κB p65)、NOD样受体热蛋白结构域相关蛋白3(NLRP3)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)、TNF-α、IL-1β、IL-18 mRNA表达量。
收集细胞,取适量细胞样本加入Trizol室温裂解5 min,加入1/5Trizol体积的氯仿提取,并用异丙醇沉淀RNA后用75%乙醇洗涤,用灭菌DEPC水溶解抽提总RNA。取1 μg RNA用Super ScriptTMⅡ Reverse Transcriptase 反转录试剂盒将RNA反转录成cDNA,用SYBR Green染料法进行扩增检测。引物序列:βactin-F 5’-ACCCTAAGGCCAACCGTGAAA-3’,βactin-R 5’-ATGGCGTGAGGGAGAGCATA-3’;TLR4-F 5’-TTCTGCAATGTCTCTGGCAGG-3’,TLR4-R 5’-GCTGAGACTTGGTAGGGCCA-3’;MyD88-F 5’-TGTTCTTGAACCCTCGGACG-3’,MyD88-R 5’-TTCCAGCTCTCGGATCTCCA-3’;NF-κB p65-F 5’-ATCATCGAACAGCCGAAGCA-3’,NF-κB p65-R 5’-TGATGGTGGGGTGTGTCTTG-3’;TNF-α-F 5’-AGGCACTCCCCCAAAAGATG-3’;TNF-α-R 5’-ACTGATGAGAGGGAGGCCAT-3’;NLRP3-F5’-CCTTAAGCTGGAGCTGCTGT-3’;NLRP3-R5’-TCACCTCTCGGCAGTGGATA-3’;Caspase-1-F5’-ACTGCTATGGACAAGGCACG-3’;Caspase-1-R5’-CCTGCCAGGTAGCAGTCTTC-3’;IL-1β-F5’-TTCAGGCAGGCAGTATCACTC-3’;IL-1β-R5’-GAAGGTCCACGGGAAAGACAC-3’;IL-18-F5’-GACTCTTGCGTCAACTTCAAGG-3’;IL-18-R5’-CAGGCTGTCTTTTGTCAACGA-3’。反应体系:Power SYBR=Green Master Mix 10 μl,10 μmol/L Forward Primer 0.5 μl,10 μmol/L micro-R 0.5 μl,SDW 8 μl,cDNA 1.0 μl,用DEPC水定容到总体积20 μl。反应条件:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30~34 s,40个循环,60 ℃处收集荧光;55~95 ℃绘制溶解曲线。每个样品重复3次,用2-△△Ct法计算基因的相对表达量。

2 结 果
2.1 各组KCs增殖情况比较 空白及高糖培养对照组KCs不断增殖,长势良好;LPS+化脂复肝组与高糖+LPS+化脂复肝组KCs缓慢增殖,非高糖组KCs均较含高糖组KCs增殖速率更快;而LPS或高糖+LPS诱导模型组及各加空白血清组KCs于第6 h开始出现凋亡,含高糖组KCs均较非高糖组KCs凋亡速率更快。见图1。
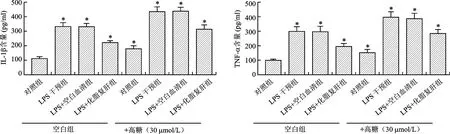
2.2 各组KCs培养基上清液中促炎因子TNF-α、IL-1β的含量比较 非高糖各组与含高糖各组中促炎因子TNF-α、IL-1β含量均呈相同变化趋势,且含高糖各组上述促炎因子含量均较非高糖组高。以非高糖组为例,LPS诱导模型组和LPS+空白血清组的促炎因子TNF-α与IL-1β含量均显著高于对照组(P<0.05),LPS诱导模型组与LPS+空白血清组间TNF-α与IL-1β含量比较差异均无统计学意义(P>0.05);与LPS诱导模型组或LPS+空白血清组比较,LPS+化脂复肝组促炎因子TNF-α与IL-1β含量均显著降低(P<0.05)。见图2。
2.3 各组KCs中TLR4/NF-κB/NLRP3通路相关基因表达水平比较 非高糖各组与含高糖各组中炎症相关基因(TLR4、MyD88、NLRP3、Caspase-1、NF-κB p65、TNF-α、IL-1β、IL-18)表达水平均呈相同变化趋势,且含高糖各组上述促炎因子及炎症相关基因表达水平均较非高糖组高。以非高糖组为例,LPS诱导模型组和LPS+空白血清组KCs中炎症相关基因TLR4、MyD88等的mRNA表达水平均显著高于对照组(P<0.05),LPS诱导模型组与LPS+空白血清组间KCs中炎症相关基因TLR4、MyD88等的mRNA表达水平比较差异均无统计学意义(P>0.05);与LPS诱导模型组及LPS+空白血清组比较,LPS+化脂复肝组KCs中炎症相关基因TLR4、MyD88等的mRNA表达水平均显著降低(P<0.05)。见图3。
注:与对照组比较,*P<0.05

图3 RT-qPCR检测KCs中各炎症相关基因表达水平
3 讨 论
NAFLD又称代谢相关脂肪性肝病(Metabolic associated fatty liver disease,MAFLD),包括单纯脂肪变性和脂肪性肝炎(Nonalcoholic steatohepatitis,NASH),可进展为肝脏纤维化及不可逆的肝硬化和肝细胞肝癌[11]。早期单纯性脂肪肝的患者几乎不表现出不良结果,随着疾病进展,如进展至NASH,可出现多种并发症,如肝衰竭、2型糖尿病(Type 2 diabetes,T2DM)、心血管疾病、肾脏疾病等代谢相关疾病[12-15]。近年来,对NAFLD的发病机制的研究有了重大进展。关于NAFLD的发病机制,之前的“双重打击”学说不足以解释NAFLD中发生的相关分子和代谢变化,目前较推崇的是“多重打击”学说,其反映了NAFLD的发病过程的复杂性。其发病机制可能包括胰岛素抵抗、脂肪因子损伤、脂肪组织分泌炎症因子、肠道菌群紊乱、基因及表观遗传学异常、氧化应激、环境影响及饮食因素等[16-18]。
KCs占全身巨噬细胞总数的80%~90%,是体内最大的巨噬细胞群,占肝脏细胞总数的15%,占肝脏非实质性细胞的20%~25%,占肝窦细胞总数的30%,是肝脏防御系统主要成员。KCs特殊的细胞结构和生理功能及其在肝脏和全身巨噬细胞中所处的地位和性质决定了它在全身和肝脏疾病发生发展中起到重要作用。在NAFLD中,KCs大量浸润[19],且极化的KCs会促进NAFLD中肝脏炎症-纤维化的启动和进展[20]。KCs激活后通过产生TNF-α、IL-6、IL-10、IL-1β、INF-β等炎症因子招募T淋巴细胞、NKT细胞等炎症细胞,间接参加炎症和免疫反应[21]。
有研究指出,NAFLD的进展进一步受到核苷酸结合域、富含亮氨酸的家族、热蛋白结合域因子-3(NLRP3)炎性小体的影响。NLRP3炎性小体是一种多聚体复合物,是炎症反应中常见的急性产物。NLRP3炎性小体在慢性肝病的晚期进展如NAFLD向NASH的进展中起重要作用。Wree等[22]证明,经胆碱氨基酸缺乏的饮食喂养,WT小鼠出现肝脏重量增加、血浆ALT和AST 升高等肝脏病理变化,而NLRP3-/-小鼠的肝肿大和肝损伤的表现则明显减轻。同样,与正常人比较,NASH 患者的 NLRP3、IL-1β及 IL-18 水平则明显升高[22]。与正常饮食小鼠比较,高脂饮食组小鼠的 NF-κB的活性高出2倍,且伴有肥胖程度和胰岛素抵抗的增加,以及炎性细胞因子IL-6、IL-1β、TNF-α等的升高[23]。此外,有学者通过体外研究发现,细菌DNA含有的未甲基化的胞嘧啶-鸟苷二核苷酸(CpG)序列,可与KCs表面的TLR9结合,可通过Toll/白介素-1受体(TIR)结构域启动MyD88依赖性途径,从而增强促炎基因的表达和产生IL-1β等[24]。
本研究通过用LPS或加高糖刺激KCs诱导炎症,结果发现,KCs中炎症因子TNF-α、IL-1β含量以及炎症相关基因TLR4、MyD88、NLRP3、Caspase-1、NF-κB p65、TNF-α、IL-1β、IL-18 mRNA表达水平均显著升高,且含高糖各组上述促炎因子及炎症相关基因表达水平均较非高糖组更高。经化脂复肝颗粒含药血清治疗组后,促炎因子TNF-α与IL-1β含量均显著降低,炎症相关基因TLR4、MyD88、NLRP3、Caspase-1、NF-κB p65、TNF-α、IL-1β、IL-18的mRNA表达水平也均显著降低(P<0.05)。提示化脂复肝颗粒含药血清可改善KCs活力,有效减轻KCs炎症反应,减少KCs细胞焦亡的发生,具有显著的抗炎、抗氧化损伤及保肝作用,推测其作用机制与TLR4/MyD88/NF-κB p65/NLRP3信号通路直接相关,为非酒精性脂肪性肝病的治疗提供了新的思路及靶点。

