洋葱醇提物总黄酮含量的测定及其降脂活性研究
樊孔明,田太成,王晓莉,陈 珍,巫道颖,张建武*,杨春艳*
(1.川北医学院药学院 川北医学院药物研究所,四川 南充 637100;2.川北医学院 基础医学创新研究平台,四川 南充 637100;3.川北医学院 形态研究所,四川 南充 637100)
洋葱(AlliumcepaL.)为百合科葱属多年生草本植物[1],是膳食黄酮类化合物最丰富的来源之一,为地中海饮食的重要组成部分[2]。洋葱不仅含有多种维生素、矿物质和氨基酸,还含有多酚、有机硫化合物和皂苷等生物活性成分[3],具有抗氧化[4-5]、抗菌、抗炎、免疫调节[6]、防癌[7]、降脂、降压、降血糖、减肥等药理作用[8],还可以有效改善非酒精性脂肪肝大鼠的病变[9]。目前,大多数研究仅针对洋葱粗提物进行动物实验,而对洋葱活性成分的研究较少。
黄酮类化合物是以C6-C3-C6为基本结构骨架的多酚类化合物,主要包括黄酮及黄酮醇类、二氢黄酮及二氢黄酮醇类、异黄酮类等。黄酮类化合物多以糖苷形式存在,在自然界中分布极其广泛,且具有多种生物活性,如抗炎[10]、抗菌、抗病毒、抗肿瘤[11]、预防心血管疾病等,一直是药物研发的热点[12-13]。
黄酮类化合物可以和铝盐生成黄色络合物,用于定量和定性分析。基于此,作者以三氯化铝-醋酸-醋酸钠缓冲溶液为显色剂,采用紫外分光光度法测定洋葱醇提物总黄酮含量,通过单因素实验与响应面法优化洋葱醇提物总黄酮含量测定的显色条件,并利用游离脂肪酸(FFA)诱导HepG2细胞建立肝脂肪变性模型评价其体外降脂活性。
1 实验
1.1 材料、试剂与仪器
紫皮洋葱,市售。
芦丁标准品、脱脂的牛血清白蛋白(d-BSA)、棕榈酸(PA)、油红O染色试剂盒,北京索莱宝科技有限公司;三水合醋酸钠、亚硝酸钠、九水硝酸铝、六水三氯化铝,成都科隆化学品有限公司;冰醋酸,西陇科学股份有限公司;DPPH、过硫酸钾、ABTS,Aladdin;HepG2细胞,川北医学院分子生物学研究所;DMEM培养基、热灭活的胎牛血清(FBS),博士得生物工程有限公司;CCK-8试剂盒,碧云天生物技术有限公司;辛伐他汀,MedChemExpress公司;油酸(OA),Sigma-Aldrich公司;二辛可宁酸(BCA)蛋白、甘油三酯(TG)、总胆固醇(TC)分析试剂盒,南京建城生物工程研究所。
SP-756P型紫外分光光度计,上海光谱仪器有限公司;KQ3200DB型数控超声波清洗器,昆山超声仪器有限公司;AC211S型电子分析天平,北京赛多利斯仪器系统有限公司;超纯水机,四川优普科技有限公司;PHS-3C型pH计,上海晶磁仪器有限公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;SHB-Ⅲ型循环水真空泵,河南金傅仪器制造有限公司;AG-9620A型精密鼓风干燥箱,上海柏欣仪器设备厂;MULTISKAN GO型全波长酶标仪、Thermo 3111型CO2细胞培养箱,Thermo Fisher公司;ECLIPSE TS100/TS100-F型倒置显微镜,尼康仪器上海有限公司。
1.2 洋葱醇提物总黄酮含量的测定
1.2.1 标准溶液的制备
精密称取10.0 mg芦丁标准品,加适量70%乙醇充分溶解,转移至25 mL容量瓶中,定容至刻度,即得0.4 mg·mL-1芦丁标准溶液。
1.2.2 显色剂的制备
称取12.131 3 g六水三氯化铝,用蒸馏水溶解并稀释至500 mL,即得0.1 mol·L-1AlCl3溶液,再转移至棕色瓶中保存,备用。称取6.799 5 g三水合醋酸钠,用蒸馏水溶解并稀释至250 mL,即得0.2 mol·L-1醋酸钠溶液;量取1.15 mL冰醋酸,用蒸馏水稀释至100 mL,加入到0.2 mol·L-1醋酸钠溶液中,调节pH值至5.2,即得HAc-NaAc缓冲溶液,再转移至棕色瓶中保存,备用。称取亚硝酸钠0.508 0 g,用蒸馏水溶解并稀释至10 mL,即得5%亚硝酸钠溶液。称取1.760 6 g九水硝酸铝,用蒸馏水溶解并稀释至10 mL,即得10%硝酸铝溶液。称取1.013 6 g氢氧化钠,用蒸馏水溶解并稀释至25 mL,即得4%氢氧化钠溶液。
1.2.3 供试溶液的制备
称取新鲜洋葱5 kg,于45 ℃鼓风干燥箱中干燥后,用粉碎机粉碎。称取2 175.00 g洋葱粉末,按料液比1∶10(g∶mL,下同)用70%乙醇回流提取3次,得洋葱醇提物1 634.50 g,于4 ℃冰箱保存,备用[14]。精确称取洋葱醇提物0.281 4 g,用70%乙醇溶解并稀释至100 mL,常温(25 ℃)超声溶解20 min,过滤,即得供试溶液。
1.2.4 最大吸收波长的确定
三氯化铝-醋酸-醋酸钠缓冲溶液显色法:分别移取0.25 mL 0.4 mg·mL-1芦丁标准溶液和1.0 mL供试溶液置于5 mL容量瓶中,加入0.25 mL 0.1 mol·L-1AlCl3溶液和0.5 mL HAc-NaAc缓冲溶液,用70%乙醇稀释至刻度;常温下显色15 min后,在300~700 nm范围内进行全波长扫描。
亚硝酸钠-硝酸铝-氢氧化钠显色法:分别移取0.1 mL 0.4 mg·mL-1芦丁标准溶液和0.16 mL供试溶液置于5 mL容量瓶中,加入0.15 mL 5%亚硝酸钠溶液,静置6 min;然后加入0.15 mL 10%硝酸铝溶液,静置6 min;再加入2 mL 4%氢氧化钠溶液,用70%乙醇稀释至刻度,静置12 min;常温下显色完毕后,在300~700 nm范围内进行全波长扫描。
1.2.5 显色条件的优化
1.2.5.1 单因素实验
准确量取供试溶液1.0 mL于5 mL容量瓶中,加入0.1 mol·L-1AlCl3溶液和HAc-NaAc缓冲溶液,用70%乙醇稀释至刻度,显色。采用单因素实验分别考察显色温度(25 ℃、30 ℃、40 ℃、50 ℃、60 ℃)、显色时间(7 min、12 min、17 min、22 min、27 min、32 min)、0.1 mol·L-1AlCl3溶液用量(0.25 mL、0.50 mL、0.75 mL、1.00 mL、1.25 mL)和HAc-NaAc缓冲溶液用量(0.50 mL、0.70 mL、0.90 mL、1.10 mL、1.30 mL)对洋葱醇提物总黄酮含量测定的影响。
1.2.5.2 响应面法
在单因素实验的基础上,选取显色时间(A)、0.1 mol·L-1AlCl3溶液用量(B)、HAc-NaAc缓冲溶液用量(C)为考察因素,设计3因素3水平响应面实验,进一步优化洋葱醇提物总黄酮含量测定的显色条件。
1.2.6 含量测定
洋葱醇提物中主要黄酮类成分为异槲皮苷和槲皮素。参照文献[14],从洋葱样品中提取、分离、纯化得到异槲皮苷,采用HPLC法测定洋葱醇提物中异槲皮苷和槲皮素含量。
1.3 体外降脂活性评价
1.3.1 溶液的制备
精密称取0.042 3 g洋葱醇提物(总黄酮提取率75.15%,与洋葱总多酚对比换算),加入1 mL DMEM培养基,50 ℃水浴2 h,即得42.3 mg·mL-1洋葱醇提物溶液,经0.22 μm除菌过滤器除菌,于-20 ℃冰箱保存;称取0.005 0 g辛伐他汀,加入122 μL无水乙醇和190 μL 0.1 mol·L-1NaOH溶液,50 ℃水浴2 h,用HCl溶液调节pH值至7.2,经0.22 μm无菌滤头过滤,得16 mg·mL-1辛伐他汀溶液,于-20 ℃冰箱保存。参照文献[15-16]配制5 mmol·L-1游离脂肪酸(10 mmol·L-1OA∶5 mmol·L-1PA=2∶1,5%d-BSA),同时配制5%d-BSA,均经0.22 μm无菌滤头过滤,分装,于-20 ℃保存。
1.3.2 细胞存活率的测定
使用89%高糖DMEM培养基、10%热灭活FBS、1%青霉素(100 U·mL-1)及链霉素(100 μg·mL-1)配制完全培养基,在5%CO2、37 ℃、饱和湿度的培养箱中培养HepG2细胞;将处于指数生长期的HepG2细胞以每孔3 000~4 000个的密度接种至96孔板中,培养24 h,作为阴性对照组(NC);然后弃培养液,分组实验,模型组(FFA)为加入1 mmol·L-1FFA(使用培养液稀释且d-BSA终浓度为1%,下同),低浓度洋葱醇提物组(ACE-L)为加入1 mmol·L-1FFA和总黄酮终浓度为111.17 μg·mL-1的洋葱醇提物,中浓度洋葱醇提物组(ACE-M)为加入1 mmol·L-1FFA和总黄酮终浓度为222.34 μg·mL-1的洋葱醇提物,高浓度洋葱醇提物组(ACE-H)为加入1 mmol·L-1FFA和总黄酮终浓度为333.52 μg·mL-1的洋葱醇提物,阳性对照组(PC)为加入1 mmol·L-1FFA和2 μg·mL-1辛伐他汀,每孔溶液总体积均为100 μL;24 h后,弃每孔液体,加入CCK-8溶液(基础培养基与CCK-8按体积比10∶1配制)110 μL,37 ℃孵育1.5 h后,采用酶标仪在450 nm处进行酶联免疫吸附测定吸光度(OD)。按下式计算细胞存活率:

1.3.3 降脂活性的评价
将处于指数生长期的HepG2细胞2 mL(约每孔5×105个)接种至6孔板中,待细胞密度达到60%~70%(24 h后),吸出培养液,PBS缓冲液清洗2次;以1 mmol·L-1FFA作用24 h诱导肝脂肪变性模型[15],按1.3.2分组进行实验,加入溶液总体积为2 mL;建模的同时加药处理,24 h后根据试剂盒说明分别进行油红O染色,测定细胞内甘油三酯和总胆固醇含量。
1.4 数据统计分析

2 结果与讨论
2.1 最佳显色剂和最大吸收波长的确定(图1)
从图1可以看出,标准品-亚硝酸钠-硝酸铝-氢氧化钠显色体系的紫外吸收光谱多刺不光滑,且吸收峰个数较多,不适合作为洋葱醇提物总黄酮含量测定的显色剂。故采用三氯化铝-醋酸-醋酸钠缓冲溶液显色剂,最大吸收波长为414 nm。
2.2 单因素实验结果(图2)
从图2可以看出,当显色温度、显色时间、0.1 mol·L-1AlCl3溶液用量、HAc-NaAc缓冲溶液用量分别为25 ℃、22 min、0.75 mL、1.10 mL时,吸光度最高。
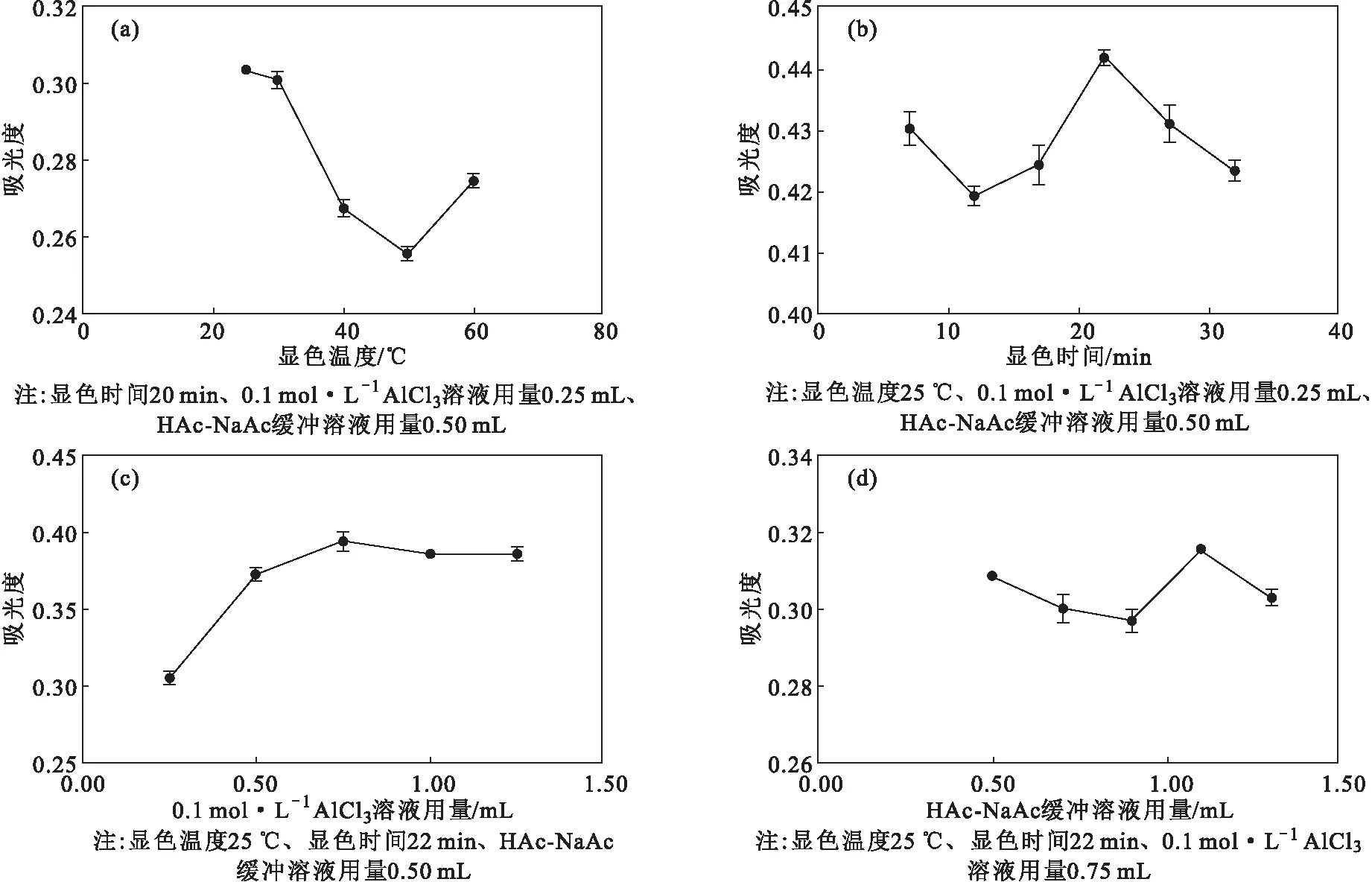
图2 单因素实验结果Fig.2 Results of single-factor experiments
故显色温度、显色时间、0.1 mol·L-1AlCl3溶液用量、HAc-NaAc缓冲溶液用量分别选取25 ℃、22 min、0.75 mL、1.10 mL较为适宜。
2.3 响应面实验结果
2.3.1 响应面实验设计及结果(表1)

表1 响应面实验设计及结果
对表1数据进行拟合,得到回归模型方程为:Y=0.3934-0.0020A+0.0290B+0.0001C-0.0069AB-0.0016AC-0.0030BC-0.0057A2-0.0102B2-0.0017C2。
回归模型的方差分析见表2。
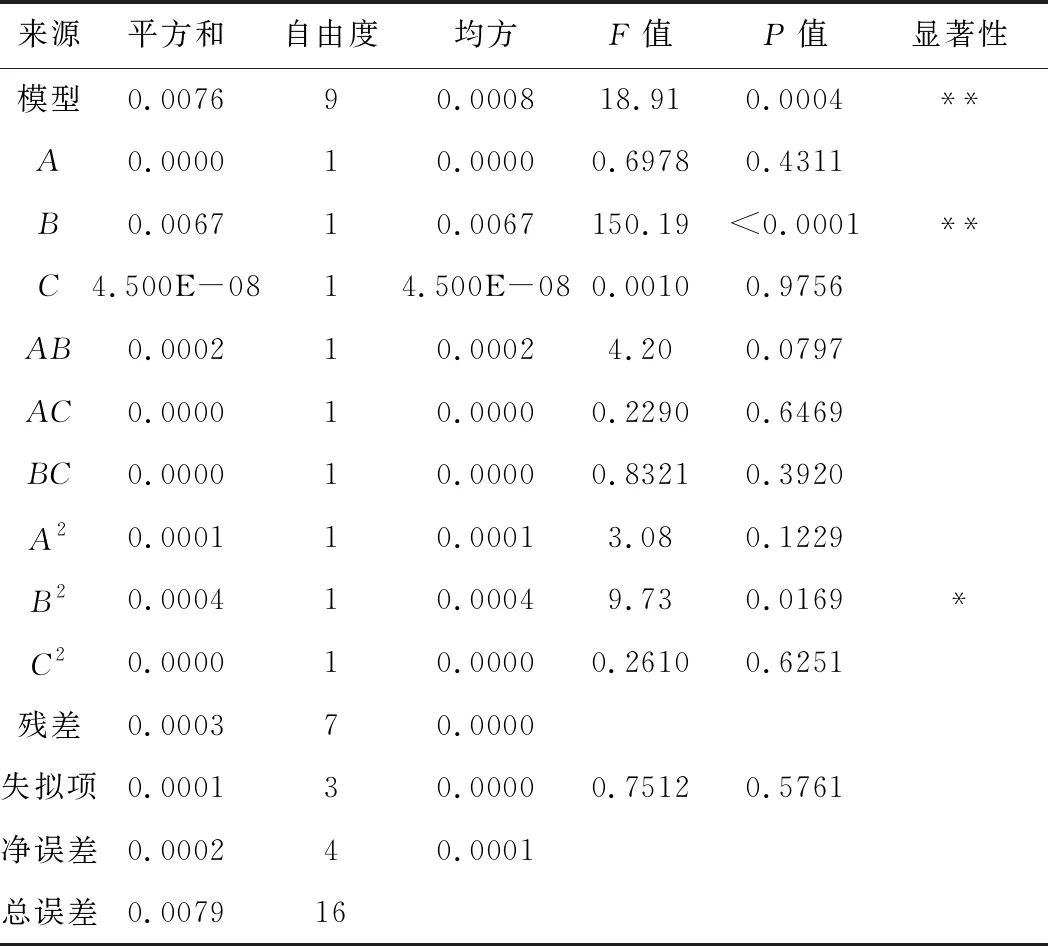
表2 回归模型的方差分析
从表2可以看出,模型F=18.91,P=0.0004<0.01,极显著;失拟项P=0.5761,不显著,表明模型有意义。R2=0.9605,表明模型拟合较好。
2.3.2 响应面分析
各因素交互作用对吸光度影响的响应面图及等高线图如图3所示。
从图3可以看出,残差的正态概率分布图及预测值与实际值的分布图接近一条直线,残差与预测值的分布图无序排列,仅显色时间与0.1 mol·L-1AlCl3溶液用量的交互作用影响较显著,响应面模型有意义。

图3 各因素交互作用对吸光度影响的响应面图及等高线图Fig.3 Response surface plots and contour plots for effects of interaction between various factors on absorbance
根据回归模型得到最佳显色条件为:显色时间27 min、0.1 mol·L-1AlCl3溶液用量1.00 mL、HAc-NaAc缓冲溶液用量0.90 mL。
2.4 方法学考察
2.4.1 标准曲线及线性范围
分别精密量取0.075 mg·mL-1芦丁标准溶液1.0 mL、0.8 mL、0.6 mL、0.4 mL、0.3 mL、0.2 mL于5 mL容量瓶中,加入1.00 mL 0.1 mol·L-1AlCl3溶液和0.90 mL HAc-NaAc缓冲溶液,用70%乙醇定容至刻度,常温下显色27 min,测定414 nm处吸光度。以芦丁浓度 (c,mg·L-1)为横坐标、吸光度(A)为纵坐标绘制标准曲线(图4),拟合得线性回归方程为A=0.0606c+0.0214,R2=0.9958。表明,芦丁浓度在3.0~15.0 mg·L-1范围内与吸光度呈良好的线性关系。
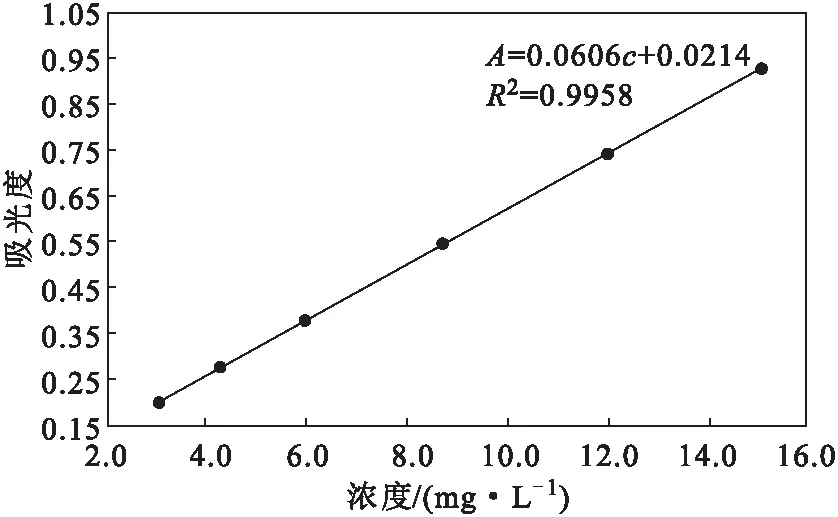
图4 芦丁的标准曲线Fig.4 Standard curve of rutin
2.4.2 精密度
分别吸取5份3.84 mg·mL-1供试溶液各1 mL于5 mL容量瓶中,在最佳显色条件下,测得414 nm处吸光度分别为0.550 6、0.545 3、0.549 2、0.550 1、0.551 7,计算得到总黄酮含量(mg·g-1)分别为8.545 1、8.459 5、8.522 5、8.537 0、8.562 8,RSD值为0.4646%。表明,仪器精密度良好。
2.4.3 稳定性
分别吸取6份3.84 mg·mL-1供试溶液各1 mL于5 mL容量瓶中,加入1.00 mL 0.1 mol·L-1AlCl3溶液和0.90 mL HAc-NaAc缓冲溶液,用70%乙醇定容至刻度,在常温下分别放置20 min、40 min、60 min、80 min、100 min、120 min,测得414 nm处吸光度分别为0.536 0、0.541 8、0.544 7、0.541 6、0.542 6、0.540 4,计算得到总黄酮含量(mg·g-1)分别为8.309 3、8.403 0、8.449 8、8.399 7、8.415 9、8.380 4,RSD值为0.5603%。表明,供试溶液在室温下120 min内稳定。
2.4.4 重复性
分别精密称取6份洋葱粉末各1.0 g,按1.2.3方法制备供试溶液。取供试溶液0.6 mL于5 mL容量瓶中,在最佳显色条件下,测得414 nm处吸光度分别为0.658 8、0.662 3、0.664 7、0.661 6、0.664 4、0.666 9,计算得到总黄酮含量(mg·g-1)分别为8.664 1、8.711 7、8.744 3、8.702 2、8.740 3、8.774 2,RSD值为0.4411%。表明,该方法的重复性较好。
2.4.5 加标回收率
分别精密称取6份洋葱粉末各0.5 g,加入一定量的芦丁标准溶液,按1.2.3方法制备供试溶液,在最佳显色条件下测定414 nm处吸光度,计算加标回收率,结果见表3。
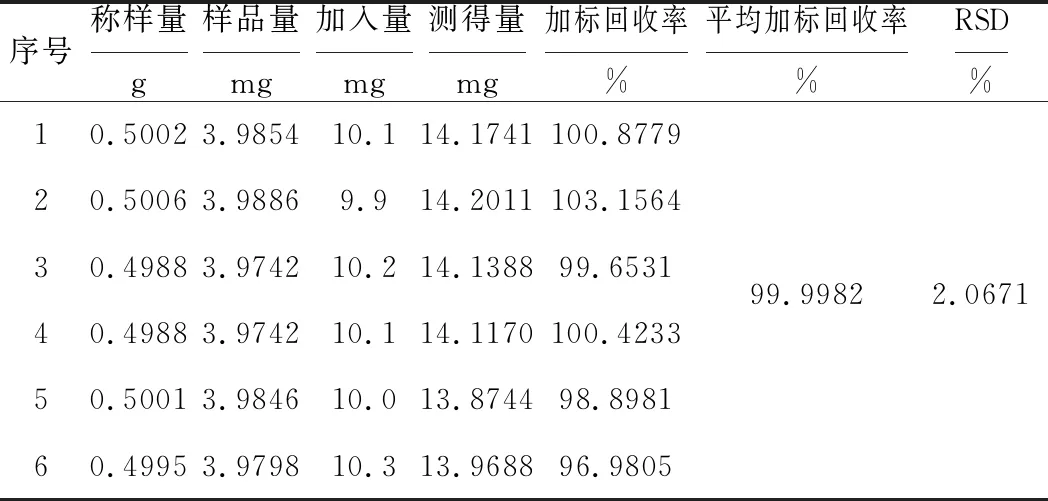
表3 加标回收率结果
2.5 实际样品中总黄酮含量测定
分别吸取3份3.84 mg·mL-1供试溶液各1 mL,在最佳显色条件下,测得414 nm处吸光度分别为0.546 4、0.559 4、0.559 8,计算得到总黄酮含量(mg·g-1)分别为8.477 2、8.687 2、8.693 6,总黄酮平均含量为8.619 3 mg·g-1,与预测值(8.364 3 mg·g-1)的相对误差为2.96%。
2.6 降脂活性
2.6.1 洋葱醇提物对HepG2细胞的毒性(图5)

图5 洋葱醇提物对HepG2细胞的毒性Fig.5 Cytotoxicity of alcohol extract of Allium cepa L.to HepG2 cells
从图5可以看出,与正常培养的阴性对照组相比,加入FFA后的不同处理组的细胞存活率均略微下降;与模型组相比,中、高浓度洋葱醇提物组的细胞存活率差别不大,低浓度洋葱醇提物组的细胞存活率略微上升。表明,中、高浓度洋葱醇提物和FFA共同作用24 h对HepG-2细胞毒性没有明显的抑制作用。
2.6.2 细胞内甘油三酯和总胆固醇的含量
FFA诱导肝脂肪变性24 h后,通过油红O染色判断是否建模成功。结果发现,与阴性对照组相比,模型组细胞内脂质的积累明显,洋葱醇提物组细胞内脂质的积累均降低。绘制标准曲线,拟合得线性回归方程:甘油三酯,y=0.0129x+0.0941,R2=0.9932;总胆固醇,y=0.0029x+0.0563,R2=0.9905;总蛋白,y=0.0001x+0.1608,R2=0.9978。计算细胞内甘油三酯和总胆固醇的含量,结果显示,与阴性对照组相比,模型组细胞内甘油三酯和总胆固醇含量均显著增加,洋葱醇提物组则以剂量依赖方式抑制FFA诱导的甘油三酯和总胆固醇积累(图6)。

注:与模型组比较,*表示P<0.05、**表示P<0.01、
2.7 讨论
由于亚硝酸钠-硝酸铝-氢氧化钠显色剂不仅能与黄酮类化合物反应,还能与酚酸、原花色素等非黄酮类化合物反应,干扰测定结果,专属性不强。因此,本研究选择三氯化铝-醋酸-醋酸钠缓冲溶液作显色剂,与陈爱洋等[17]选择的显色剂一致。王彩虹等[18]以芦丁为标准品,采用三氯化铝-亚硝酸钠-氢氧化钠显色剂测定的洋葱总黄酮含量为8.35 mg·g-1。本研究在单因素实验的基础上,进一步通过响应面法[19-20]优化显色条件,测得洋葱醇提物总黄酮含量为8.619 3 mg·g-1。
黄酮醇是洋葱的主要黄酮类化合物,包括槲皮素、山萘酚、异鼠李素、杨梅黄酮及其衍生物[21-22]。研究表明,黄酮类化合物具有抗氧化、降脂以及改善代谢性综合征等作用[8,23]。氧化应激的产生是脂质代谢紊乱的一大诱因,增加抗氧化剂的摄入量可能会降低肥胖的发生率[24]。Nuutila等[25]、Prakash等[26]已报道了洋葱通过抑制脂质过氧化和清除自由基发挥抗氧化作用;作者所在课题组前期也证明了洋葱醇提物及洋葱皮醇提物具有一定的抗氧化作用[27-28]。此外,NAFLD的临床病理特征是肝脂肪变性和脂肪堆积,Emamat等[9]和El-Din等[29]均研究发现,给大鼠喂食高脂肪饮食诱导NAFLD后,实验组食用洋葱可以正调节与NAFLD疾病相关的生化和组织学标志物。本研究中,通过FFA诱导HepG2细胞建立肝脂肪变性模型,油红O染色表明建模成功;进一步实验证明洋葱醇提物在一定浓度范围内有降低细胞内甘油三酯和总胆固醇含量的作用。并且,作者所在课题组前期研究发现,洋葱醇提物可以通过下调HMGCR和上调LDLR来缓解SD大鼠的高脂血症[14]。
3 结论
以三氯化铝-醋酸-醋酸钠缓冲溶液为显色剂,采用紫外分光光度法测定洋葱醇提物总黄酮含量,通过单因素实验结合响应面法优化洋葱醇提物总黄酮含量测定的显色条件,确定最佳显色条件为:显色温度25 ℃、显色时间27 min、0.1 mol·L-1AlCl3溶液用量1.00 mL、HAc-NaAc缓冲溶液(pH值5.2)用量0.90 mL,在该显色条件下,洋葱醇提物总黄酮含量为8.619 3 mg·g-1,与预测值(8.364 3 mg·g-1)的相对误差为2.96%。体外降脂实验发现,与模型组相比,洋葱醇提物使细胞内甘油三酯和总胆固醇含量降低,且高浓度组具有统计学差异(P<0.05)。洋葱醇提物含有较丰富的黄酮类化合物,其降脂活性可能是黄酮类化合物异槲皮苷、槲皮素等与其它活性成分协同作用的结果,有望进一步研究开发用来防治非酒精性脂肪肝。

