胸腔镜手术与正中开胸二尖瓣成形术治疗二尖瓣反流的效果比较
罗 磊 杨柳山 范 悦 曾 慧
(广西中医药大学附属瑞康医院胸心血管外科,广西南宁市 530011)
心脏外科手术微创化的目的是降低手术创伤、加快患者恢复、节约用血等,其中全胸腔镜微创心脏手术已在临床中广泛开展[1-2]。我国于2001年首次报道腔镜瓣膜成形术,随后其发展迅速,但受医疗技术、器械及地域经济条件差异的影响,我国胸腔镜心脏瓣膜术主要集中在少数几个大型医疗中心,西部等经济欠发达地区仍开展较少,各地发展极不均衡[3-4],使民众对腔镜手术的效果及费用等仍心存疑虑。本文回顾性分析完成二尖瓣成形术患者的临床资料,比较胸腔镜手术与正中开胸手术的有效性、安全性、经济性及社会适应性,旨在为医疗机构及患者选择合适的手术方式提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月至2020年12月在我院接受二尖瓣成形术的65例二尖瓣反流患者的临床资料,其中男31例、女34例,年龄34~60(43.6±16.1)岁。术前所有患者均通过超声心动图、心电图及胸部X线片等检查诊断为二尖瓣反流,且具备手术指征,无绝对手术禁忌证。根据手术方式将患者分为胸腔镜组(n=30)和正中开胸组(n=35)。两组患者的心脏瓣膜病变均以退行性病变为主,其次为缺血性及风湿性病变。两组患者的年龄、性别、体重、BMI、心功能分级、机体基础疾病(高血压、糖尿病、肝肾功能不全、心房颤动、心肌梗死)、病变类型比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会审核批准,所有患者及其家属均在术前签署知情同意书。
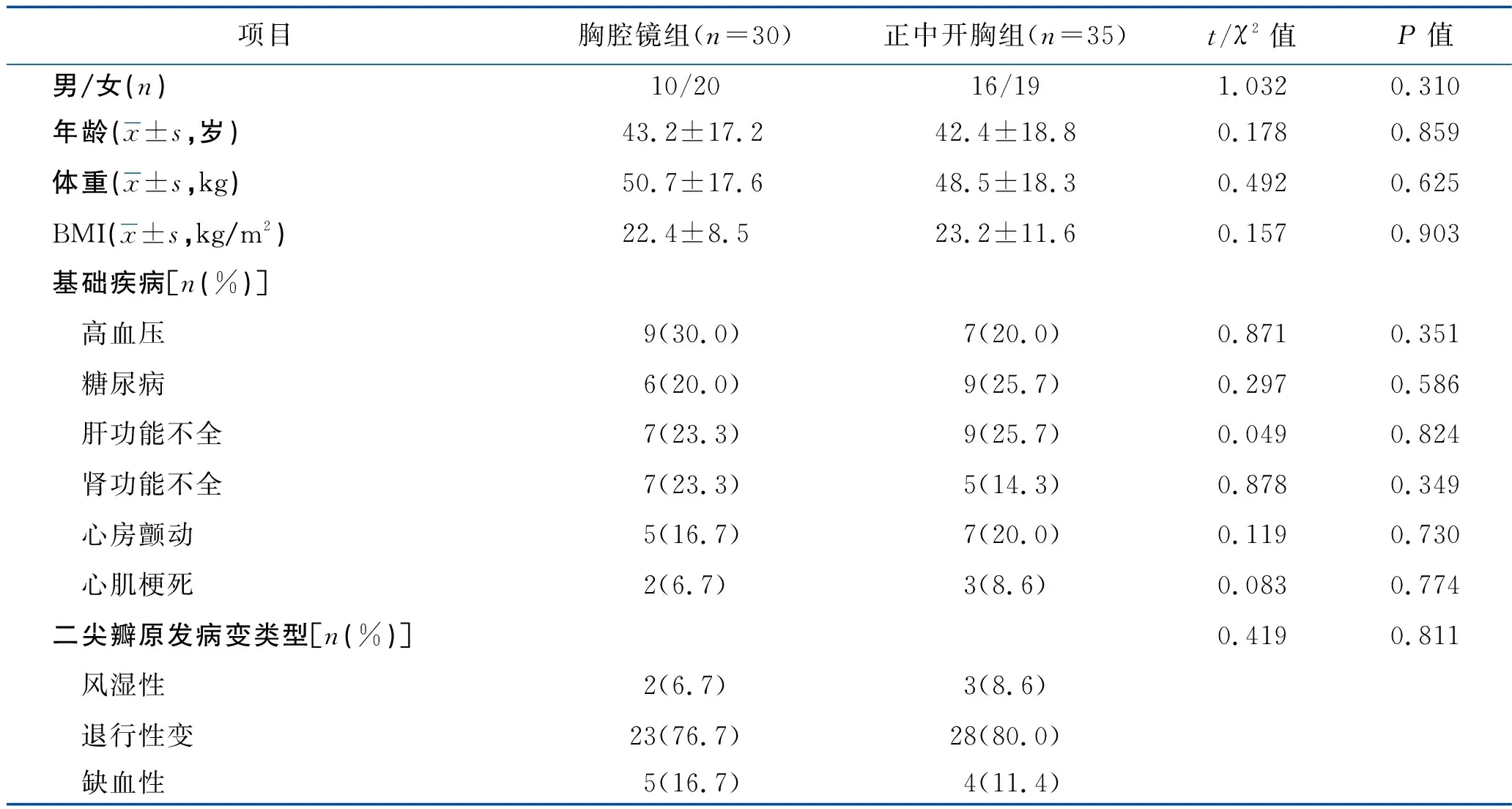
表1 两组患者的一般资料比较
1.2 手术方法 两组患者均取仰卧位,胸腔镜组右侧胸廓垫高30°~40°,右上臂悬吊于麻醉架上。两组均在全身麻醉浅低温体外循环心脏停搏下进行手术,胸腔镜组采用双腔气管插管,经股动脉(17~19F)、股静脉(21~25F)-下腔静脉及右侧颈内静脉(15~17F)-上腔静脉插管建立体外循环,通过升主动脉顺行灌注冷晶体心肌停搏液(HTK液)2 000 mL。于右侧第4肋间锁骨中线外5 cm做一切口,设为主操作孔,于右侧第5肋间腋中线外做一切口,设为腔镜孔及放置主动脉阻断钳,经左房房间沟路径行二尖瓣手术;如需同期行三尖瓣手术,经右房-房间隔路径套带阻断上、下腔静脉隔离右心。正中开胸组采用单腔气管插管,经胸骨上窝至剑突下,电锯劈开胸骨,在升主动脉及上、下腔静脉分别插管建立体外循环,经主动脉根部间歇顺行性灌注冷血心肌停搏液600~1 500 mL,每30 min灌注一次,经左房房间沟或右心房-房间隔切口直视下完成二尖瓣成形手术。见图1。两组患者术后进行相同的护理及药物治疗。
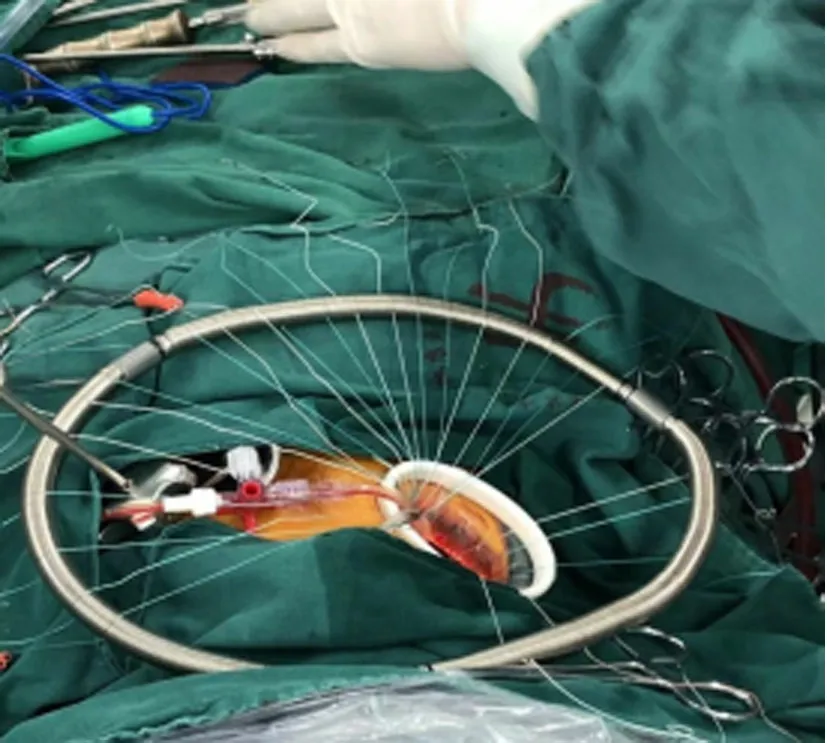
A.胸腔镜手术路径
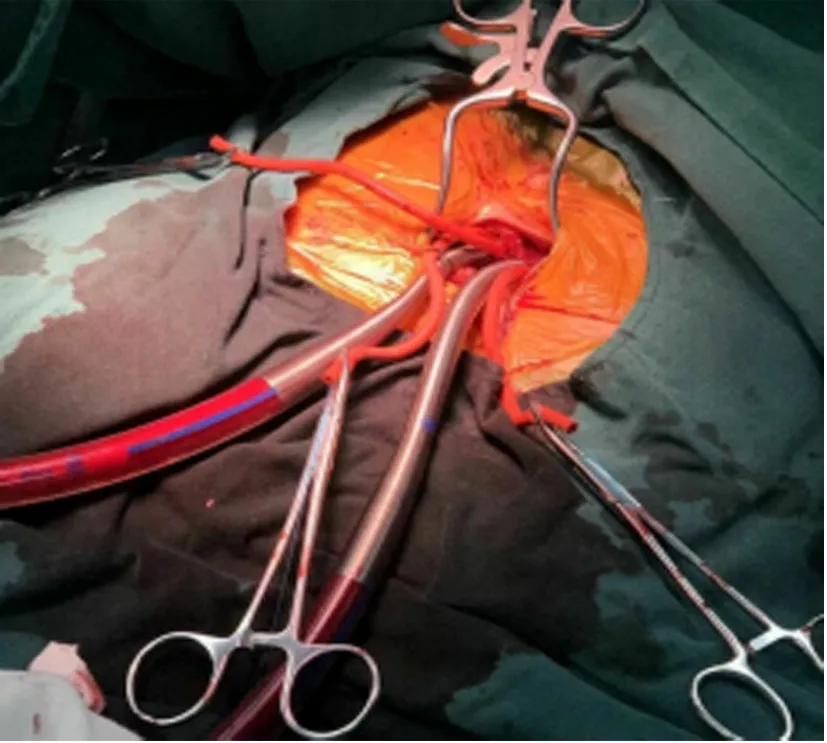
B.股动、静脉插管
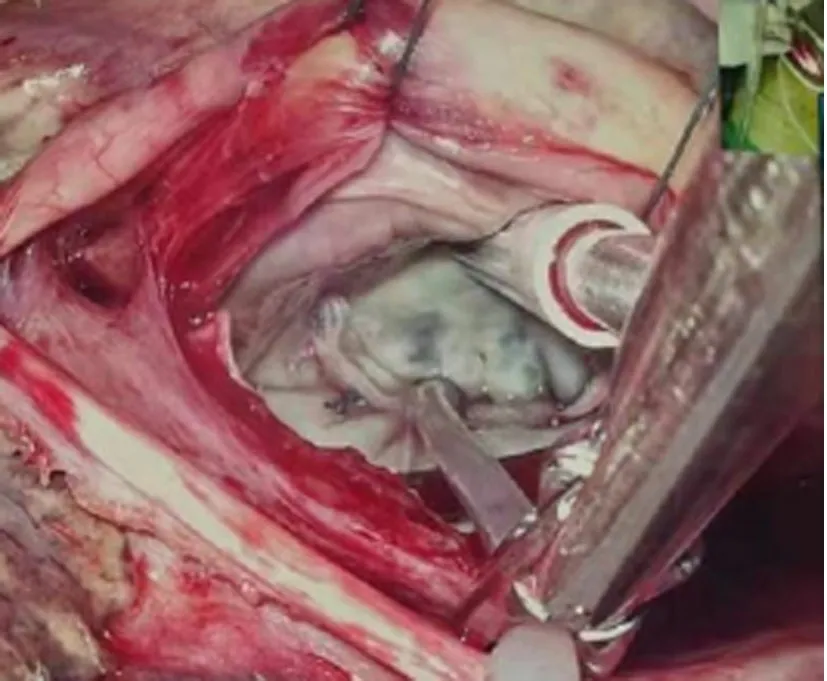
C.后瓣叶成形环
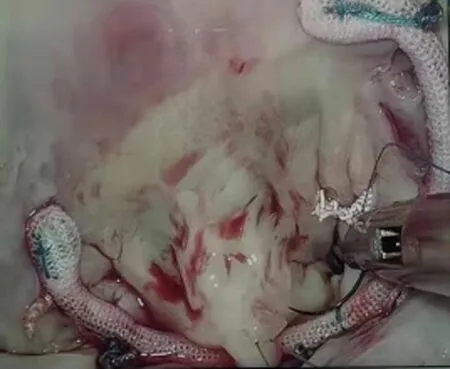
D.P3区人工腱索+半成型环图1 胸腔镜二尖瓣成形术影像
1.3 观察指标 (1)治疗效果:比较两组患者的手术情况及围术期心肺功能指标,其中手术情况包括手术时间、体外循环时间、主动脉阻断时间、开放辅助时间、关胸时间、机械通气时间、ICU 停留时间、总住院时间、血液制品输注总量、二次开胸止血率、二次阻断率,围术期心肺功能指标包括术后经胸超声心动图测定的二尖瓣反流情况及术前1周和术后2周的左室射血分数(left ventricular ejection fraction,LVEF)、左心房内径(left atrial diameter,LAD)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVED)、用力肺活量(forced vital capacity,FVC)、第1秒用力呼气容积(forced expiratory volume in one second,FEV1)。(2)安全性:每3~6个月通过电话及门诊对患者进行随访,共随访2年,记录其术后呼吸道感染、伤口愈合不良、心律失常等并发症发生情况及生存情况、心功能变化情况。(3)经济效益:比较两组患者的住院费用。
1.4 统计学方法 采用SPSS 23.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验;计数资料以例数(n)和百分比(%)表示,组间比较采用χ2检验或Fisher确切概率法,等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况比较 胸腔镜组的手术时间、体外循环时间、主动脉阻断时间均长于正中开胸组,关胸时间短于正中开胸组,红细胞、新鲜冰冻血浆、人血白蛋白输注量及血液制品输注总量均少于正中开胸组(均P<0.05),但两组患者的开放辅助时间、二次阻断率、二次开胸止血率、机械通气时间、ICU停留时间、总住院时间比较,差异均无统计学意义(均P>0.05)。见表2。胸腔镜组有3例、正中开胸组有4例患者术中心脏复跳后,经食管超声检查提示瓣膜成形效果欠佳,再次阻断主动脉体外转机行二次瓣膜成形术,效果良好。
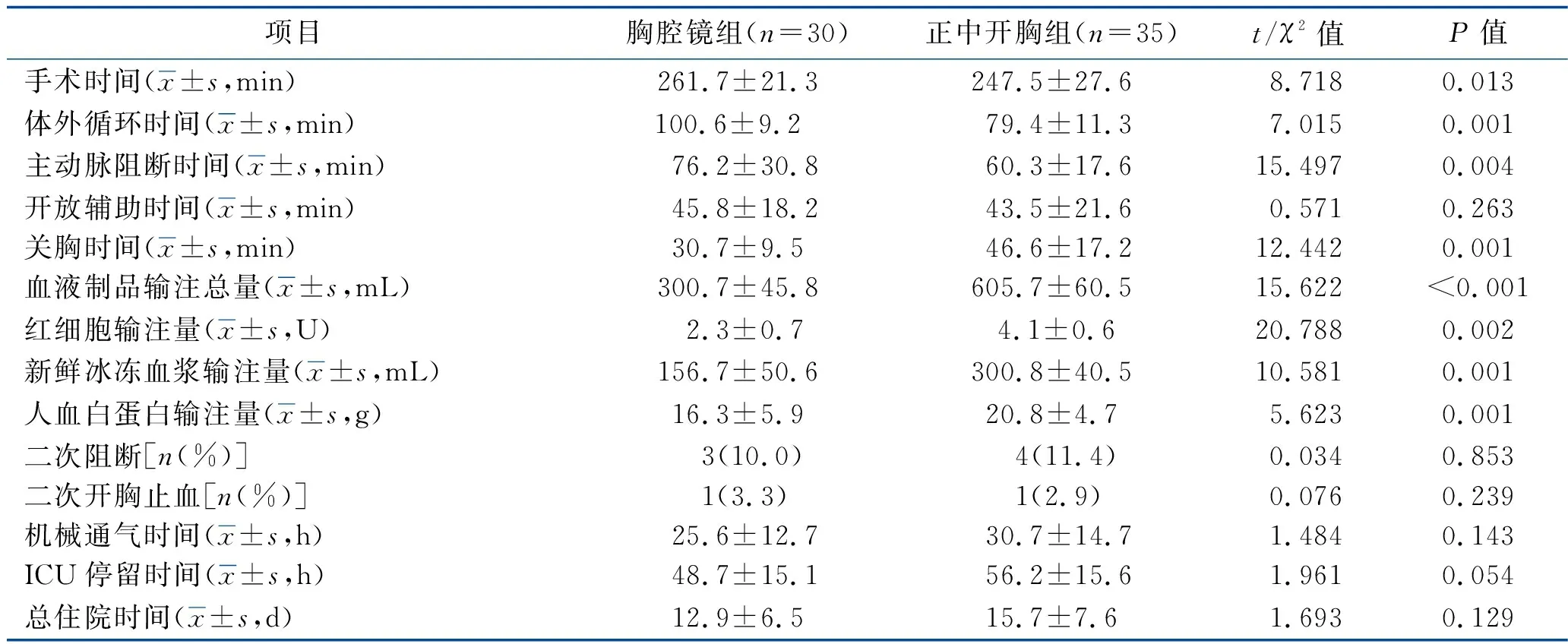
表2 两组患者的手术情况比较
2.2 围术期心肺功能指标比较 术前1周,两组LVEF、LAD、LVED、FVC、FEV1比较,差异均无统计学意义(均P>0.05)。术后2周,两组LVEF、LAD、LVED、FEV1比较,差异均无统计学意义(均P>0.05),但两组LAD、LVED、FEV1均小于术前(均P<0.05),两组LVEF与术前差异无统计学意义(P>0.05);两组FVC均较术前下降且正中开胸组低于胸腔镜组(均P<0.05)。两组术后均无二尖瓣中度、重度反流,两组二尖瓣反流情况差异无统计学意义(P>0.05)。见表3。
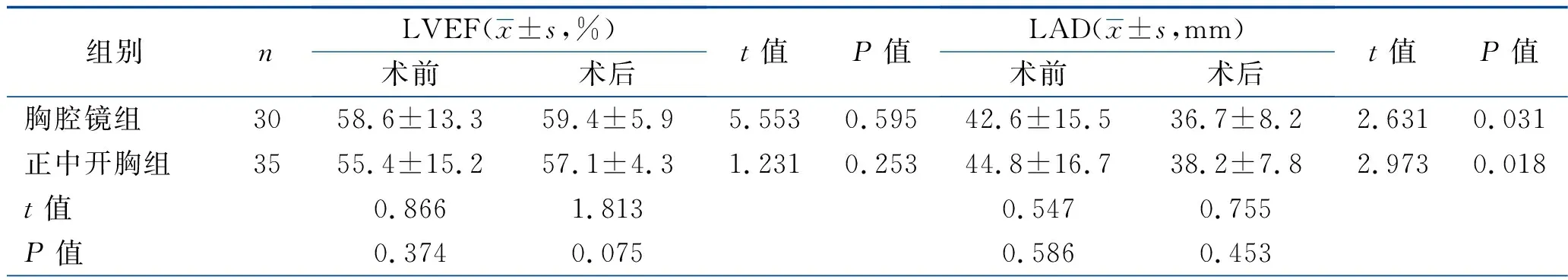
表3 两组患者的围术期心肺功能指标比较
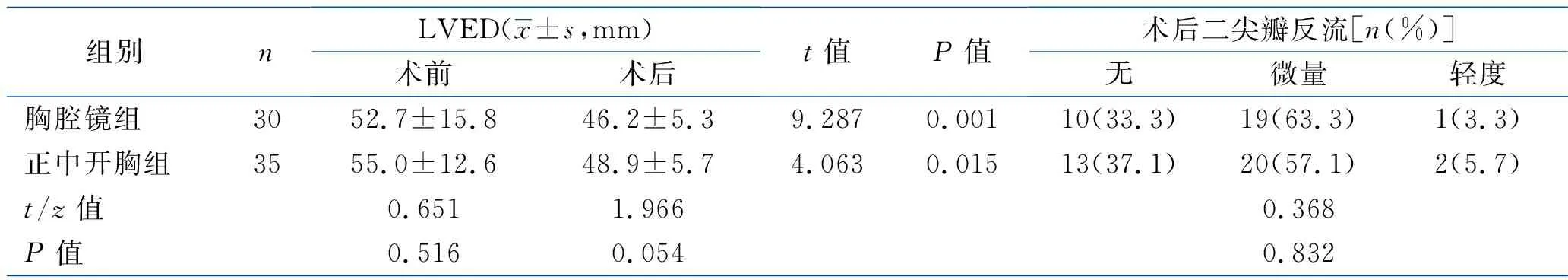
组别nLVED(x±s,mm)术前术后t值P值术后二尖瓣反流[n(%)]无微量轻度胸腔镜组3052.7±15.846.2±5.39.2870.00110(33.3)19(63.3)1(3.3)正中开胸组3555.0±12.648.9±5.74.0630.01513(37.1)20(57.1)2(5.7)t/z值0.6511.9660.368P值0.5160.0540.832
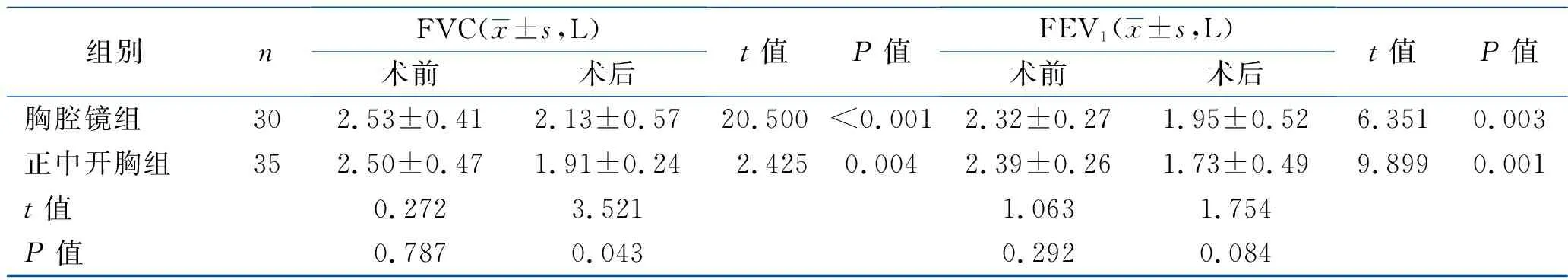
组别nFVC(x±s,L)术前术后t值P值FEV1(x±s,L)术前术后t值P值胸腔镜组302.53±0.412.13±0.5720.500<0.0012.32±0.271.95±0.526.3510.003正中开胸组352.50±0.471.91±0.242.4250.0042.39±0.261.73±0.499.8990.001t值0.2723.5211.0631.754P值0.7870.0430.2920.084
2.3 术后并发症发生率、围术期死亡率及住院费用比较 正中开胸组围术期死亡1例,为术后严重肺部感染致多器官功能衰竭致死;胸腔镜组无死亡病例。两组患者的死亡率、呼吸道感染率、伤口愈合不良率、心律失常率、住院费用比较,差异均无统计学意义(均P>0.05)。见表4。
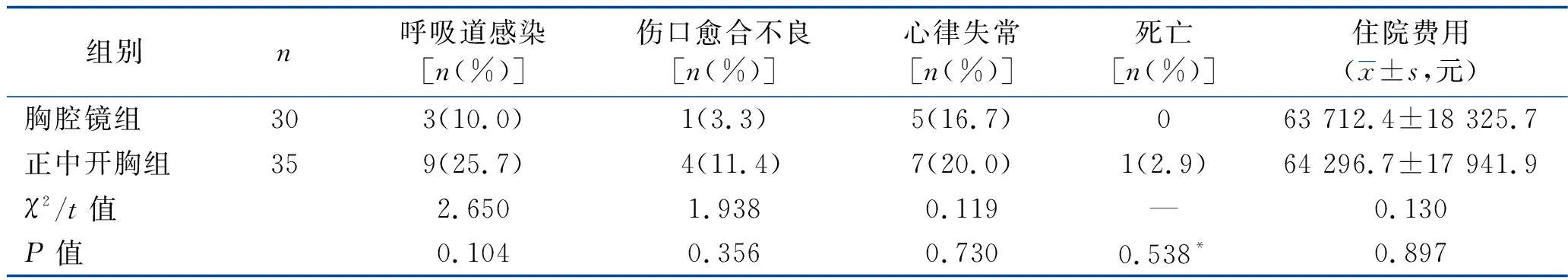
表4 两组患者术后并发症发生率、围术期死亡率及住院费用比较
2.4 心功能比较 两组患者术前、术后1年、术后2年的心功能分级差异均无统计学意义(均P>0.05)。见表5。
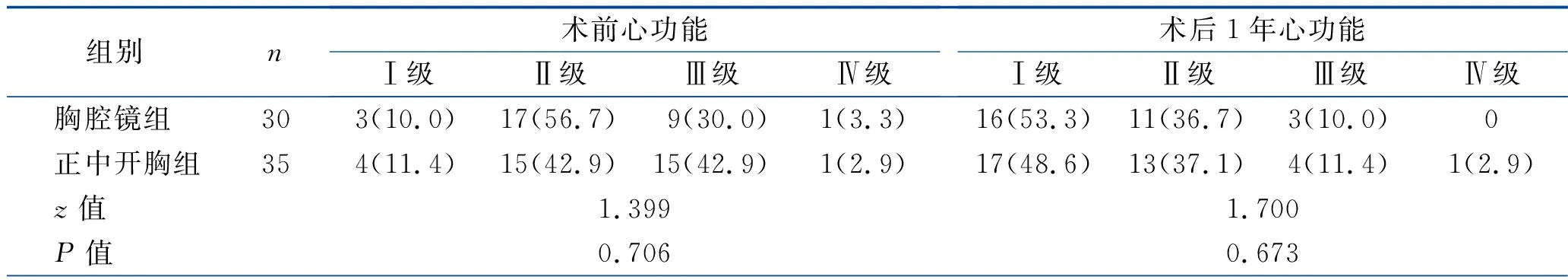
表5 两组患者心功能比较 [n(%)]

续表5
3 讨 论
心脏瓣膜病起病隐匿,病程较长,早期多无明显临床症状,但疾病后期患者的心肺功能储备下降,多合并多器官功能不全,治疗难度大。严重的二尖瓣病变可引起左心房室负荷增加,心排血量降低[5-6]。但瓣膜中度以上关闭不全病变采用单纯药物治疗的效果较差,外科手术是其主要的干预方式,经典手术方式有正中开胸二尖瓣成形术和置换术,术中需破坏胸骨,创伤较大且不美观[6]。研究显示,二尖瓣成形术可以很好地维护左心室的几何形态结构及功能,保留左束支至浦肯野纤维网的传导,减少抗凝及血栓栓塞等并发症的发生,在改善患者预后及提高生活质量方面具有良好的效果[7-8]。现代微创外科的核心理念是尽量避免和减少医源性创伤,胸腔镜二尖瓣成形术能在有限的损伤下完成手术[9]。因此,随着微创技术的发展,胸腔镜在心脏外科中的应用逐渐增多,但民众对胸腔镜心脏手术的安全性、有效性及费用等知之甚少,仍心存顾虑,这在一定程度上阻碍了胸腔镜心脏手术技术的进步及推广。因此,本研究比较了胸腔镜手术与同期传统手术(正中开胸二尖瓣成形术)治疗二尖瓣反流患者的安全性、手术效果、经济效益、社会适应性。
本研究结果显示,胸腔镜组关胸时间短于正中开胸组,且红细胞、新鲜冰冻血浆、人血白蛋白输注量及血液制品输注总量均少于开胸组(均P<0.05),但两组患者的二次阻断率、二次开胸止血率、ICU停留时间、机械通气时间、总住院时间差异均无统计学意义(均P>0.05)。这说明,采用胸腔镜手术治疗二尖瓣反流患者可以缩短手术切口关闭时长,减少血液制品消耗。此外,该术式不增加二次阻断率和二次开胸止血率,这可能是因为其仅需在胸壁做两个小切口,能较好地保持胸骨完整,减少创伤,且胸腔镜手术视野大、瓣膜及瓣下结构显露清晰,器械缝合准确,因而二尖瓣成形效果良好。本研究结果还显示,两组患者的住院费用差异无统计学意义(P>0.05),提示采用胸腔镜手术治疗二尖瓣反流患者不增加治疗费用。但在胸腔镜下进行心内操作的难度加大,由于术者从直视下操作转变为通过显示屏反映经器械间接操作,手感及视觉维度需要逐渐适应,因此与正中开胸组相比,其技术开展初期的手术总时长、体外循环阻断时间延长,但随着手术例数的不断增加及经验的累积,有望加快手术进度。本研究中,两组患者均成功完成手术,虽然胸腔镜组的体外循环时间和主动脉阻断时间延长,但术后两组的LVEF、LAD、LVED、二尖瓣反流情况、心功能分级、死亡率,以及不良反应(呼吸道感染、伤口愈合不良、心律失常率)发生率的差异均无统计学意义(均P>0.05),正中开胸组患者的FVC低于胸腔镜组(P<0.05)。这提示,采用胸腔镜手术治疗二尖瓣反流患者的疗效和安全性与采用正中开胸二尖瓣成形术治疗相当。这可能是因为:胸腔镜手术的创面小,胸廓完整性未受破坏,术后伤口瘢痕小,疼痛程度轻,患者生理及心理方面的创伤能够较快恢复,能早期下床活动,肢体锻炼及运动康复的依从性好,因而其术后切口愈合不良、呼吸道感染、心律失常等并发症发生率及围术期死亡率并未升高。
微创心脏外科技术具有广阔的应用前景。1996年Carpentier等[10]最早经胸腔镜行二尖瓣成形术,1999年Chitwood等[11]首次报道经胸腔镜辅助小切口完成二尖瓣置换术,随后国外各心脏中心逐步开展腔镜心脏手术,手术方式由腔镜辅助逐渐发展至全腔镜[12-13]。2001年俞世强等[14]报道我国首例胸腔镜辅助下右胸壁三孔二尖瓣置换手术。与传统开胸手术相比,胸腔镜手术优势明显:(1)单侧胸廓入路,双孔或三孔进胸,开关胸迅速;(2)可提供清晰无血的手术视野,放大心内结构,能兼顾处理三尖瓣病变及心房颤动。但其也存在一些不利因素,如操作空间小、器械长且关节相对固定、组织接触端抖动、视野易受烟雾干扰、助手功能弱化等,因此其手术效果受主刀医师操作经验及操作习惯的影响,各项研究的手术效果也存在差异[15-21]。笔者采用胸腔镜手术治疗二尖瓣反流的体会是:(1)如前后瓣叶扩大、瓣叶脱垂、腱索延长、腱索断裂,可选择瓣叶矩形切除[22]、交界成形[23]、腱索转移[24]及人工腱索植入[25]等术式,尽量用简单的方法恢复瓣膜形态及整体高度,重建前后叶对合面,消除瓣叶异常运动(如SAM征);(2)麻醉后经食管超声检查,测量与脱垂瓣叶临近的正常腱索高度,采用loop方法预制人工腱索,缩短体外循环时间;(3)注水测试瓣叶运动情况前,先放松左房拉钩,避免心房牵拉影响瓣叶致误判;(4)综合考虑前瓣叶大小、前后纤维三角的距离及患者体重来选择成型环[26]。
研究显示,微创术中经右侧胸廓入路,双腔气管插管左侧单肺通气,引起右肺萎陷,术后易出现肺不张及肺部感染[27-28]。本研究中,我们监测围术期肺功能,发现两组患者的肺通气功能较术前下降,但胸腔镜组总体肺功能优于正中开胸组,这可能得益于肺保护策略,包括:(1)术前呼吸功能锻炼,呼吸训练器的合理使用;(2)术中进入胸腔时下调肺通气量,尽量减少烧灼、钳夹、暴力牵拉等对肺组织的副损伤;(3)体外循环阶段间断膨肺,减轻肺不张,复温阶段常规超滤,减少肺组织及间质水肿;(4)于手术切口上下肋间行肋间神经阻滞局麻;(5)肺部体疗,术后早期拔除胸腔引流导管,尽早进行床旁活动。
综上所述,采用胸腔镜手术治疗二尖瓣反流患者的疗效和安全性与正中开胸二尖瓣成形术相当,可缩短关胸时间,减少血液制品消耗,减轻患者的经济负担,且不增加术后并发症的发生率,社会效益良好,值得推广应用。但本研究存在一定的不足及局限,包括腔镜系统器械昂贵,尚未能完整配备;风湿性瓣膜病变合并房颤患者未接受同期射频消融术,影响预后;纳入的患者例数相对较少。因此今后仍需要继续增加手术例数、累积操作经验,并联合国内外心脏中心进一步深入研究。

