乳腺癌肺转移患者预后危险因素的分析及诺模图的构建
解松刚, 梁成通, 周丽娟, 王孟婷
(1.江苏省苏北人民医院 医学检验科, 江苏 扬州, 225001;2.扬州大学附属医院 妇产科, 江苏 扬州, 225001)
研究[1]称2020年全球女性乳腺癌新发病例数量超过230万(占所有癌症11.7%), 死亡人数达到了69万,已超过肺癌成为最常见的癌症类型。远处转移是肿瘤患者最重要的预后危险因素之一,而肺转移是乳腺癌较为常见的远处转移类型之一,往往发生在最初诊断乳腺癌的5年内,并对患者的病死率有显著影响[2-3]。肺转移可损伤肺功能,导致咳嗽、呼吸困难、咯血,并最终导致死亡[4]。尽管乳腺癌的治疗技术有了大幅度的提高,但是乳腺癌肺转移(BCLM)患者的预后仍不容乐观。对于局限于肺转移的乳腺癌患者,全身化疗后的中位总生存期(OS)仅为22.5个月左右[5]。有关乳腺癌转移模式的研究[6]称60%~70%的乳腺癌死亡患者发现存在肺转移。然而, BCLM患者预后的危险因素在人群水平上仍未得到很好的评估。
TNM分期系统是通过评估肿瘤浸润深度(T)、是否有区域淋巴结转移(N)和是否有远处转移(M)的方式来预测癌症患者的预后,是目前预测癌症患者预后最为常用的工具[7]。然而, TNM分期系统不能充分覆盖癌症生物学或预测所有类型的恶性肿瘤,尤其是存在远处转移的恶性肿瘤[8]。因此,越来越多的癌症相关的诺模图(Nomogram图)被用于预测癌症患者的预后。与传统的美国癌症联合委员会(AJCC)TNM分期系统相比,列线图能够充分结合多个被认为对预后有影响的因素(如年龄、肿瘤病理类型、肿瘤分化程度、是否手术治疗或放化疗等)来量化评估个体的生存风险, Nomogram图在预测一些恶性肿瘤的预后方面有许多优势,对评估癌症患者生存率有着重要的价值[9]。本研究通过监测、流行病学和最终结果(SEER)数据库收集大量BCLM患者的临床特征数据,探讨BCLM患者的临床特点、肺转移发生情况及其与预后的关系,现将结果报告如下。
1 资料与方法
1.1 一般资料
患者数据来自美国国家癌症研究所SEER数据库,其包含了约28%美国人口的数据。在SEER数据库中,作者确认了2010年1月—2015年12月诊断为恶性乳腺癌的321 755例患者,其中5 334例患者被诊断为肺转移。数据集排除标准: ① 年龄较小者(<20岁); ② 通过尸检或死亡证明得到诊断者; ③ 转移状态未知者; ④ 生存时间未知者。
1.2 研究方法
采用单因素Cox回归模型分析年龄、种族、性别、原发肿瘤部位、分化分级、T分期、N分期、病理类型、是否手术、是否放化疗、区域淋巴结检出数目、其他远处转移位点(骨、脑、肝)、分子亚型、恶性肿瘤数目、婚姻状态、保险状态与BCLM全因死亡率(ACM)的相关性,将差异有统计学意义的因素纳入多因素Cox回归分析模型以得到影响BCLM预后的独立影响因素。
采用Fine-Gray竞争风险模型评估与乳腺癌特异性生存率(BCSS)相关的因素,癌症相关死亡率和竞争风险死亡概率用累积发生率(CIF)表示。生存曲线采用Kaplan-Meier法生成,组间的生存差异采用Log-rank检验评估。采用SPSS 20.0软件(美国IBM公司)进行统计分析,采用R软件(4.1.0)建立BCLM患者生存预测模型,采用受试者工作特征(ROC)曲线、一致性指数、校准曲线来验证模型的稳定性和可靠性。
2 结 果
2.1 研究人群的基线特征
根据纳入标准,共纳入SEER数据库2010—2015年5 334例BCLM患者,并按照2∶1的比例分为建模集3 556例和验证集1 778例。结果表明,建模集与验证集在年龄、种族、性别、原发肿瘤部位、分化分级、T分期、N分期、病理类型、是否手术、是否放化疗、区域淋巴结检出数目、其他远处转移位点(骨、脑、肝)、分子亚型、婚姻状态、保险状态等方面比较,差异均无统计学意义(P>0.05)。见表1。

表1 乳腺癌患者临床病理特征
2.2 各变量对乳腺癌总体生存率的影响
多变量Cox回归结果显示下述因素与BCLM患者的预后具有相关性: 年龄60~79岁(与20~39岁相比,HR=1.41, 95%CI: 1.21~1.65,P<0.001)、年龄≥80岁(与20~39岁相比,HR=2.22, 95%CI: 1.86~2.65,P<0.001); 肿瘤分级为中分化(与高分化相比,HR=1.37, 95%CI: 1.12~1.70,P=0.003)、低分化(与高分化相比,HR=1.86, 95%CI: 1.50~2.30,P<0.001)、未分化(与高分化相比,HR=2.33, 95%CI: 1.51~3.57,P<0.001); T分期为T4期(与T0~1期相比,HR=1.21, 95%CI: 1.10~1.33,P<0.001); 病理组织类型为浸润性小叶癌(与浸润性导管癌相比,HR=1.28, 95%CI: 1.08~1.51,P=0.004)、其他类型(与浸润性导管癌相比,HR=1.09, 95%CI: 1.01~1.19,P=0.042); 手术(与未手术相比,HR=0.77, 95%CI: 0.69~0.84,P<0.001); 化疗(与未化疗相比,HR=0.59, 95%CI: 0.55~0.64,P<0.001); 骨转移(与无骨转移相比,HR=1.30, 95%CI: 1.22~1.40,P<0.001); 脑转移(与无脑转移相比,HR=1.72, 95%CI: 1.56~1.90,P<0.001); 肝转移(与无肝转移相比,HR=1.68, 95%CI: 1.56~1.80,P<0.001); 分子分型为Luminal B型(与Luminal A型相比,HR=0.78, 95%CI: 0.70~0.87,P=0.037)、HER2过表达型(与Luminal A型相比,HR=1.31, 95%CI: 1.12~1.53,P<0.001)。见表2。采用Kaplan-Meier和Log-rank检验方法绘制不同因素下的生存曲线,见图1。
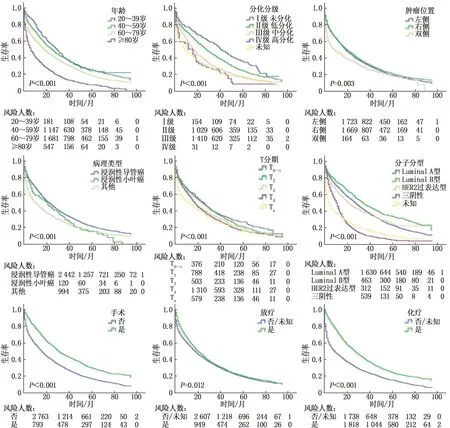
图1 乳腺癌肺转移患者总生存率的部分影响因素的生存曲线分析
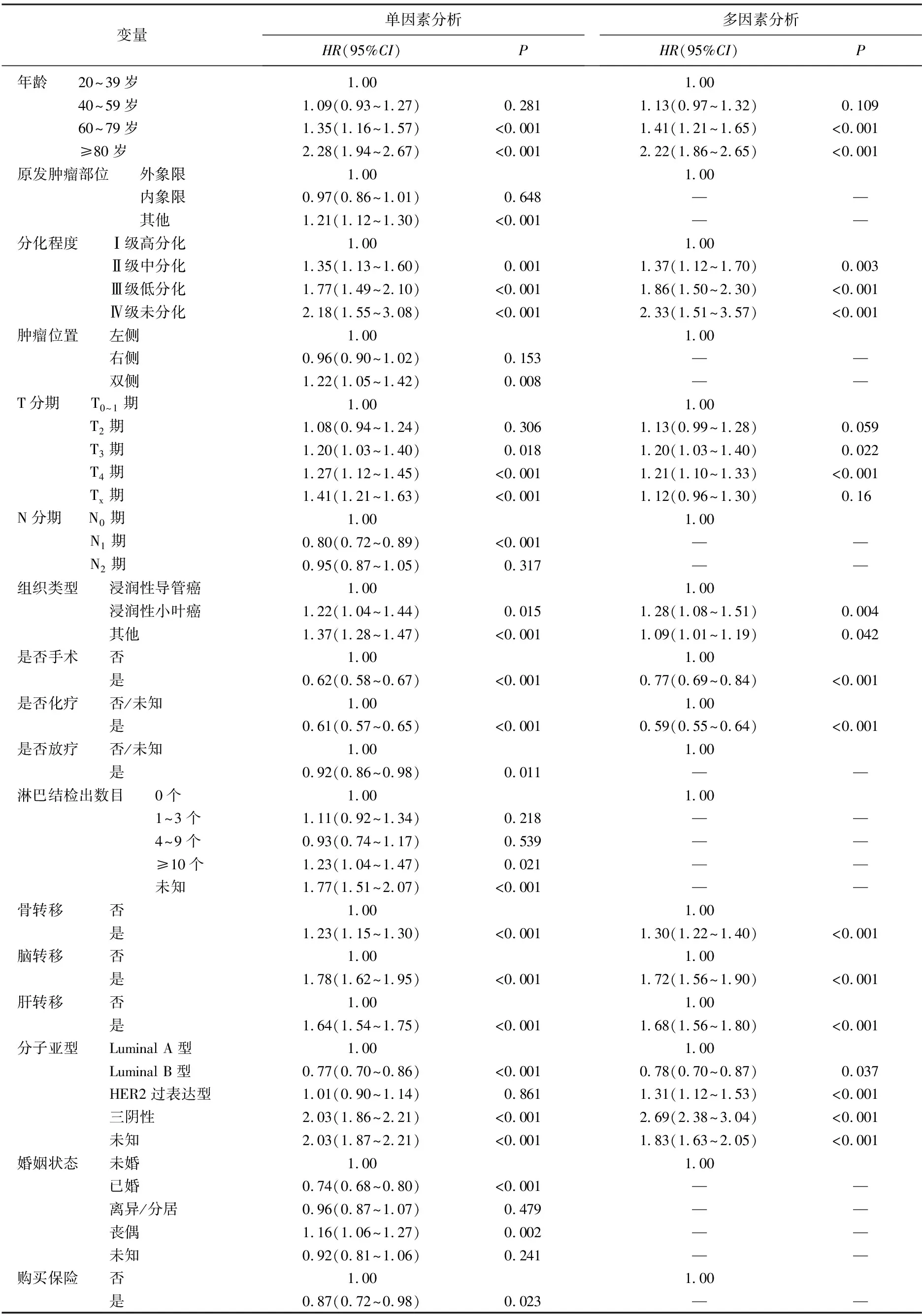
表2 乳腺癌肺转移全因死亡率相关因素的单因素及多因素Cox回归分析
2.3 BCLM患者总生存率预测模型的构建及验证
根据建模及多因素Cox回归分析的结果,将差异有统计学意义的10个因素纳入到Nomogram预测模型,用于预测患者1、3、5年的生存概率,其中一致性指数计算结果为0.724(0.705~0.744)、0.744(0.717~0.771)。采用ROC曲线和3年生存率的校准曲线进行内部和外部的验证,结果显示内部验证ROC曲线的曲线下面积(AUC)为0.738, 外部验证ROC曲线的AUC为0.746。在内部验证和外部验证中, 3年校准曲线展示了预测生存率和实际生存率高度的一致性,说明本研究建立的预测模型具有高度的辨别能力和准确性。见图2、图3。

图2 乳腺癌肺转移患者总生存率的Nomogram预测模型
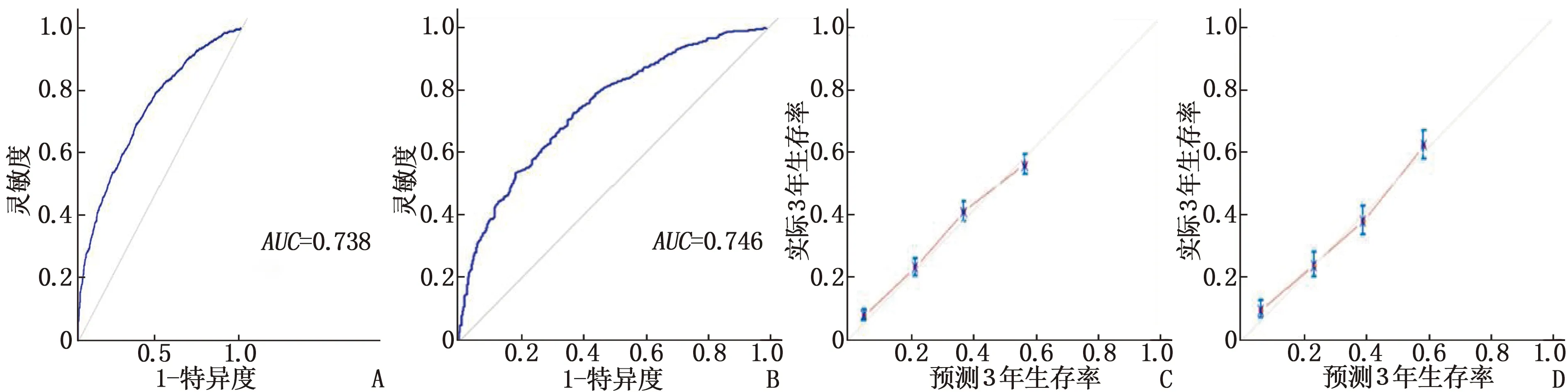
A: 建模集ROC曲线; B: 验证集ROC曲线; C: 建模集3年生存率的校准曲线; D: 验证集3年生存率的校准曲线。
2.4 各变量对BCLM癌症特异性生存率的影响
应用Fine-Gray竞争风险模型对BCLM癌症特异性生存率影响因素进行分析,经过逐步筛选及多因素分析后发现,年龄、分化程度、T分期、手术、化疗、骨转移、脑转移、肝转移、分子亚型是乳腺癌特异性预后的独立影响因素,其中年龄越大、分化程度越低、T分期级别越高、肝转移、骨转移、脑转移、HER2过表达型/三阴性(相较于Luminal A型)是预后的独立危险因素。见图4(各图中a表示因乳腺癌死亡, b表示其他原因导致死亡)。手术、化疗等治疗手段对于BCLM患者仍然有着较好的保护作用,见表3。
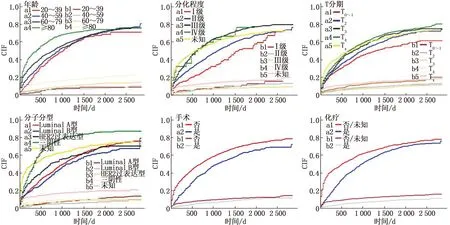
图4 乳腺癌肺转移患者癌症特异性生存率的部分影响因素的生存曲线分析

表3 乳腺癌肺转移患者癌症特异性生存率的影响因素分析
2.5 BCLM患者癌症特异性生存率预测模型的构建及验证
根据建模集Fine-Gray竞争风险模型分析的结果,将差异有统计学意义的9个因素纳入到癌症特异性Nomogram预测模型,用于预测患者1、3、5年的生存概率,见图5。建模集和验证集一致性指数计算结果分别为0.723(0.706~0.745)、0.702(0.684~0.729)。采用ROC曲线和3年生存率的校准曲线进行内部和外部的验证,结果显示,内部验证ROC曲线的AUC为0.722, 外部验证ROC曲线的AUC为0.708。在内部验证和外部验证中, 3年校准曲线展示了预测生存率和实际生存率高度的一致性,说明本研究建立的模型有较好的辨别能力和准确性,见图6。

图5 乳腺癌肺转移患者癌症特异性生存率的Nomogram预测模型
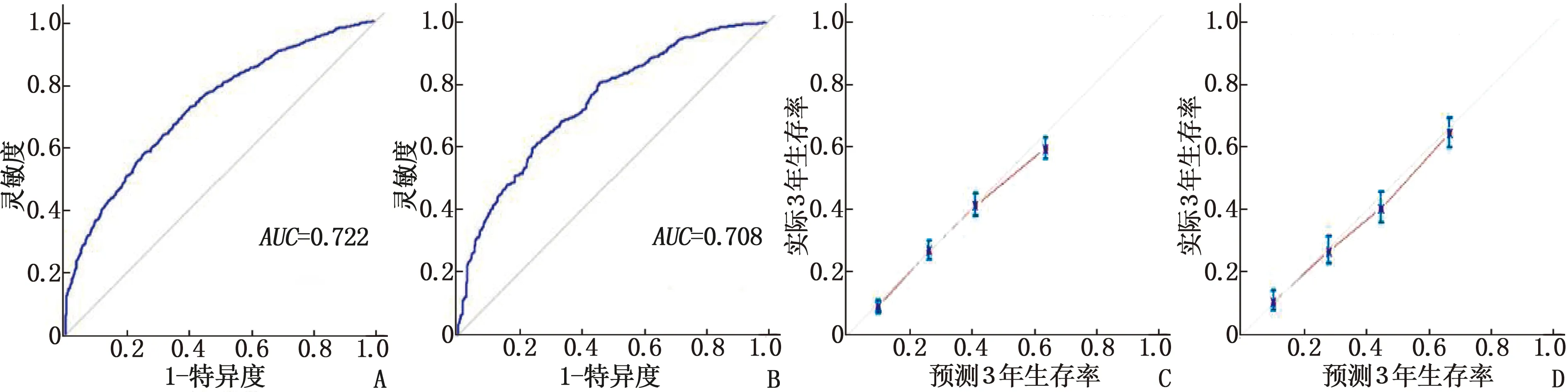
A: 建模集ROC曲线; B: 验证集ROC曲线; C: 建模集3年生存率的校准曲线; D: 验证集3年生存率的校准曲线。
3 讨 论
Nomogram图具有准确性高、辨识能力强、易于利用和推广等特点,已被广泛应用于胃癌[10]、小细胞肺癌[11]、前列腺癌[12]等癌症分析中。本研究应用列线图对SEER数据库中确定的与BCLM患者预后相关的独立危险因素进行可视化分析,探讨在竞争风险事件存在情况下的关键预后危险因素,并对该结果进行了验证和性能评价,结果显示其在预测患者生存率方面具有良好的准确性和一致性,有利于个体化治疗的选择。
本研究确定了与预后相关的诸多因素,包括年龄、分化程度、组织类型、T分期、手术、化疗、骨转移、脑转移、肝转移、分子亚型,其中乳腺癌分子亚型与OS有很强的相关性。本研究结果显示,在BCLM患者的OS及BCSS分析中, Luminal B型预后最好。在荷兰进行的一项多中心研究[13]中, Luminal B型在有远处转移的乳腺癌患者中表现出最长的生存期(Luminal B型与Luminal A型比较,HR=0.64, 95%CI: 0.45~0.92,P=0.02)。在另一项基于SEER数据库的分析[14]中, BCLM患者中Luminal B型预后最好(Luminal B型与 Luminal A型比较,HR=0.82, 95%CI: 0.70~0.94,P=0.006), 生存时间最长,中位生存时间为31.0个月。
HER2靶向治疗的研究有了很大的进展,曲妥珠单抗、帕妥珠单抗等单克隆抗体药物的应用已经日渐成熟,在CLEOPATRA试验中,在曲妥珠单抗和多西他赛的基础上加入帕妥珠单抗可进一步改善一线治疗方案,使得HER2阳性患者进一步获益[15]。Margetuximab的使用可较曲妥珠单抗药物明显延长HER2阳性晚期乳腺癌患者的无进展生存期(5.8个月对比4.9个月)[16]。Ertumaxomab可针对HER2位点及T细胞特异性CD3抗原的三功能抗体,与激活的FcγⅠ/Ⅲ受体选择性结合而达到治疗的目的[17]。内分泌治疗有着较好的安全性和疗效,是激素受体阳性(HR+)进展期乳腺癌患者重要的治疗方式[18], 其中具有代表性的是周期蛋白依赖性激酶(CDK)4/6抑制剂[19]。MONALEESA-2 Ⅲ期临床试验[20]结果显示,瑞博西尼联合来曲唑组较安慰剂联合来曲唑组的无进展生存期明显延长(25.3个月对比16.0个月)。转移性HR+乳腺癌进展或内分泌抵抗后可采用多线内分泌治疗模式[21-22]。HR阳性的乳腺癌可能比HR阴性的肿瘤表现出更多惰性的生物学特征[23]。内分泌治疗联合靶向治疗/免疫治疗、抗HER-2治疗以及聚腺苷酸二磷酸核糖基聚合酶抑制剂等或可成为乳腺癌治疗的发展方向。在临床试验中, PERTAIN[24]和ALTERNATIVE[25]试验也表明了HR和HER2联合靶向治疗是一种有效且安全的治疗方案。
肿瘤原发部位的手术是一个有争议的话题,存在证据相互矛盾的情况。SEER数据库、国家癌症数据库(NCDB)或单中心研究[26-27]已经证明,对原发部位进行手术治疗可使患者有更好的预后。土耳其MF07-01 Ⅲ期临床随机对照前瞻性研究[28]显示,局部手术患者3年无病生存与5年OS较未手术患者有显著差异。一项回顾性分析[29]显示,接受全身化疗的BCLM患者的中位OS为22.5个月,进行手术治疗的患者中位OS为35.0~75.6个月, 5年生存率为38%~54%。印度的一项随机对照试验[30]显示,手术不能改善OS。本研究结果显示,对肺转移的乳腺癌患者原发肿瘤部位进行手术治疗,其预后会有明显的改善。此外,本研究还得出了化疗对肺转移患者有积极作用,这与其他研究[31]结果一致。
本研究的局限性: ① 一项回顾性研究很难确定癌症特异性死亡率或其他死亡率,尤其是在数据库研究中,同时也很难判断其他死亡是否与肺转移有关。② SEER数据库中关于亚洲人,尤其是中国人口的记录是不成熟的,这可能使得本研究结果存在偏差。③ SEER数据库未记录并发症、详细治疗、治疗顺序、治疗时间、复发评分等显著影响预后的因素。上述局限性可能会在很大程度上影响本研究在实际病例中的适用性,因此对分析结果的解读应谨慎。
综上所述,本研究筛选出与BCLM患者预后相关的危险因素,提示原发肿瘤部位的手术或化疗会改善患者的生存状况。

