鼠疫治疗策略进展
易星驰,张利霞,张亚楠
鼠疫是由鼠疫耶尔森菌(简称鼠疫菌)引起的人兽共患疾病,该病被列为国际检疫传染病和我国法定的甲类管理传染病。临床分型包括肺鼠疫、败血症鼠疫和腺鼠疫。鼠疫菌属于肠杆菌科耶尔森菌属,由细菌学家亚历山大·耶尔森于1894年在中国香港鼠疫暴发时分离出来[1]。当前研究认为鼠疫菌是在约5 700至6 000年前,由食源性假结核耶尔森菌通过一系列基因重组进化而来,两者在基因组水平上高度相似,但生物学特性、致病机制和生态学表现截然不同[2]。鼠疫菌能够表达独特的毒力因子,侵袭跳蚤和啮齿类动物并能破坏哺乳类宿主动物的免疫功能,在缺乏适当治疗的情况下易导致宿主的迅速死亡[2]。鼠疫自然疫源地分布广泛,疫情一直未能间断,近年来更是多地出现抬头,当前社会和公众都十分关注[3-5]。研究有效的鼠疫预防措施和治疗方法十分关键。以链霉素为首的抗生素疗法是当前鼠疫治疗的传统方法,鼠疫疫苗的问世也对疫源地鼠疫蔓延进行了有效遏制,而多重耐药性鼠疫菌的报道又推动了人们对噬菌体疗法等其它治疗方法的研发兴趣。基于此,本文将目前鼠疫研究的热点治疗方案进行分析总结。
1 抗生素疗法
成功治疗鼠疫的关键是及早发现并使用抗生素,如果有效的抗生素和抗休克治疗延迟24 h以上,极易导致患者死亡[6]。美国疾病预防和控制中心(CDC)关于鼠疫抗菌治疗的最新建议[7]:氨基糖苷类和氟喹诺酮类药物为一线治疗药物,四环素类和氯霉素类也用作鼠疫菌的治疗,具体方案根据患者的年龄和妊娠情况作了建议和规定,本文做了归纳总结,详见表1、表2和表3。

表1 推荐对患有腺鼠疫的成人和儿童进行抗菌治疗Tab.1 Antimicrobial therapy is recommended for adults and children with pneumonic plague
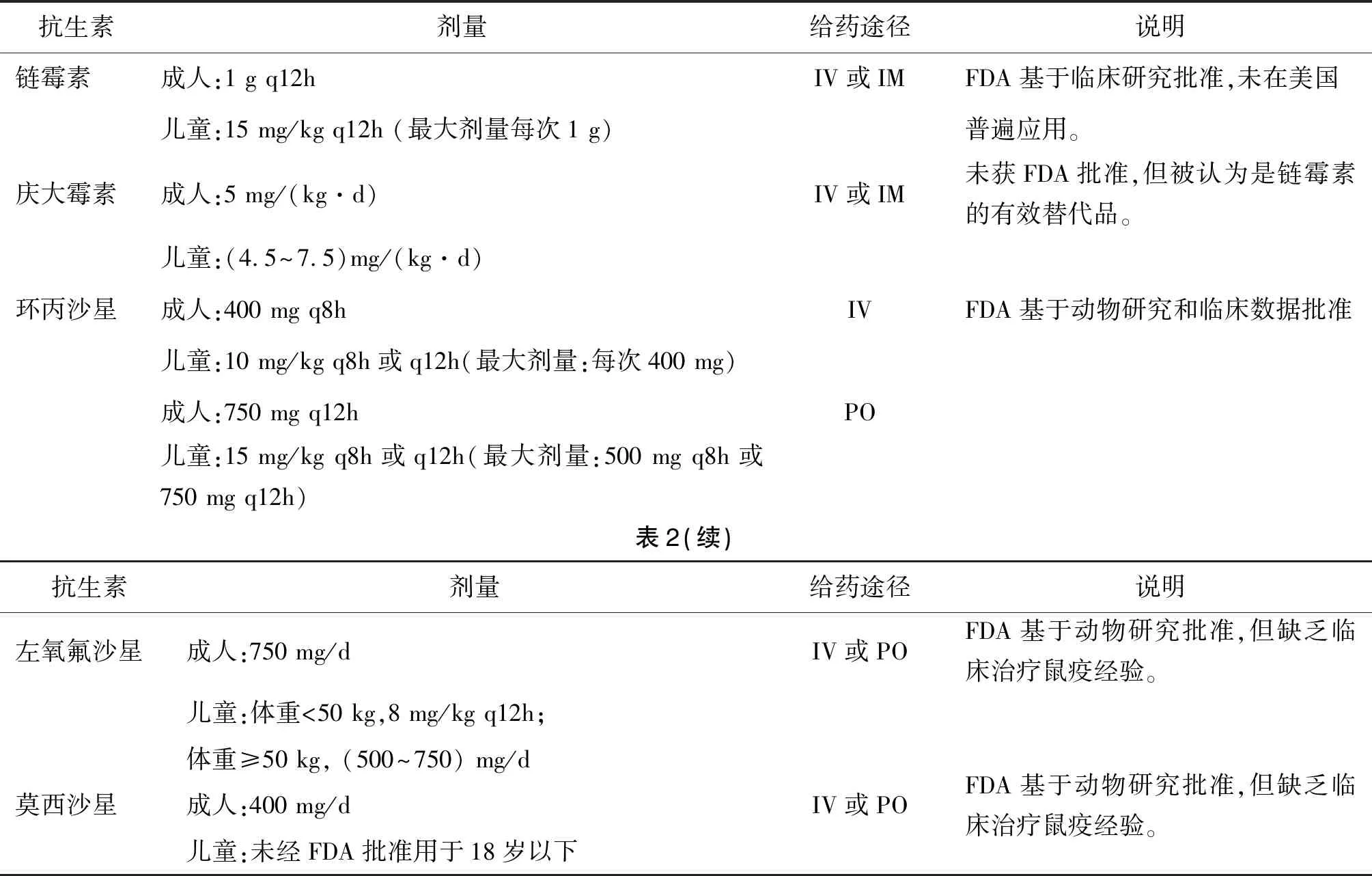
表2 推荐对患有肺鼠疫和败血症鼠疫的成人和儿童进行抗菌治疗Tab.2 Antimicrobial therapy is recommended for adults and children with pneumonic plague and septicemic plague

表3 推荐对患有肺鼠疫、腺鼠疫和败血症鼠疫的孕妇进行抗菌治疗Tab.3 Antimicrobial therapy is recommended for pregnant women with pneumonic plague,bubonic plague and septicemic plague
1.1 氨基糖苷类-链霉素 CDC的数据显示:大多数的鼠疫感染患者被抗生素成功治疗,其中氨基糖苷类-链霉素是治疗鼠疫的首选抗生素[8]。链霉素广泛应用于世界各个鼠疫疫源地区鼠疫患者的治疗,2011 版中国鼠疫诊疗方案中强调早期、足量、总量控制的鼠疫用药策略,以链霉素为首选,为达到更好的预后效果可以与喹诺酮类、多西环素、β-内酰胺类或磺胺等联合用药[9]。但长期使用链霉素治疗方案存在许多缺陷,一是会对患者造成较强的毒副作用,导致神经肌肉阻滞和听觉器官(耳毒性)甚至是肾脏功能(肾毒性)的破坏[10]。二是已有多次报道从自然界中分离到耐药性鼠疫菌株,如在马达加斯加分离出的第2株鼠疫菌株具有链霉素磷酸转移酶活性,对链霉素疗法产生高度抗性[11]。为了评估中国鼠疫疫源地链霉素耐药性,戴瑞霞团队[12]采用最低抑菌浓度(MIC)和PCR方法筛选链霉素抗性相关基因(strA和strB),在体外评价536株鼠疫菌的链霉素敏感性中,首次报道中国耐链霉素鼠疫菌分离株(S19960127)(MIC为4 096 mg/L)。该菌株属于青藏高原喜马拉雅旱獭鼠疫疫源地,于1996年从中国西藏自治区暴发的肺鼠疫中分离出来。与以往报道由质粒介导的链霉素耐药性不同,S19960127是由一种新的耐药机制即rpsL基因(核糖体蛋白S12)突变导致的耐药。S19960127的发现,推翻了中国地区未有鼠疫耐药菌株的认知,同时也是首次报道由rpsL突变介导的耐链霉素鼠疫菌株。由rpsL突变引起的链霉素耐药自1993年以来在结核分枝杆菌中多次报道,但没有足够的证据证明rpsL基因突变是产生耐链霉素鼠疫菌的诱因[13]。
1.2 氨基糖苷类-庆大霉素 链霉素较强的不良反应使其未在美国普遍应用,而同为氨基糖苷类的庆大霉素被认可是链霉素的有效替代品,并在美国成为鼠疫一线治疗药物。美国食品药物管理局(FDA)批准用于治疗和预防鼠疫的抗菌药物包括链霉素、环丙沙星、左氧氟沙星、莫西沙星和多西环素。庆大霉素虽未被 FDA 批准用于鼠疫,但临床经验和动物数据证明其治疗的有效性[14]。Mwengee等[15]在坦桑尼亚进行一项庆大霉素与多西环素疗效比较的随机临床试验中,35例采用庆大霉素治疗的腺鼠疫患者中有33例(94%)存活,与先前越南的非对照研究中链霉素94%救治率相当。Kugeler团队[16]回顾了1942-2018年间美国报道的533例鼠疫患者,88%(469例)的患者接受了抗菌药物治疗且其中330位患者接受多种药物联合治疗,氨基糖苷类(68%的患者使用)和四环素类药物(57%的患者使用)比其它类药物更多用于治疗,并且治疗的生存率也更高。链霉素用于治疗180名患者(38%),选用次数随时间推移而降低(自2000年以来只有5名患者使用),使用庆大霉素治疗的患者有149例(31%),选用次数随时间推移而增高。庆大霉素在败血症鼠疫患者中的使用比腺鼠疫和肺鼠疫更为常见。
1.3 氟喹诺酮类与四环素类 环丙沙星和多西环素均被疾控中心推荐为暴露后预防的首选抗生素类药物,环丙沙星是合成的第三代喹诺酮类抗菌素,作用在细菌细胞DNA螺旋酶A亚单位上,干扰细菌DNA的复制。而多西环素是四环素类广谱抑菌剂,与细菌核糖体亚基30S亚基特异性结合,能够抑制细菌肽链延长,从而使得细菌蛋白质合成受阻。在实验室下进行肺鼠疫暴露小鼠治疗时,环丙沙星对恢复期小鼠致死感染剂量具有完全保护能力,其杀菌活性能有效抑制体内细菌。但多西环素对同样暴露小鼠的治疗效果却较为不足,推测多西环素的抑菌能力在较大程度上依赖于吞噬细胞的活性,为此需要最佳的免疫反应来完全根除代谢低下的细菌[17]。在Kugeler等[16]的回顾报告中多西环素占四环素类药物使用记录的39%,并伴随时间推移而增加,且使用四环素类治疗腺鼠疫比治疗肺鼠疫或败血性鼠疫更为常见。2018年报道了1株对多西环素耐药的新型鼠疫菌菌株IP2180H,菌株耐药性由来自肠道沙门氏菌与pB71同源的共轭质粒(pIP2180H)携带,鼠疫菌对四环素的耐药问题令人担忧[18]。近年来,喹诺酮类药物已用于治疗超过30%的患者,有限的数据也表明其临床有效性[14]。一项使用左氧氟沙星和莫西沙星治疗豚鼠实验感染研究中,左氧氟沙星和莫西沙星治疗组豚鼠全部存活,解剖后脏器均未分离出鼠疫菌,而对照组动物于感染后3~5 d全部死亡[19]。在非洲绿猴的动物模型实验中,当发烧后10 h给药时,于10 d内环丙沙星和左氧氟沙星治疗高度有效(分别为90%和100%)。当环丙沙星延迟19.7 h、左氧氟沙星延迟26.5 h后治疗效果降至50%,可以用于预测喹诺酮类抗菌素治疗反应时间[20]。
1.4 抗生素疗效的影响因素及研究进展 氨基糖苷类、四环素类、氟喹诺酮类、氯霉素和磺胺类等抗菌疗效已在小鼠等啮齿动物模型及非人灵长类动物模型大量报道,但由此产生的鼠疫治疗效果却因动物模型而不同。这些差异可能是由于鼠疫菌菌株、鼠疫菌生长条件、动物种类、动物饲养条件、鼠疫菌接种时间和剂量、抗生素给药时间和给药途径以及鼠疫临床分型不同而产生[21]。Godfred-Cato等[22]回顾了1939-2019年报道的2 631例鼠疫病例,93.6%为腺鼠疫,5.9%为肺鼠疫,0.5%为败血症,相关病死率分别为14.2%、31.1%和20.0%。接受四环素类、氯霉素类、氨基糖苷类或磺胺类药物单药治疗的患者的病死率分别为1.3%、1.4%、7.5%和20.2%。在Kugeler等[16]回顾的533例美国人间鼠疫中,408例(77%)为腺鼠疫,93例(17%)为败血症鼠疫,18例(3%)为肺鼠疫;14例为未知或其他罕见的临床类型。89%的男性患者和93%的女性患者同样接受高效抗菌药物,男性治疗失败风险更高,不过当前并未发现鼠疫感染率及死亡率与年龄分布相关。
Gur等[23]研究发现,感染肺鼠疫小鼠通过吸入庆大霉素治疗可限制鼠疫菌菌株的生长和传播,而皮下注射给药途径的治疗组小鼠救治率极低。吸入疗法有助于缩短治疗时间并减少鼠疫菌引发的肺损伤,能够快速减轻肺部细菌负荷,降低继发感染的风险[23]。由于在动物模型中药物在小动物内的半衰期往往比人类短,且当前抗生素对非人灵长类动物的研究较少,因此,动物模型数据难以准确描述不同抗生素对鼠疫的疗效[21]。同时,除了需要考虑抗生素的药效学和药物代谢动力学外,根据患者感染鼠疫的类型不同,还需考虑患者肥胖率、糖尿病等代谢疾病及免疫差异等的个体差异来选择最佳治疗方案。当前,一项在马达加斯加进行的环丙沙星、链霉素治疗腺鼠疫的疗效和安全性评估正在开展中,将通过随机对照试验的研究方案为鼠疫治疗管理提供更精准的信息[24]。
1.5 新型抗生素-LpxC抑制剂 具有毒副作用小和与传统抗菌药物无交叉耐药特点的新型抑菌剂一直以来被不断的探寻,抑制铁载体生物合成的小分子抑菌剂[25]、β-酮酰基-酰基载体蛋白合成酶FabF和FabH[26]以及UDP-3-O-(R-羟基十四酰)-N-乙酰氨基葡糖脱乙酰基酶(LpxC)[27]在鼠疫菌治疗方面被报道,其中LpxC的研究较为系统和深入。脂多糖(LPS)是革兰阴性菌细胞壁重要组成成分,在维持细菌正常生理活动和抵抗外界因子侵袭方面起重要作用。UDP-3-O-(R-羟基十四酰)-N-乙酰氨基葡糖脱乙酰基酶(LpxC)是与锌离子相螯合的金属酶,是参与催化合成LPS主要成分脂质A的关键酶[28]。LpxC作为近年来筛选出的理想抗菌靶点,其抑制剂正逐渐研发成针对革兰氏阴性菌的新型抗生素。当前开发出的多种LpxC抑制剂在体外实验中对多种革兰氏阴性菌分离株作用显著,包括院感高危的多重耐药菌和泛耐药菌株[27-28]。小鼠实验证实LpxC抑制剂LPC-058分子和LPC-069分子都对鼠疫菌具有极强抑制效果,LPC-058的最小抑菌浓度(MIC)与喹诺酮类抗菌药物环丙沙星相近(0.03 μg/mL);LPC-069对鼠疫菌的MIC与用于临床的庆大霉素和多西环素的指南推荐值处于同一范围内,此浓度被证明可以有效治疗腺鼠疫[27]。LpxC抑制剂具有鼠疫治疗的潜在能力,通过基团修饰等手段研发出更为有效的分子,同时拓展对不同临床型鼠疫的治疗能力正在进一步探究中。
2 疫 苗
疫苗接种是预防多种传染病的重要手段,全球范围内人类利用疫苗接种消灭了天花,有效控制了脊髓灰质炎、白喉、麻疹等传染病,疫苗接种也是目前阻断新冠病毒人群传播的重要举措。对于鼠疫感染的长期防护以及耐药性鼠疫菌株的治疗,疫苗防治的高效性和经济性被社会普遍认可。鼠疫疫苗类型主要为耶尔森氏菌减毒活疫苗、亚单位疫苗、重组载体疫苗和 DNA 疫苗等,当前国内出于安全等问题只有少数疫苗上市[29]。
2.1 减毒活疫苗 目前国内上市的鼠疫疫苗大多为EV76减毒活疫苗[29],EV76是由Girard和Robic于1926年在马达加斯加从人类腺鼠疫病例中分离出的EV菌落中研发出的pgm突变株[30]。70多年来,EV76及其衍生物EV76 NIIEG一直用作鼠疫活疫苗在东欧和前苏联及一些亚洲国家鼠疫流行地进行预防,疫苗保护鼠疫研究人员等易感人群超过1 000万人次[31]。单剂量的EV76 NIIEG疫苗可提供疫苗接种者持续 10至12个月的高效免疫力,在疫苗接种后第7 d便对腺鼠疫感染具有显著的疗效,并在一定程度上改善肺鼠疫症状[32]。这种防护是因为EV76能通过宿主血红素和铁蛋白、血凝素和转铁蛋白诱导对铁的营养免疫,即限制致命微生物对宿主铁的利用,阻止了生物体内游离铁的可用性,从而建立了营养免疫力[33]。但随着EV76疫苗的接种增多,其严重的副作用也暴露出来,出现身体的不适包括持续长达2 d的头痛,并伴有发热反应。约8%的疫苗接种者出现淋巴肿大,其中2%有严重反应,在局部注射后也出现了丘疹等局部皮肤反应,需要长达1周时间缓解[34]。因此,减毒活疫苗EV76强烈的反应原性以及在基因分布上的不一致也使其未获得FDA的批准许可[35]。Meyer[36]总结了在美国、越南和马达加斯加的EV76菌株及其衍生物实验数据,当施用于不同种类的动物包括非人灵长类动物时,该菌株仅能提供一定的免疫力并且免疫强度还与疫苗接种途径有关。在一项对哈萨克斯坦人群接种鼠疫减毒活疫苗EV76NIIEG研究中,接种4个月后达到最高滴度的抗体保护水平,接种第12个月后仍具有较好的保护能力[37]。因此,建议在鼠疫流行暴发期前4个月进行鼠疫疫苗接种,可实现最大限度的保护作用。
2.2 亚单位疫苗 亚单位疫苗主要是由F1 抗原和 V(LcrV) 抗原构成的双组分疫苗或 F1-V 融合抗原疫苗。F1抗原作为一种哺乳动物体温下表达的毒力因子,能够通过抑制细菌粘附到上皮细胞来抑制细菌摄取[38]。V抗原是毒力因子和多功能蛋白,通过与其它蛋白质结合在分泌水平上起作用,通过影响细胞因子的产生进而调节宿主免疫反应[39]。当前 F1和V抗原联合免疫有效性已在小鼠、雪貂、食蟹猴等多种动物模型中得以证明,尤其是在对抗腺鼠疫和肺鼠疫感染时尤为有效,但在临床上对人体的预防效果还需要进一步研究来评估[40]。刘磊等[41]在对包含天然F1抗原和重组V抗原的新型亚单位鼠疫疫苗研究中,在不同时间和剂量下接种犬粘菌猕猴,在对疫苗进行系统性免疫毒性研究后,F1+rV亚基鼠疫疫苗能诱导强烈的体液免疫和低水平的细胞免疫,并具有良好的安全性。在一项对中国健康成人进行亚单位疫苗接种研究中,新型鼠疫疫苗(F1+rV)能够诱导长达12月的免疫能力,在18~55岁的成年人中显示出良好的安全性[42]。亚单位疫苗以其高效和安全的优点成为了当前疫苗研究的重点,具有较好的治疗前景。
2.3 重组载体疫苗 鼠疫重组载体疫苗是目前鼠疫疫苗研究中新的热点,当前已有多项研发出的新型载体被报道,包括鼠伤寒沙门氏菌[43]、人5型腺病毒[44]、烟草花叶病毒[45]和噬菌体载体[46]等。Jia等[47]研究将土拉氏菌LVS ΔcapB突变株和减毒的单核细胞增多性李斯特菌(Lm)菌株作为载体,使用LVS ΔcapB载体疫苗进行同源启动,诱导有效的抗原特异性体液免疫和T细胞介导的免疫反应。外膜囊泡(OMV)实验疫苗已在实验室针对多种病原体进行测试,OMV可以用作抗原载体去递送抗原和佐剂,已开发出OMV脑膜炎奈瑟球菌B型疫苗超过3 000万人接种,当前等待进一步开发为新型鼠疫疫苗[48]。新型重组亚单位疫苗也多有报道,F1和LcrV与结核分枝杆菌的HSP70(II)组成的三价融合蛋白 F1-LcrV-HSP70(II)在小鼠模型中能够增强体液和细胞免疫反应[49]。Tao等[50]报道了一种含有突变F1、V和炭疽杆菌保护性抗原(PA)构成的3重抗原重组疫苗,并在3种不同的动物模型中显示了对炭疽和鼠疫的完全保护作用。同样由炭疽杆菌PA和F1、V构成的多抗原融合蛋白MaF2,在小鼠模型中表现出强大免疫能力,也具有作为治疗炭疽和鼠疫的多种抗原候选疫苗前景[51]。
2.4 DNA疫苗 DNA疫苗又称核酸疫苗,携带着特定编码基因的细菌质粒,该基因能在宿主中表达所需的抗原并诱导免疫反应的产生。基因工程DNA已被测试用于艾滋病、乙型肝炎、寄生虫病和癌症等各种疾病的新型疫苗接种策略。DNA疫苗以其易于构建、稳定性较强、大规模生产成本低、能够诱导体液和细胞介导的免疫反应等众多优点具有开发疫苗治疗的潜力,但对于鼠疫DNA疫苗的研发当前仍止步于实验室研究阶段[40]。
2.5 疫苗佐剂 佐剂用于增强机体对抗原的免疫应答或改变免疫反应的类型,白细胞介素-12可作为高效的疫苗佐剂,在一项研究中添加IL-12佐剂的灭活鼠疫菌CO92疫苗提供了完全的保护能力[52]。新型BECC衍生的TLR4L佐剂BECC438在小鼠模型中同样具备较高的活性,保护感染实验小鼠抵抗鼠疫的侵袭[53]。鞭毛蛋白被用作应对鼠疫菌的有效佐剂,鞭毛蛋白/F1/V疫苗在健康成年志愿者中进行I期安全性和免疫原性剂量递增试验,试验显示该疫苗免疫原性具有剂量相关性,抗体反应强度随着剂量的增加而增大[54]。
2.6 国内疫苗接种方式 国内根据《中华人民共和国药典(2020年版)》,皮上划痕用鼠疫活疫苗进行鼠疫疫源地人群疫苗防护接种。采用皮上划痕接种方法,在上臂外侧三角肌上部皮上用消毒针划成“井”字,在划痕部位上滴加疫苗。疫苗使用剂量为每人每年滴加0.05 mL,对于14周岁以下儿童,疫苗滴于两处划2个“井”字,14周岁以上者疫苗滴于三处划3个“井”字。“井”字划痕长度1~1.5 cm,间隔2~3 cm。对于免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者以及妊娠期或6个月内的哺乳期妇女等严禁使用[55]。
3 噬菌体
3.1 噬菌体疗法的研究 噬菌体是自然环境广泛存在的病毒,可以感染特定的细菌宿主,专门侵入宿主细菌并在宿主细菌内部复制,形成新的祖细胞病毒粒子,并从内部裂解细菌,同时使自身在下一个感染周期中传播。许多研究者从鼠疫感染患者尸体、动物尸体、感染患者血液和粪便、污水等分离出鼠疫噬菌体,并发现鼠疫噬菌体更易在鼠疫流行末期或是静息时段出现[56]。20世纪初在Frederick Twort和Felix D'Herelle发现噬菌体后,由于其强大的抗菌活性,便立即用于治疗人类与畜牧动物的细菌感染[57]。在1925年,D'Herelle使用从大鼠粪便中分离出的高毒力鼠疫噬菌体治疗了4例腺鼠疫患者,这也是历史上第一次噬菌体疗法的应用[58]。该治疗方案直接将噬菌体悬浮液注射到患者腹腔中,4例腺鼠疫患者都在几天内康复[59]。但在接下来鼠疫噬菌体的疗效研究中,进行的多次动物模型实验和临床实验未获得预期的治疗效果,出现了相互矛盾的实验数据[60]。为此,噬菌体疗法相关研究在之后长时间停滞不前。
如今,全球范围内耐多药致病菌的增加燃起了人们对噬菌体治疗的兴趣,多重耐药性鼠疫菌的相继发现更是推动了鼠疫噬菌体治疗和诊断的研究。Moses等[61]在BHI(脑心浸液培养基)和人血清中进行噬菌体φA1122和PST裂解鼠疫菌体外实验,φA1122在BHI中具有极佳裂解鼠疫菌的能力,但在人体血清中完全丧失裂解活性。血液中存在的补体成分会削弱噬菌体与细菌的结合能力,B细胞介导的抗体免疫反应是导致噬菌体失活的主要因素,推测出噬菌体失活可能是由补体介导的IgM引发[62]。Filippov等[63]在感染小鼠模型的实验中,发现φA1122可以在小鼠肝脏和脾脏等体内传播,并对血液中、肝脏中和脾脏中的鼠疫菌显著杀灭,同时研究还发现腹腔注射φA1122悬浮液相比于肌肉注射在血液和器官内具有更佳的活性。Filippov等[59]另一项实验中采用单次腹腔注射φA1122悬浮液治疗小鼠腺鼠疫感染,观测到小鼠平均死亡时间和存活率的明显延长和升高,治疗效率与14~25倍高剂量抗生素给药的结果相当,并表现出了较高的安全性和稳定性。
3.2 噬菌体-抗菌药物联合疗法 通过机制互补发挥协同作用的联合疗法,是探究鼠疫治疗新策略的强大理论支持。Vagima等[64]为评估噬菌体疗法对肺鼠疫的潜在疗效,建立小鼠感染模型进行抗生素-头孢曲松与噬菌体фA1122和PST治疗实验。当使用噬菌体фA1122和PST作为单一治疗时,噬菌体治疗效果与Moses等[61]的研究结果相同,都受到血清成分抑制。当使用头孢曲松作为单一治疗时,80%的实验小鼠死于感染。而在进行头孢曲松与噬菌体联合治疗时,实验组感染小鼠全部存活,并从小鼠内部彻底清除鼠疫菌,联合治疗效果显著。噬菌体联合抗生素疗法在应对多重耐药病原菌和提高药物疗效方面具有明显效果,在多篇相关综述论文中也被探讨报道[65-66]。当前对于噬菌体疗法存在诸多不稳定因素,如影响噬菌体稳定性的理化因素、不同的给药途径和给药剂量的细化,因此噬菌体虽具有极强的病原菌裂解特异性和活性,但却未广泛应用于人类和动物的治疗中[67]。噬菌体对鼠疫的治疗仍以实验室研究为主,并且病原体被噬菌体裂解需要24~36 h才能完成[68]。由于感染鼠疫后病情进展迅速,因此缩短发挥疗效所需的时间也是面临的挑战。
4 展 望
随着全基因组测序、多靶点新型核酸检测等技术的应用,鼠疫菌的耐药机制将逐渐更为明晰,更多的新型抗菌药物将被研发。疫苗及噬菌体疗法也可以有效的缓解治疗焦虑,目前该疗法已在少数地区及病例上使用,并对多重耐药菌也具备治疗的潜力。除此之外,针对鼠疫感染的其它疗法也不断被报道,如免疫疗法、细菌素疗法、宿主导向疗法、阳离子抗菌肽等,但当前仅在实验室进行体外和动物模型的治疗研究,仍缺乏标准化的临床实验及病例报告,需要进一步研究。
利益冲突:无
引用本文格式:易星驰,张利霞,张亚楠.鼠疫治疗策略进展[J].中国人兽共患病学报,2022,38(9):830-838.DOI:10.3969/j.issn.1002-2694.2022.00.116

