脾门区血管淋巴结清扫在进展期近端胃癌根治术患者中的应用
马任远,常娜,王兴国,牟亚刚
1.榆林市第二医院普外科,陕西 榆林 719000;2.西电集团医院普外科,陕西 西安 710077
胃癌是一种临床常见消化道肿瘤疾病之一,与人们的生活环境、基因遗传和肠道炎症息息相关,严重威胁人们的生命健康[1]。胃癌易发生在胃壁表皮内部上皮黏膜细胞中,多发生在50岁以上老人中,长期吸烟喝酒、不健康的饮食习惯、心情不佳都会增加患胃癌的风险[2-3]。胃癌患者的致死率极高,且治愈率极低。胃癌早期没有明显的症状,而发展为近端胃癌的临床症状是腹部疼痛[4]。临床上采用手术治疗,化疗方式为辅进行治疗胃癌,而手术治疗是胃癌的最佳治疗手段。脾门淋巴结是胃肿瘤患者的重要淋巴回流方式,淋巴结清扫对近端胃癌根治患者具有重要意义[5-6]。以往临床采用切除脾脏以进行淋巴结清扫,但并未取得良好的治疗效果,且增加患者并发症和致死率。由于脾脏手术位置较深,血管曲折极易受损,脾脏血管脆弱,极易发生出血症状且难以止住,血管较难被发现,在近端胃癌根治术患者中采用脾门区血管淋巴结清扫术比较困难[7-9]。目前,对于脾门区血管淋巴清扫的研究资料较少。本文探讨了脾门区血管淋巴结清扫在进展期近端胃癌根治术患者中的应用效果,现报道如下:
1 资料与方法
1.1 一般资料回顾性收集2018年9月至2021年9月于榆林市第二医院普外科和西电集团医院普外科就诊的120例进展期近端胃癌根治术患者,按照淋巴结清扫范围分组,其中50例给予原位腹腔淋巴结清扫者纳入对照组,70例给予脾门区血管淋巴结清扫者纳入观察组。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经上述两家医院医学伦理委员会批准。
表1 两组患者的一般资料比较[±s,例(%)]
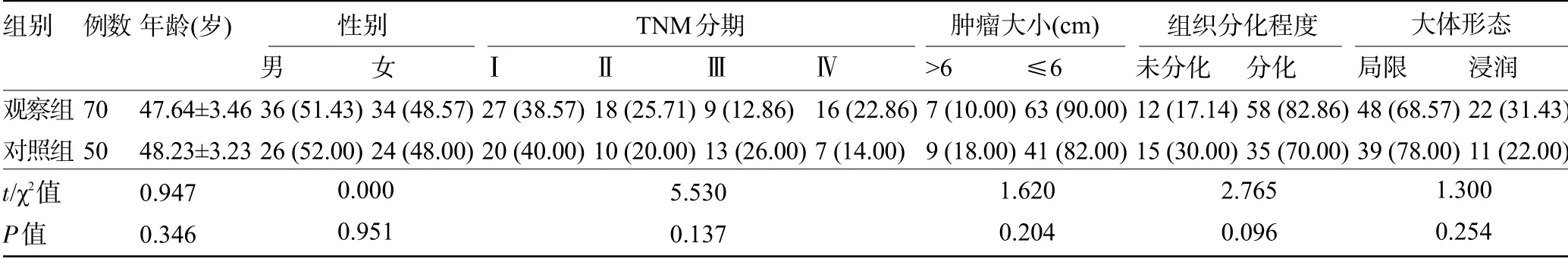
表1 两组患者的一般资料比较[±s,例(%)]
组别观察组对照组t/χ2值P值例数年龄(岁)70 50 47.64±3.46 48.23±3.23 0.947 0.346男36(51.43)26(52.00)女34(48.57)24(48.00)0.000 0.951Ⅰ27(38.57)20(40.00)Ⅱ18(25.71)10(20.00)Ⅲ9(12.86)13(26.00)Ⅳ16(22.86)7(14.00)>6 7(10.00)9(18.00)≤6 63(90.00)41(82.00)未分化12(17.14)15(30.00)分化58(82.86)35(70.00)局限48(68.57)39(78.00)浸润22(31.43)11(22.00)5.530 0.137 1.620 0.204 2.765 0.096 1.300 0.254性别 TNM分期 肿瘤大小(cm) 组织分化程度 大体形态
1.2 纳除标准纳入标准:(1)符合《胃癌诊断标准》[10]对近端胃癌患者的诊断标准;(2)临床资料完整;(3)无其他类型恶性肿瘤者;(4)术前检测腹部以及邻近器官未发生肿瘤转移者;(5)患者均符合胃癌根治术指征。排除标准:(1)术前肿瘤、淋巴结转移者;(2)检查发现患者存在其他恶性肿瘤者;(3)有其他严重遗传性疾病者。
1.3 治疗方法两组患者均采用气管内插静脉复合麻醉,按照《胃癌诊疗规范》[11]采用近侧D2胃癌根治术。对照组患者均采用传统腹腔内脾门血管淋巴结清扫技术,采用常规探查方法探查腹腔内腹膜和脾脏等情况,手术人员向患者的胰腺下缘和肠系膜血管交点处伸展筋膜,放入胰腺后部间隙,向左侧拓展,使用肠钳将胰腺上抬,辅助适当的张力,保持Gerota筋膜处在前方,减少对周围血管和神经的损伤。安全和高效完成内部动脉,到脾门区血管都处于游离状态,完全分离胰体尾、脾脏和小网膜囊,将游离的脾脏、胰体尾部和网膜脱出患者的身体外部,便于观察。此时,脾脏、血管和胰腺的相对位置保持原位,对脾门区、脾血管和后方淋巴结进行清扫。观察组患者均采用脾门区血管淋巴结清扫术。具体操作方法:游离大网膜后切断大网膜内部血管,左手使用抓钳找到脾叶血管,右手找到脾门后方的脂肪组织,清扫左侧前方的脾门脂肪组织。左侧腹部主动脉裸露在肠系膜下,将静脉下缘的后腹膜切开,使用Gerota筋膜对胰腺进行脱离,打开胰腺上缘、脾动脉和脾脏血管的分支后方间隙。将侧腹膜进行切开脾脏韧带,将脾脏、胰腺体整体进行翻转,将其拖出暴露于外面,采用超声刀对脾门区淋巴组织进行清扫,先清扫脾门区的前方淋巴结,将脾血管和胰腺进行分离后,沿着脾血管以及分支向脾门方向前方进行清扫脾脏前方淋巴结直达脾门,再次清扫脾门血管后方的淋巴结,将后方的淋巴结完全清扫干净。
1.4 观察指标(1)淋巴结清扫情况:术后比较两组患者的淋巴结阳性发生率和清扫情况。(2)手术相关指标:比较两组患者的手术相关指标,包括手术时间、术中出血量、排气时间和住院恢复时间。(3)并发症:脾门区淋巴清扫后6个月内,统计并比较两组患者出现肺部感染、吻合口瘘和反流性食管炎等症状。(4)体内炎性因子:采集两组患者治疗前后的静脉血液4 mL放入抗凝管中,离心分离血清,低温保存。采用酶联吸附试法检测白介素-6(Interleukin-6,IL-6)和超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)水平。
1.5 统计学方法应用SPSS22.0统计学软件分析数据。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内比较行配对样本t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的淋巴结清扫情况比较观察组患者的平均淋巴清扫数和平均幽门下区淋巴结数目分别与对照组比较差异均无统计学意义(P>0.05),但观察组患者的淋巴结阳性发生率明显低于对照组,差异具有统计学意义(P<0.05),见表2。
表2 两组患者的淋巴结清扫情况比较[±s,例(%)]
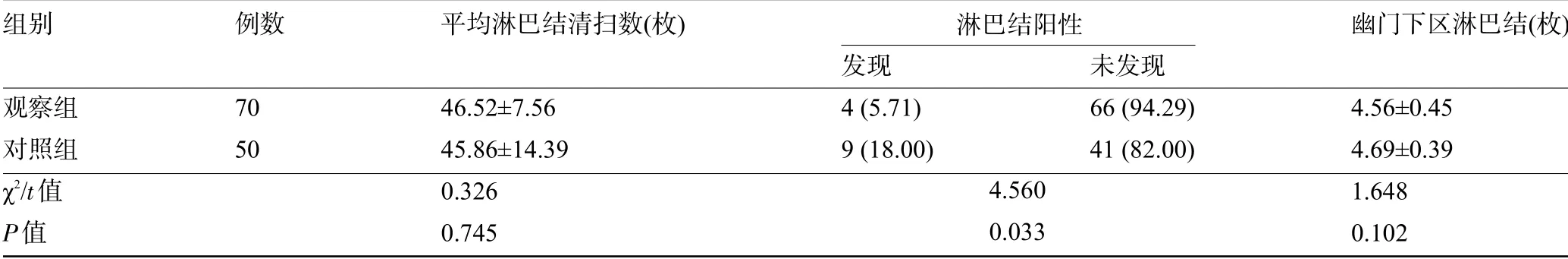
表2 两组患者的淋巴结清扫情况比较[±s,例(%)]
组别观察组对照组χ2/t值P值例数70 50平均淋巴结清扫数(枚)46.52±7.56 45.86±14.39 0.326 0.745发现4(5.71)9(18.00)未发现66(94.29)41(82.00)幽门下区淋巴结(枚)4.56±0.45 4.69±0.39 1.648 0.102 4.560 0.033淋巴结阳性
2.2 两组患者的手术相关指标比较观察组患者的手术时间、术中出血量、排气时间、住院恢复时间明显短(少)于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者的手术相关指标比较(±s)
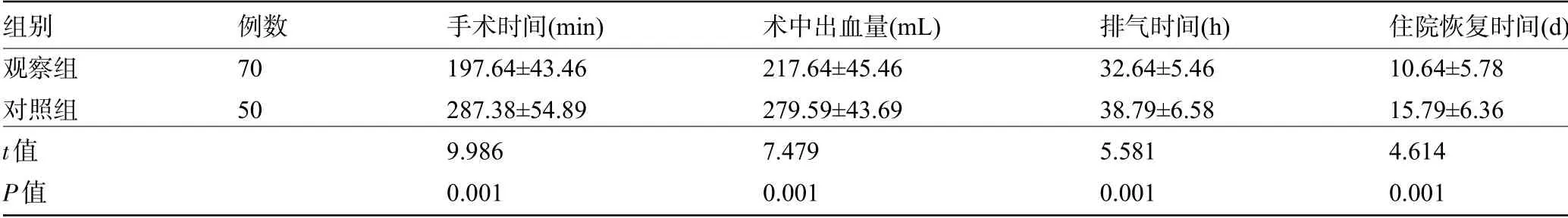
表3 两组患者的手术相关指标比较(±s)
组别观察组对照组t值P值例数70 50手术时间(min)197.64±43.46 287.38±54.89 9.986 0.001术中出血量(mL)217.64±45.46 279.59±43.69 7.479 0.001排气时间(h)32.64±5.46 38.79±6.58 5.581 0.001住院恢复时间(d)10.64±5.78 15.79±6.36 4.614 0.001
2.3 两组患者的术后并发症比较观察组患者的术后并发症总发生率为8.57%,明显低于对照组的32.00%,差异具有统计学意义(χ2=10.69,P=0.001<0.05),见表4。

表4 两组患者的术后并发症比较(例)
2.4 两组患者的炎性因子水平比较清扫前,两组患者的IL-6和hs-CRP水平比较差异均无统计学意义(P>0.05);清扫后,两组患者的IL-6和hs-CRP水平均降低,且观察组患者的IL-6和hs-CRP水平明显低于对照组,差异均具有统计学意义(P<0.05),见表5。
表5 两组患者的炎性因子水平比较(±s)
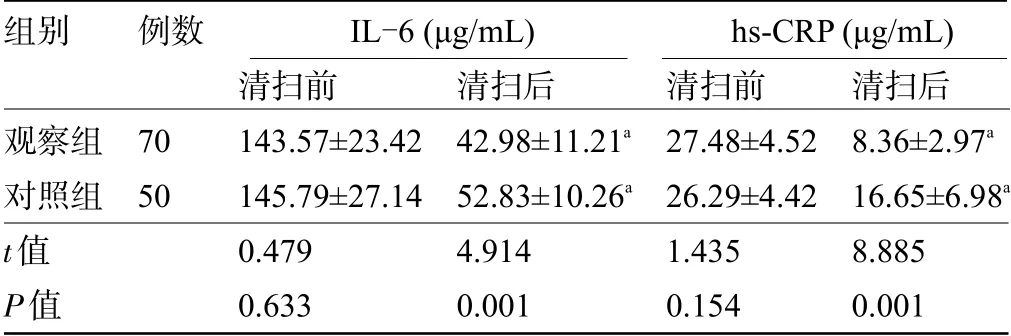
表5 两组患者的炎性因子水平比较(±s)
注:与同组清扫前比较,aP<0.05。
组别观察组对照组t值P值例数70 50清扫前143.57±23.42 145.79±27.14 0.479 0.633清扫后42.98±11.21a 52.83±10.26a 4.914 0.001清扫前27.48±4.52 26.29±4.42 1.435 0.154清扫后8.36±2.97a 16.65±6.98a 8.885 0.001 IL-6(μg/mL) hs-CRP(μg/mL)
3 讨论
胃癌是一种常见的消化系统恶性肿瘤疾病,具有较高的致死率。近年来,我国胃癌发病人群比例不断上升,严重威胁我国居民的生命健康[12-13]。目前,临床上70%的胃癌患者早期没有明显症状,当患者出现腹部疼痛等症状时已发展为胃癌进展期[14]。目前,临床上治疗进展期胃癌主要采用胃癌根治术,其通过将患者的肿瘤、淋巴结和受损伤器官全部切除来延缓病情进展,减少肿瘤的复发。但由于胃部结构以及周围关系较为复杂,且移动范围大,没有固定位置,手术对患者淋巴结清扫标准高,且视野范围较广,手术操作难度较大[15-16]。因此,对胃癌患者进行胃癌根治术时,应对脾动脉和周围淋巴结彻底清扫,竭力避免淋巴结清扫残留,降低手术对脾门区清扫范围的影响。
脾门区血管淋巴结连接重要器官和组织,前方有脾血管以及分支,后方连接肾脏筋膜和胰腺尾端,外部靠近脾门;脾门区血管与周围器官位置关系极为繁琐,且操作空间较小,一旦手术操作出现失误,会导致患者内部器官出血。因此,脾门血管清扫是一项极为复杂的手术。而淋巴结和肝总动脉位于胃背侧系膜,将会加大胃部脾门区淋巴结清扫的难度[17]。近年来,研究资料发现,过度进行淋巴结清扫,并不能提高患者的术后生存周期,且会影响患者的术后恢复。胃癌的转移方式为淋巴转移,胃淋巴结的清除是胃癌根除的基础条件。原位腹腔清扫对腹腔内部清扫范围不够彻底,视野范围不够清晰,极易损伤脾脏和脾脏血管,影响原位腹腔的清扫范围。脾门血管区淋巴结清扫分为切脾清扫和保脾清扫两种方式,脾门淋巴结是位于近端胃癌的第2站淋巴结,近端胃癌采用D2根治手术治疗,对脾门区淋巴结可进行彻底清扫[18]。SA-SADA等[19]研究349例近端胃癌患者的临床资料,发现脾门淋巴结转移率为15.4%,处在T1和T2期中,患者没有发生淋巴结转移情况,发生淋巴结转移患者的生存率为15%。本研究中,观察组患者的平均淋巴清扫总数与对照组比较没有显著差异,观察组患者平均幽门下区淋巴结数目与对照组比较没有显著差异,观察组患者淋巴结阳性发生率明显小于对照组。林建贤等[20]回顾性分析404例近端胃癌患者的临床资料,发现两组患者的平均淋巴结扫除没有显著差异,阳性淋巴结发生率类似,与上述研究结果类似。该研究结果表明脾门区血管淋巴清扫对患者的影响程度较小。
胃癌患者会出现营养不良、体质量急速下降等症状,对手术的承受能力有限。近端胃癌手术会影响患者对营养物质的吸收效率,术后可能会产生多种并发症[21-22]。本研究发现,观察组患者的手术时间、术后出血量、排气时间和住院恢复时间明显低于对照组,观察组的术后并发症总发生率明显低于对照组,说明采用胃癌根治术以及脾门区血管淋巴清扫能够减少患者的术后并发症,原因可能是将脾门区血管和淋巴结进行分离,避免对其造成巨大的损伤,术后将胃部脾脏拖出外部,保留清晰的手术视野,清晰辨认手术位置结构,有效提高手术效率,从而减少患者术后并发症,增大了脾门区淋巴结的清扫范围,且该手术保留患者胃壁,有利于患者吸收外来营养物质。本研究进一步分析了清扫前后炎症因子的水平,结果显示,清扫后两组IL-6和hs-CRP水平均降低,且观察组IL-6和hs-CRP水平明显低于对照组,提示脾门区血管淋巴清扫能够明显降低患者的炎症因子水平。可能因为脾门区血管淋巴清扫后,患者并发症较少,能够减轻患者的术后应激反应,从而降减少炎性介质的释放,减轻炎症反应。
综上所述,脾门区血管淋巴结清扫将会彻底扫除患者的淋巴结,适当降低手术时间、减少术中出血量和术后并发症,安全性高,更有助于患者术后恢复,值得在临床上推广。本研究的局限在于所涉样本量较小,且为单中心、回顾性研究,故为得到更加确切的结论,后期仍需开展大样本、多中心前瞻性研究。

