黄芪汤含药血清对血管内皮生长因子诱导的大鼠肝窦内皮细胞增殖、迁移和成管能力的影响及其作用机制
王浩艺, 麦静愔, 平 键,3, 成 扬,3,4
1 上海中医药大学附属曙光医院 肝病研究所, 上海 201203; 2 上海市光华中西医结合医院 治未病科, 上海 200052;3 上海中医药大学肝肾疾病病证教育部重点实验室, 上海 201203; 4 上海市中医临床重点实验室, 上海 201203
肝纤维化是肝脏对多种病理刺激的自我修复反应。在该过程中,血管内皮生长因子(VEGF)表达上调,多种细胞因子激活肝星状细胞,使细胞外基质生成降解失衡、过度沉积。目前多数学者认为肝窦内皮细胞(LSEC)先于肝星状细胞激活,其持续去窗孔化、表型改变、形成内皮下基底膜,即肝窦毛细血管化,是肝纤维化、肝硬化的早期特征性病变[1-2],由此伴随的内皮功能障碍和血管新生,会进一步加重肝纤维化的进展,并参与门静脉高压形成[3-4]。因此,如何抑制LSEC的增殖和血管新生对于肝纤维化、肝硬化的治疗具有重要意义[5]。
在肝硬化“虚损生积”理论的指导下[6],本课题组前期临床研究[7]发现,黄芪汤可以改善乙型肝炎肝硬化伴轻、中度食管静脉曲张患者门静脉直径和食管静脉曲张Palmer评分。动物实验[8]成功复制胆管结扎大鼠肝硬化门静脉高压模型,发现黄芪汤可以显著降低门静脉压力,减少肝窦毛细血管化标志物的表达。基于此,本研究体外分离、培养大鼠LESC,进一步观察黄芪汤对LESC增殖、迁移和成管能力的影响并初步探讨其相关机制。
1 材料与方法
1.1 动物 20只雄性SD大鼠,8周龄,体质量180~220 g,购于上海斯莱克实验动物有限公司,实验动物生产许可证号:SCXK(沪)2017-0005;实验动物使用许可证号:XYXK(沪)2020-0009。所有大鼠均饲养于上海中医药大学动物实验中心清洁级饲养室,饲养环境:22 ℃,12 h昼夜循环,自由进食饮水。适应性喂养3 d后进行实验。
1.2 细胞 分离的雄性SD大鼠原代LSEC。
1.3 药品 黄芪汤由黄芪30 g和炙甘草5 g组成,委托江苏江阴天江药业有限公司制作颗粒剂(批号:1212353),1.2 g黄芪汤颗粒相当于黄芪生药量6 g、炙甘草生药量1 g。制备工艺如下:取饮片,加水煎煮二次,合并煎液,过滤。浓缩至一定相对密度的清膏,喷雾干燥,过筛。按照处方取以上提取物,混合30 min使之均匀。将以上混合物干法制粒,制成12~40目颗粒。采用空白铝箔袋喷印包装喷码,按照规格将颗粒包装成铝箔小袋。使用前配置成0.14 g/mL溶液(成人用量为6 g/d,体质量按60 kg计算,大鼠灌胃剂量等效约为人体14倍,因此换算为大鼠每天灌胃剂量1.4 g/kg)。
1.4 试剂与仪器 DMEM培养液、胎牛血清(FBS)、青链霉素混合液、RIPA裂解液购于北京索莱宝科技公司,货号分别为:11995、S9030、P1400、R0010;BCA蛋白检测试剂盒、噻唑蓝(MTT)试剂盒、ECL化学发光试剂盒购于上海碧云天生物技术有限公司,货号分别为:P0012、C0009S、P0018M;重组鼠细胞VEGF购于美国PeproTech公司,货号:400-31;Matrigel基质胶购于美国Corning公司,货号:356234;GAPDH抗体、血小板-内皮细胞黏附分子-1(CD31)抗体、内皮性一氧化氮合酶(eNOS)抗体、蛋白激酶B(AKT)抗体、磷酸化(p)-AKT抗体、哺乳动物雷帕霉素靶蛋白(mTOR)抗体、磷酸化(p)-mTOR抗体购于英国Abcam公司,货号分别为:ab9485、ab28364、ab5589、ab126811、ab8805、ab2732、ab63552;内皮素-1(ET-1)抗体购于南京安研生物科技有限公司,货号:NY-174490M;辣根过氧化物酶标记山羊抗兔二抗购于英国Abcam公司,货号:ab97051。5415R型高速低温离心机(日本Olympus公司);pectramax M5酶标仪(美国Molecular Devices公司);DP80倒置荧光显微镜(日本Olympus公司);041BR127719型电泳仪及转膜仪(美国Bio-Rad公司)。
1.5 方法
1.5.1 黄芪汤药物血清制备 随机选择SD大鼠10只,按照1.4 g/kg的剂量给予黄芪汤灌胃,另10只大鼠给予相同体积的蒸馏水灌胃。1次/d,连续3 d。第3天给药灌胃后2 h,无菌条件下腹主动脉取血10 mL,4 ℃静置2 h,离心制备血清(3000 r/min、20 min),56 ℃灭活30 min,过滤,-80 ℃储存备用。此药物血清为高剂量组,1倍比稀释为中剂量含药血清,3倍比稀释为低剂量含药血清。
1.5.2 大鼠LSEC分离和培养 使用雄性SD大鼠用于分离原代LSEC,分离方法:将前灌流液、胶原酶溶液等置于37 ℃水浴预热,无菌硅胶管一端通过恒流泵与前灌流液瓶相连,另一端通过气泡管与穿刺针相连接。大鼠麻醉后,分别用碘酒、酒精消毒皮毛,U型剖腹术分层打开腹腔,暴露内脏。分离门静脉,在门静脉近肝门处围结扎线,门静脉穿刺,插入留置针,扎紧管口,开启恒流泵,流量为10~20 mL/min,迅速剪断下腔静脉,使肝脏变为均匀的淡黄色。分离肝脏,连同留置针悬挂于放有布氏漏斗的铁架台上,待前灌流液灌注约8 min后,开始灌注胶原酶溶液循环灌注20 min,待肝被膜下肝组织几乎液化后,快速剪下肝脏,转移至培养皿,剪碎后放入装有50 mL胶原酶溶液的硅化三角烧瓶中,加入4 mL DNA酶Ⅰ溶液,加酶配制液至100 mL。将烧瓶放入恒温水浴振荡器分散肝组织,200 r/min,37 ℃,20 min。振荡后将细胞悬液通过二层200目不锈钢筛滤至2根50 mL离心管中,将细胞悬液离心(900 r/min、5 min),收集上清。然后将上清离心(1800 r/min、10 min),收集沉淀;用PBS重悬沉淀后再次离心(1800 r/min、10 min);再用10 mL PBS混匀沉淀,得到LSEC细胞悬液。沿离心管壁依次加入体积分数50%的percoll 15 mL,体积分数为25%的percoll 20 mL和10 mL细胞悬液,离心(2700 r/min、20 min)。小心吸取50%和25% percoll间的LSEC混浊带,加等量PBS,混匀,离心(2700 r/min、10 min);将沉淀悬于10 mL 20% FBS DMEM培养基中,40 min后,收集未贴壁细胞悬液,再培养于另一培养瓶中,并进行细胞计数。LSEC采用含有10% FBS、1%双抗生素的DMEM培养液,置于37 ℃恒温、5% CO2培养箱中孵育。
1.5.3 LSEC分组和药物干预处理 LSEC分为6组:空白组,VEGF组,血清对照组,黄芪汤低、中、高剂量组(以下简称空白组、VEGF组、血清组、低剂量组、中剂量组、高剂量组),每组LSEC均采用含有10% FBS、1%双抗生素的DMEM培养液培养。实验中各组LSEC药物干预处理方法如下:(1)空白组,予以上述培养液;(2)VEGF组,予以40 ng/mL的VEGF;(3)血清组,予以VEGF和10%空白血清;(4)低剂量组,予以VEGF和10%低剂量黄芪汤含药血清;(5)中剂量组,予以VEGF和10%中剂量黄芪汤含药血清;(6)高剂量组,予以VEGF和10%高剂量黄芪汤含药血清。
1.5.4 MTT检测 各组LSEC以1×104个/孔的密度接种于96孔板,予以100 μL上述培养液,37 ℃、5% CO2环境下培养48 h,然后20 μL/孔加入5 mg/mL MTT溶液,37 ℃恒温孵育4 h,弃去每孔残液,150 μL/孔加入二甲基亚砜。将96孔板置于摇床轻微摇动10 min,酶标仪检测490 nm波长的吸光值,计算细胞活力,细胞活力(%)=处理组细胞吸光值/对照组细胞吸光值×100%。
1.5.5 Transwell实验 各组LSEC悬浮于无血清培养液,密度为1×106个/mL。在上室(8 μm孔径)6孔插板上种植500 μL LSEC悬浮液;在下室添加600 μL(10% FBS和1%双抗生素)DMEM培养液。于37 ℃和5% CO2环境下孵育24 h,将迁移细胞使用4%多聚甲醛固定15 min,然后使用0.1%结晶紫染色15 min,漂洗,显微镜下观察、计数。
1.5.6 成管实验 将Corning凝胶基底膜基质(150 μL,10 μg/mL)预包被于24孔板,将密度为1×105个/孔的LSEC种植于24孔板,依照分组加入相应的培养液,37 ℃、5% CO2培养12 h后,在显微镜下观察LSEC,应用Image J软件进行血管生成长度测量。血管长度(%)=处理组细胞管长/空白组细胞管长×100%。
1.5.7 Western Blot检测 各组LSEC培养48 h后收集,使用RIPA裂解液抽提总蛋白,BCA蛋白检测试剂盒检测总蛋白含量,10%聚丙烯酰胺凝胶电泳分离蛋白,转膜到PVDF膜,5%脱脂牛奶室温下1 h进行阻断封闭,加入CD31(1∶1000)、eNOS(1∶1000)、ET-1(1∶1000)、AKT(1∶1000)、p-AKT(1∶500)、mTOR(1∶1000)、p-mTOR (1∶500)、GAPDH(1∶1000)一抗,4 ℃过夜。加入辣根过氧化物酶标记山羊抗兔二抗(1∶2000)室温下2 h,TBST洗涤3次,每次10 min,用ECL发光液显影,采用Image J软件分析。

2 结果
2.1 黄芪汤含药血清对VEGF诱导大鼠LSEC增殖的影响 MTT检测结果显示:与空白组相比,VEGF组、血清组、低剂量组LSEC增殖均显著增加(P值均<0.05);VEGF组、血清组、低剂量组比较差异无统计学意义(P>0.05);与血清组比较,中、高剂量组的LSEC活性显著下降(P值均<0.05),其中高剂量组比中剂量组的细胞活力下降更为明显(P<0.05)(表1)。
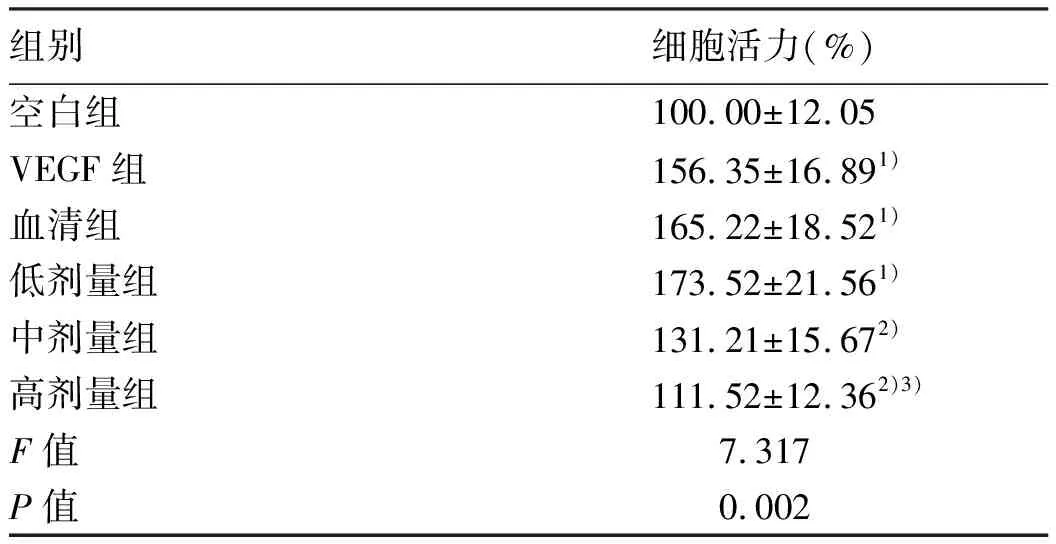
表1 各组大鼠LESC活力比较
2.2 黄芪汤含药血清对大鼠LSEC迁移的影响 Transwell试验结果显示:与空白组相比,VEGF组、血清组的LSEC迁移数目显著增多(P值均<0.05);血清组与VEGF组相比,差异无统计学意义(P>0.05);与血清组比较,低剂量组细胞的迁移数目明显增加(P<0.05),而中、高剂量组细胞的迁移数目明显减少(P值均<0.05)(图1,表2)。
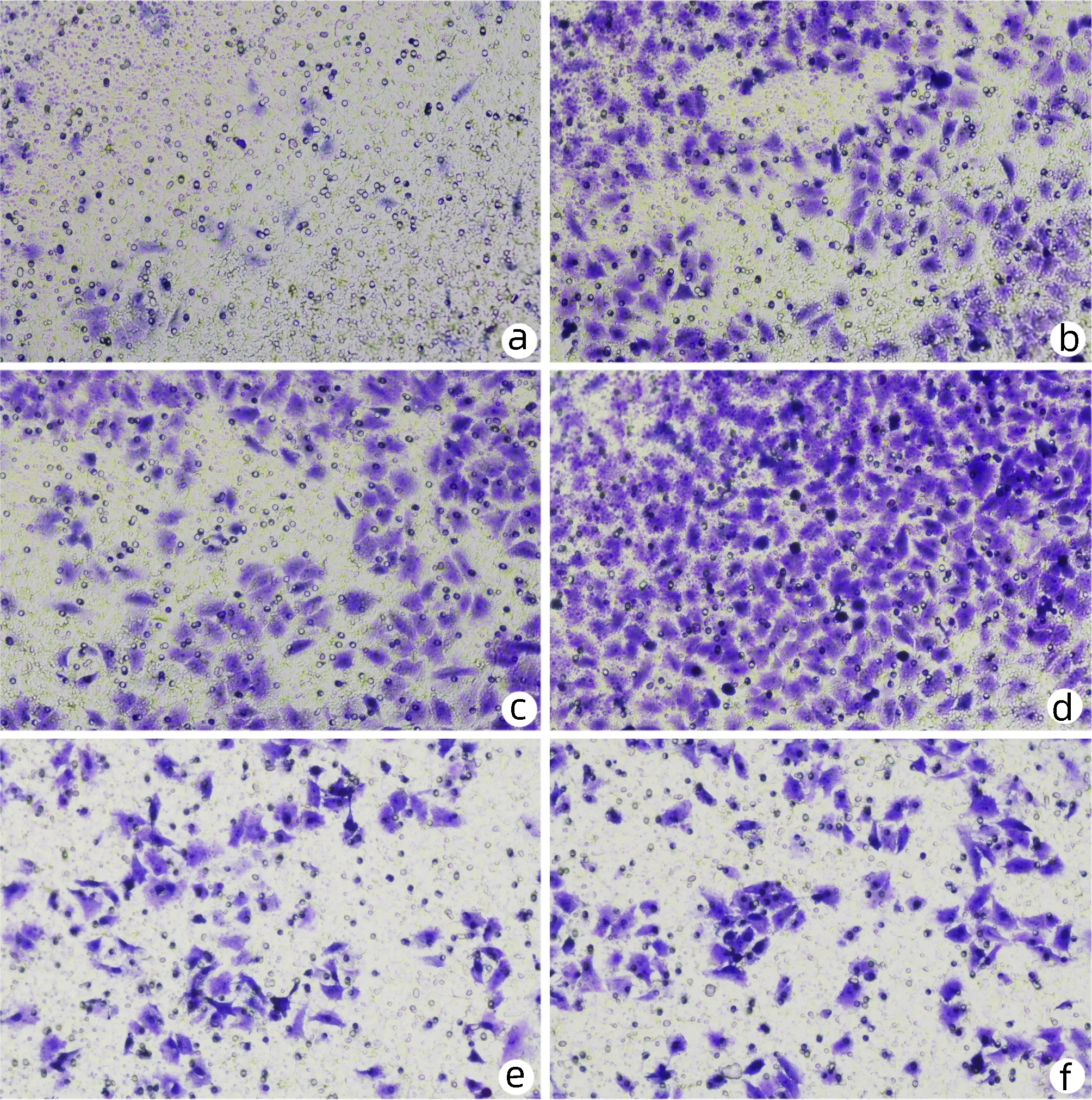
注:a,空白组;b,VEGF组;c,血清组;d,低剂量组;e,中剂量组;f,高剂量组。
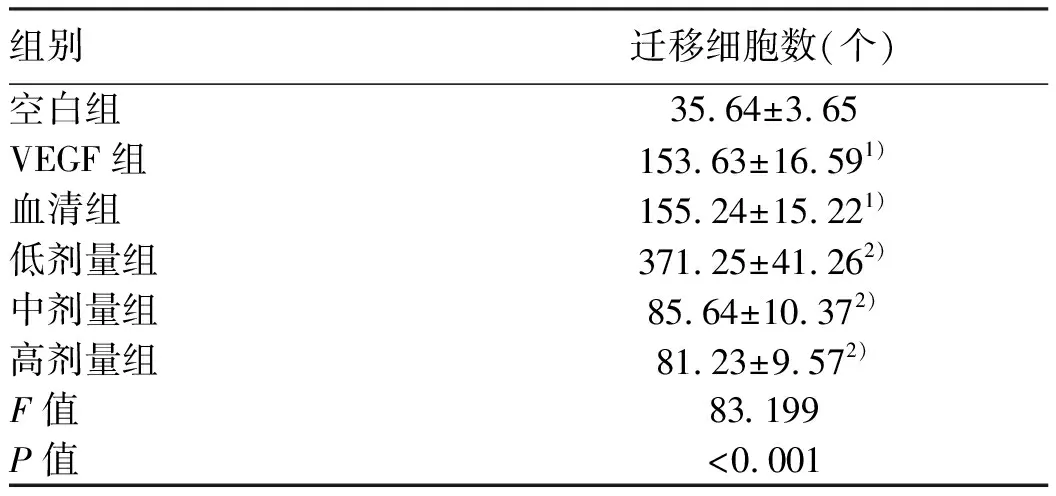
表2 各组大鼠LESC迁移细胞数目比较
2.3 黄芪汤含药血清对大鼠LSEC成管能力的影响 成管实验结果显示:空白组LSEC几乎无管腔结构形成。与空白组相比,VEGF组、血清组能明显促进LSEC管腔结构形成,其成管节点数、交叉点数、血管长度均显著增加(P值均<0.05);血清组与VEGF组成管能力比较,差异无统计学意义(P>0.05);与VEGF组、血清组相比,低剂量组对LSEC成管具有促进作用,可见管腔形成(P值均<0.05),而中、高剂量组在成管节点数、交叉点数、血管长度方面均显著降低,较少有完整管腔形成(P值均<0.05)(图2,表3)。
2.4 黄芪汤含药血清对大鼠LSEC表达CD31、eNOS和ET-1的影响 Western blot检测结果显示:与空白组比较,VEGF组、血清组LSEC中CD31、eNOS和ET-1蛋白表达显著升高(P值均<0.05);VEGF组与血清组蛋白表达差异无统计学意义(P>0.05);与VEGF组、血清组比较,低剂量组CD31和eNOS蛋白表达差异不明显(P>0.05),ET-1蛋白表达显著升高(P<0.05);与VEGF组、血清组、低剂量组相比,中剂量组CD31、eNOS和ET-1蛋白表达水平均显著下降(P值均<0.05);与中剂量组比较,高剂量组CD31、eNOS和ET-1蛋白表达水平均显著降低(P值均<0.05)(图3,表4)。
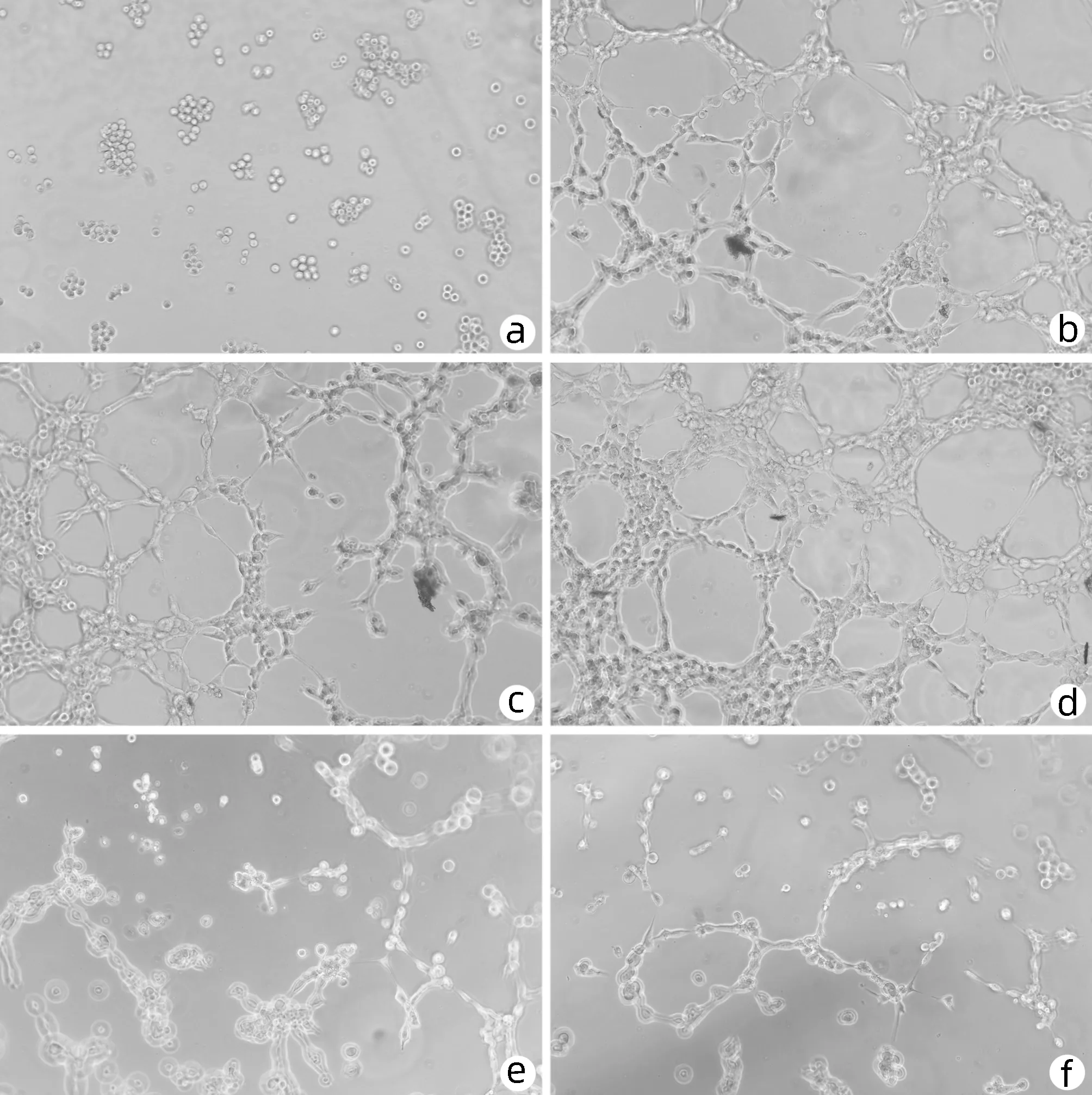
注:a,空白组;b,VEGF组;c,血清组;d,低剂量组;e,中剂量组;f,高剂量组。
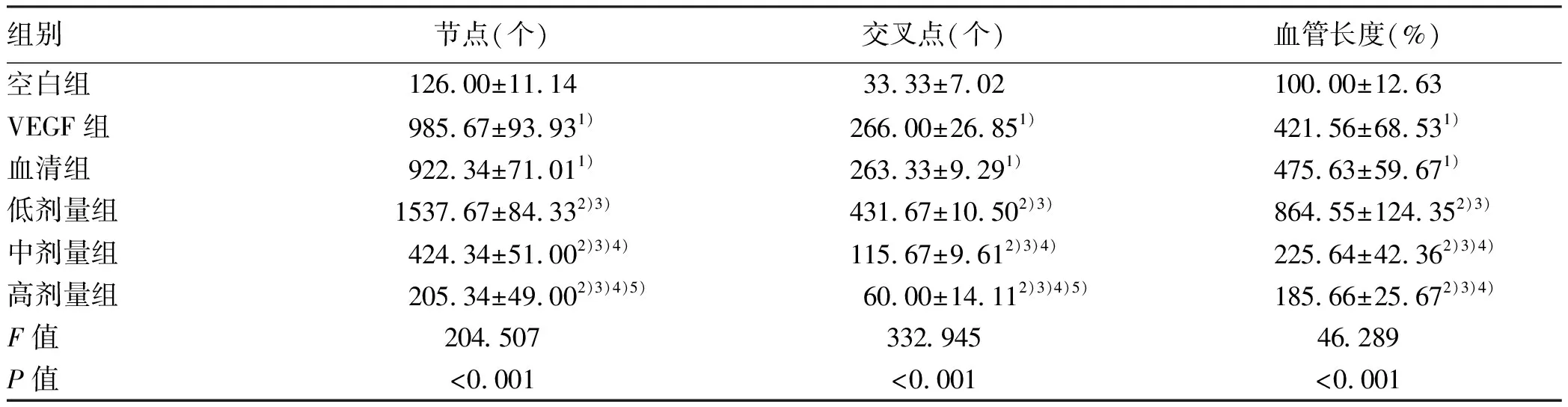
表3 各组大鼠LESC成管能力比较
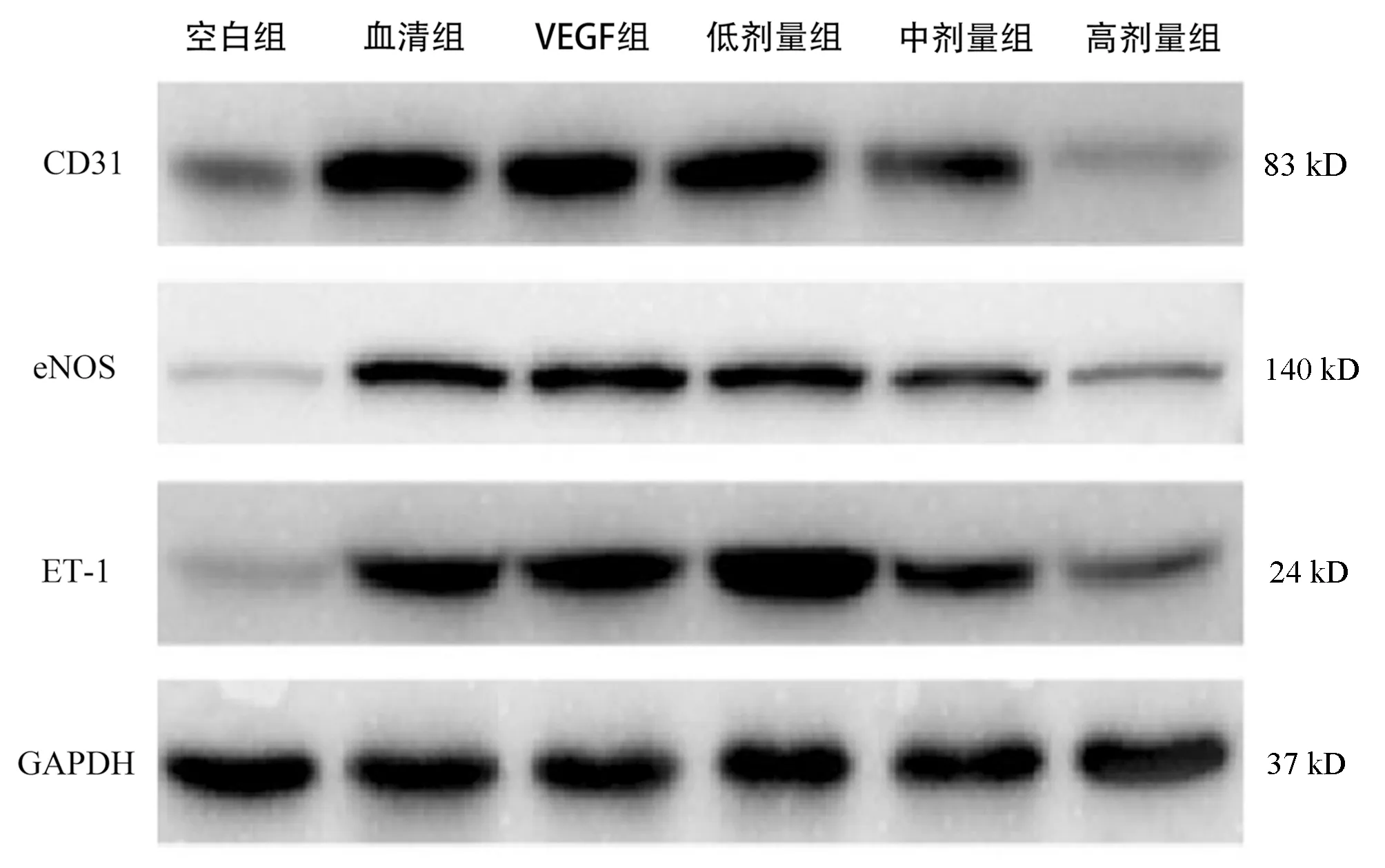
图3 各组大鼠LSEC中CD31、eNOS、ET-1、GAPDH蛋白表达
2.5 黄芪汤含药血清对AKT/mTOR信号通路的影响
Western blot检测结果显示:与空白组比较,VEGF组、血清组、低剂量组LSEC中p-AKT/AKT和p-mTOR/mTOR蛋白表达均明显增加(P值均<0.05);VEGF组与血清组之间p-AKT/AKT、p-mTOR/mTOR蛋白表达的差异无统计学意义(P>0.05);与低剂量组和血清组相比,中剂量组LSEC的p-AKT/AKT和p-mTOR/mTOR蛋白表达水平均明显下降(P值均<0.05);与中剂量组比较,高剂量组LSEC的p-AKT/AKT和p-mTOR/mTOR蛋白表达水平显著下降(P值均<0.05)(图4,表5)。
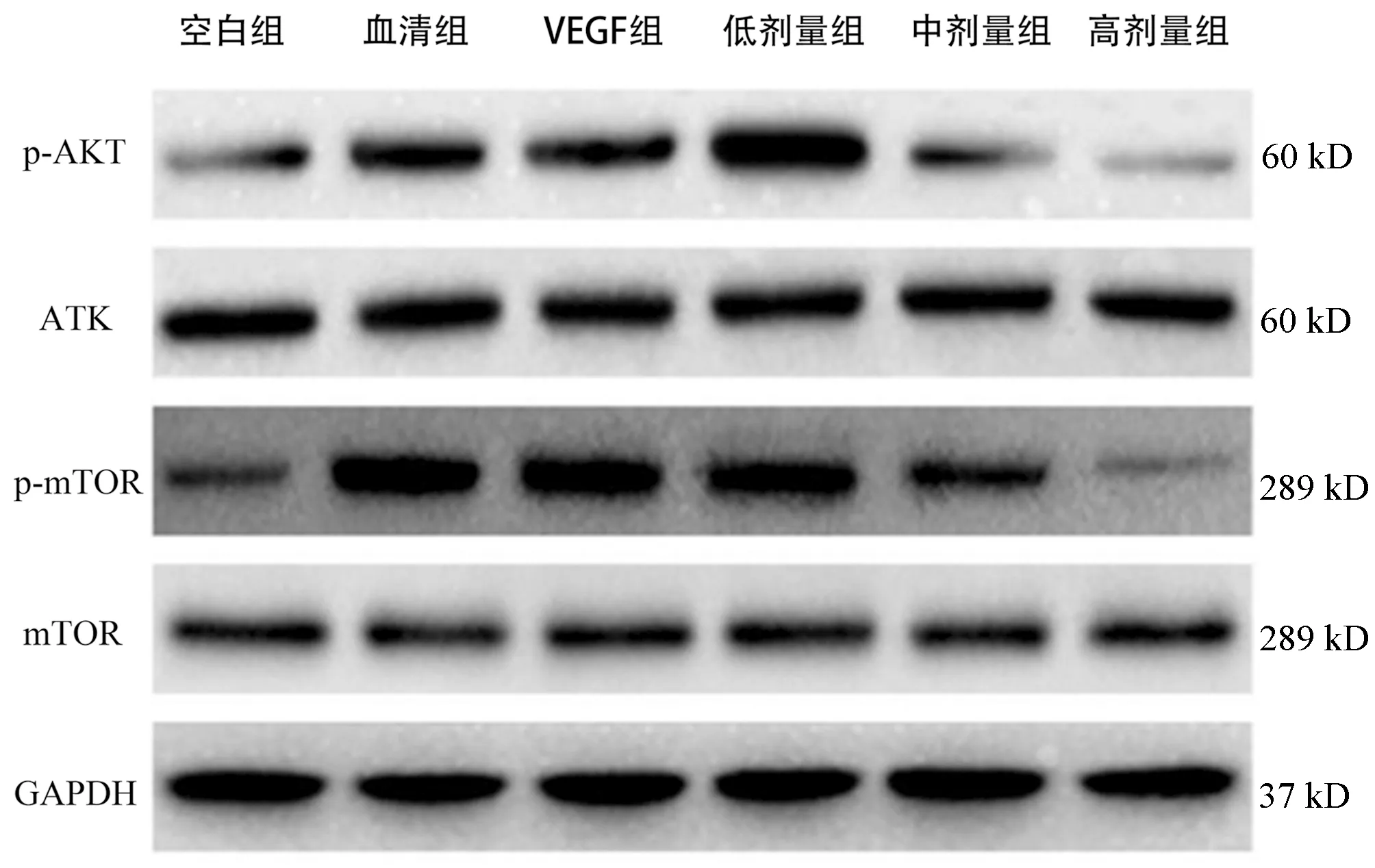
图4 各组大鼠LSEC中AKT/mTOR信号通路相关蛋白表达
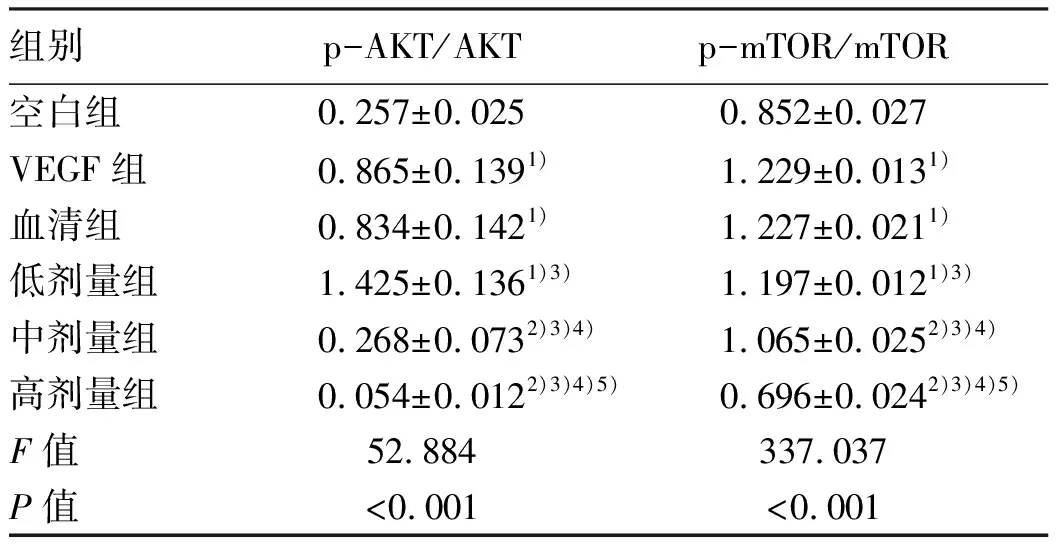
表5 各组大鼠LESC中AKT/mTOR信号通路蛋白表达比较
3 讨论
慢性肝病是全球面临的主要健康挑战之一,肝纤维化是慢性肝病进程中重要的病理阶段,决定了慢性肝病的发展和预后。如何控制、逆转肝纤维化成为慢性肝病治疗的关键。目前抗肝纤维化治疗尚未满足对预防慢性肝病进展为肝硬化、肝癌的需求[9-10],在中医学整理观念和辨证论治原则指导下,探索、优化中医药抗肝纤维化的治疗方案,符合当前肝纤维化治疗的主流[11-12]。
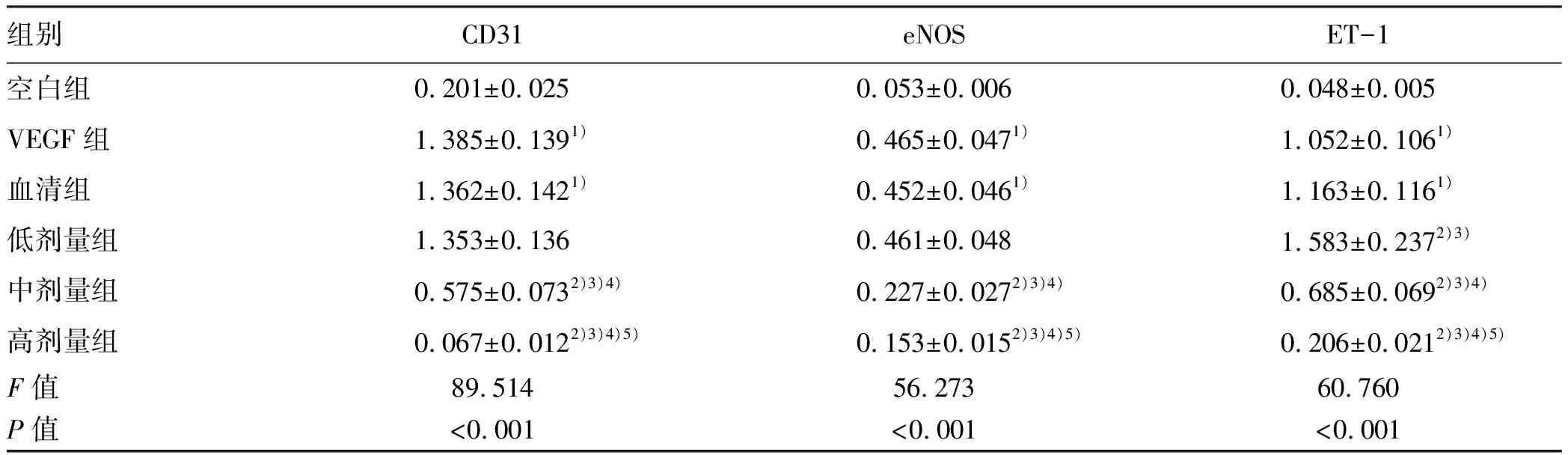
表4 各组大鼠LESC中CD31、eNOS、ET-1蛋白表达比较
肝纤维化是肝脏损伤的阶段性病理改变,现代医学未将其归属于一个独立性的疾病,中医古籍亦无肝纤维化的病名记载,现多将其归属于“胁痛”“肝积”等范畴,其病因各异,但基本病机可归纳为“虚损生积”,即机体功能损伤,无以化气,因虚致瘀,因虚生积[13]。治积之要,张元素认为“当先养正则积自除”,强调扶助正气的重要性。黄芪汤出自北宋《太平惠民和剂局方》,由黄芪、甘草6∶1相虚配伍,黄芪益气扶正,且能活血生血,甘草缓气养阴血,且助黄芪益气补血,与肝纤维化病机相契合,补气癥自消,养正积自除,虚瘀同治,标本兼顾。
LSEC是肝窦内数目最多的非实质细胞群,在维持肝脏稳态方面发挥重要的作用,其结构和功能的改变常常是肝纤维化发生的初始事件[14]。众所周知,病理性血管的新生,既伴发于肝纤维化的发生,又能加速肝纤维化的进程。肝窦毛细血管化是肝脏微血管生成的主要形式,其发生能进一步加重肝脏微循环障碍,促进肝纤维化、肝硬化的发展及并发症的形成,使肝纤维化逆转更加困难。因此抑制肝窦毛细血管化和LSEC介导的病理性血管新生,可能成为肝纤维化防治的重要策略。生理状态下LSEC不表达CD31,随着肝窦毛细血管化发生,LSEC表型发生变化,CD31表达增加,因此CD31被认为是肝窦毛细血管化的标志物[15]。ET-1主要来源于内皮细胞,与内皮素受体结合促进内皮细胞的增殖和迁移,是内皮功能障碍的病理生理学基础[16]。研究[17]表明LSEC功能障碍和损伤后会合成及分泌丰富的ET-1,引起LSEC窗孔结构改变、缩小,促进肝窦毛细血管化[18]。VEGF是eNOS的激活剂,慢性肝病中VEGF表达升高,促进LSEC表达eNOS,引起内皮细胞增殖和血管通透性改变[19],有利于长期局部血管的生成[1,20]。AKT是调控细胞增殖、分化和血管生成的重要信号分子,mTOR是其下游信号分子之一,AKT/mTOR信号通路的激活在细胞增殖、血管生成中发挥重要的作用[21]。
本研究以大鼠LSEC作为研究对象,以VEGF刺激LSEC来模拟肝纤维化发生时LSEC所处的病理环境,予以不同剂量的黄芪汤含药血清干预。结果显示,血清对照组中在VEGF诱导下可以促进LSEC增殖、迁移和血管新生,促进CD31、eNOS、ET-1蛋白表达和AKT/mTOR信号通路的激活,中、高剂量的黄芪汤含药血清可以抑制由VEGF诱导的LSEC增殖、迁移和血管新生,抑制CD31、eNOS、ET-1蛋白表达,该作用机制可能与抑制AKT/mTOR信号通路的激活相关。值得注意的是,黄芪汤对LSEC成管能力的影响可能与剂量相关,低剂量时可以促进血管新生,中、高剂量时可以抑制血管新生。关于黄芪汤对LSEC成管能力的影响更深层次的作用机制,本研究团队将在后续研究中进一步探索。
伦理学声明:本研究方案于2019年4月28日经由上海中医药大学实验动物伦理委员会审批,批号:PZSHUTCM2019041835,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:王浩艺参与课题设计,收集数据,资料分析,撰写论文;麦静愔、平键参与课题设计,收集数据,修改论文;成扬负责课题设计,拟定写作思路,指导撰写文章并最后定稿。

