羧甲基化棉短绒止血纱布的生物相容性研究
柳小军 刘康博 刘振 师月 周静 徐玉茵 王海涛 田源
0 引言
突发事故、战争和外科手术中的创伤出血难以避免,这极大地危及伤者的生命安全,而且大量失血也正是伤者死亡主要原因之一。快速有效的止血手段能提高存活率,减少伤者术后出现的并发症。及时有效的止血成为了紧急救治过程中的关键步骤。外科手术是控制创面出血的主要方法之一,而使用止血材料止血是临床中常见的辅助止血手段,目前常用的主要有医用脱脂棉纱布和各种生物医用止血材料。医用脱脂棉纱布因具有吸水能力强以及生物相容性好等优点,一直是医院及家庭在创伤出血急救时常用的止血材料[1-3],然而由于其在使用过程中容易粘连创面周围的组织器官,在移除时也较容易出现创面再出血和二次创伤[4-5],显著地降低了止血效果,进而影响手术质量和预后效果。因此,近年来生物医用止血材料在临床中的应用日益广泛。
医用可吸收止血纱布是由天然或再生纤维素经改性而制得的一类具有良好吸水性能的纤维素衍生物。这类止血材料因原料来源广泛、价格较低、可吸收和止血效果好等优点成为了在临床上应用较多的止血产品之一[6-10]。目前临床上这类止血材料仍以进口为主,虽效果较好,但价格昂贵;而国内的同类产品质量参差不齐[11]。因此,开发具有良好生物相容性且止血效果好的生物医用止血材料十分重要。
棉短绒属于天然纤维,纤维长度短,并且廉价易得,使用后易降解。目前,棉短绒及其改性制品在清理水或油污染方面受到广泛关注[12-13],然而将其用于止血纱布的制备尚未见报道。前期研究以棉短绒纱布为原料,通过化学改性制备了羧甲基化棉短绒止血纱布。棉短绒虽具有良好的生物相容性,但其经羧甲基化改性后的成分和结构均发生了改变,其生物相容性也可能发生了改变,而且根据现行的《医疗器械分类目录》要求,羧甲基化棉短绒止血纱布作为植入类医疗器械应按照第三类医疗器械进行管理。在临床应用过程中,需接触人体组织和血液,因此它不仅应无毒、无刺激性和无致敏性,还应对机体的组织和血液等系统无不良作用。因此,重新评估其生物相容性是很有必要的。本研究参考GB 16886.1—2011要求,选取了皮内反应、皮肤致敏、急性全身毒性、溶血、体外凝血指标和和体外血栓形成等试验,通过体内和体外两种不同的途径初步进行生物相容性研究,探讨其生物安全性,进而分析其在创面止血过程中可能存在的潜在风险,旨在为临床中该生物医用止血材料的安全应用提供参考。
1 试验方案
1.1 主要材料与试剂
羧甲基化棉短绒止血纱布(实验组);可吸收止血纱布(对照组,规格100 mm×75 mm,批号19111559,惠州华阳医疗器械有限公司);弗氏完全佐剂(SLCF1289,Sigma公司);生理盐水(C2191123C3,河南科伦药业有限公司);植物油(20210102,江西益普生药业有限公司)。
1.2 实验动物
日本大耳白兔,体质量2.0~2.5 kg,健康白化豚鼠,体质量300~350 g,均购于北京金牧阳实验动物养殖有限责任公司[许可证号SCXK(京)2020-0002]。SPF级KM小鼠,雌鼠无孕,体质量17~23 g,购于河南省实验动物中心[许可证号SCXK(豫)2017-0001]。
1.3 生物相容性检测
(1) 皮内反应试验:取羧甲基化棉短绒止血纱布,制备生理盐水浸提液和植物油浸提液,浸提比例为1.25 cm2/mL,置于37℃恒温箱中振荡72 h。阴性对照组为生理盐水和植物油。依据GB/T 16886.10—2017中规定的方法试验,取健康兔子3只,分别注射两种浸提液和浸提介质,并观察记录24 h、48 h和72 h各注射部位状况,按表1记录各注射点的红斑和水肿反应的记分结果,得出皮内反应试验的最终记分。

表1 皮内反应记分标准
(2) 皮肤致敏试验:取羧甲基化棉短绒止血纱布,分别制备生理盐水浸提液和植物油浸提液,浸提比例为1.25 cm2/mL,置于37 ℃恒温箱中振荡72 h。阴性对照组为生理盐水和植物油。依据GB/T 16886.10—2017中规定的最大剂量法试验,并按照Magnusson和Kligman分级,对皮肤的红斑和水肿情况进行双盲分级,得到皮肤致敏反应的平均等级。
(3) 急性毒性反应试验:取羧甲基化棉短绒止血纱布,制备生理盐水浸提液和植物油浸提液,浸提比例为1.25 cm2/mL,置于37 ℃恒温箱中振荡72 h。阴性对照组为生理盐水和植物油。依据GB/T 16886.11—2011和GB/T 14233.2—2005中规定的方法试验,自腹腔分别注射两种浸提液和浸提介质。注射完毕后,观察小鼠即时反应,并在4 h、24 h、48 h和72 h按表2观察和记录实验组和对照组动物的一般状态、毒性表现和死亡动物数,并称量动物体质量。

表2 毒性反应观察
(4) 溶血试验:依据GB/T 16886.4—2003中规定的方法试验,首先制得新鲜抗凝兔血的稀释溶液。在实验组试管中加入10 mL生理盐水和12.5 cm2羧甲基化棉短绒止血纱布。在阴性对照组与阳性对照组试管中分别加入10 mL的生理盐水和纯化水。所有试管在37 ℃恒温箱中放置30 min,分别加入抗凝兔血的稀释溶液0.2 mL,混匀后保温60 min。移出管内液体,离心取上清,用分光光度计在545 nm波长测吸光度。取三组平行,计算出各组平均值。按下式得出溶血率。
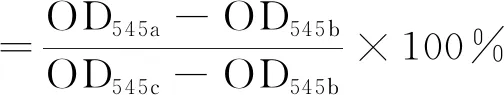
(1)
式中:OD545a为实验组光密度平均值;OD570b为阴性对照组光密度平均值;OD570c为阳性对照组光密度平均值。
(5) 体外凝血指标试验:依据凝血瀑布机制,凝血过程分为外源性凝血途径、内源性凝血途径以及共同凝血途径[14]。一般认为凝血酶原时间(prothrombin time,PT)是评价内源性凝血途径的一种有效方法;活化部分凝血酶原时间(activated partial thromboplastin time,APTT)则可作为外源性途径及共同途径凝血因子的定量实验;纤维蛋白原(fibrinogen,Fbg)用于测定血浆中纤维蛋白原的含量[15]。分别取20 mg实验组和对照组纱布,置于3 mL的硅化玻璃采血管中,依此制备5个重复样。选取健康家兔,心脏取血,新鲜兔血与3.8 %枸橼酸钠溶液以9∶1(体积比)比例混合。将新鲜抗凝全血以3000 r/min离心15 min,取1 mL上层贫血小板血浆分别加入到每个硅化玻璃采血管中,使血浆浸没样品,放置于旋转培养箱内。在37 ℃条件下,30 r/min动态接触30 min。吸取上层血浆,采用全自动凝血分析仪检测凝血酶原时间、活化部分凝血活酶时间和纤维蛋白原。空白组为纯血浆。
(6) 体外血栓形成试验:采用纤维蛋白原体外血栓形成法[16-17]。该方法基于在血液凝固关键过程中纤维蛋白原会在凝血酶作用下转化为不溶的纤维蛋白并交联形成血栓,通过测量血浆纤维蛋白原水平可以反映血栓形成中血液凝固的程度[18]。取0.5 cm2实验组和对照组纱布分别制备5个重复样放置于硅化玻璃管中。取3.8%枸橼酸钠溶液(体积比1∶0.04)新鲜抗凝兔血20 mL。向实验组与对照组中每个硅化玻璃管交叉加入1.0 mL血液。在空白组硅化玻璃管中加入1.0 mL血液。在室温下,静置15 min后,向各管中加入10 μL 的6250 U/mL肝素钠(加入顺序同上述加血液顺序)。各管充分震荡混匀后,室温静置30 min。吸取各管中的血液,2000g离心10 min后取上层血浆,在凝血分析仪上检测纤维蛋白原水平。
1.4 统计学分析
数据用平均值±标准差表示。采用Graphpad prism 7 软件对数据进行统计学分析并作图,3 组及以上统计学方法采用one-way ANOVA 检验,P<0.05 为差异有统计学意义。
2 试验结果
2.1 皮内反应试验结果
分别在24 h、48 h和72 h内对每只兔子的皮肤进行观察,实验组与阴性对照组的动物皮肤注射处均未见有明显的异常反应,两组的最终记分均为0。结果表明,羧甲基化棉短绒止血纱布无刺激性。
2.2 皮肤致敏试验结果
在24 h和48 h观察期,实验组与阴性对照组激发处理部位的皮肤均未见有明显异常反应。根据Magnusson和Kligman分级标准,实验组与阴性对照组的动物平均等级均为0级。结果表明,羧甲基化棉短绒止血纱布无皮肤致敏性。
2.3 急性全身毒性反应试验结果
实验组与阴性对照组的小鼠体质量增长正常,而且在72 h观察期内,实验组与阴性对照组小鼠活动正常,未观察到有明显的运动减少、步态不稳、呼吸困难、腹泻、震颤和死亡等异常情况。结果表明,羧甲基化棉短绒止血纱布无急性全身毒性反应。

表3 急性全身毒性试验结果(n=5)
2.4 溶血性能
阳性对照组的吸光度在0.8±0.3范围(0.8843)内,阴性对照组的吸光度小于0.03(0.0084),实验组的溶血率为1.8%。试验结果符合小于5%的安全标准要求。在试验中也观察到,离心后阳性对照组的溶液呈鲜红色,红细胞破裂现象较为明显;而实验组和阴性对照组红细胞沉在底部,溶液呈澄清透明,未见有明显的红细胞破裂现象。
2.5 体外凝血指标试验结果分析
三组之间的PT没有显著差异(P>0.05)。实验组的APTT值显著大于空白组(P<0.05),同时显著小于对照组(P<0.05)。实验组和对照组的Fbg值均显著大于空白组(P<0.05),而彼此之间无显著性差异(P>0.05),如图1所示。结果表明,实验组与对照组的PT和Fbg值均无统计学差异,而两组的APTT值虽有统计学差异,但是相对百分比为92.4%,在医疗器械要求的85%~115%允许范围内。

图1 纱布的体外凝血指标
2.6 体外血栓形成试验结果分析
实验组与对照组的纤维蛋白原含量具有显著性差异(P<0.05),并且两组含量均显著小于空白组P<0.05),如图2所示。结果表明,实验组的纤维蛋白原含量虽然与对照组相比有统计学差异,但两组的相对百分比为94.6%,在医疗器械要求的85%~115%允许范围内。
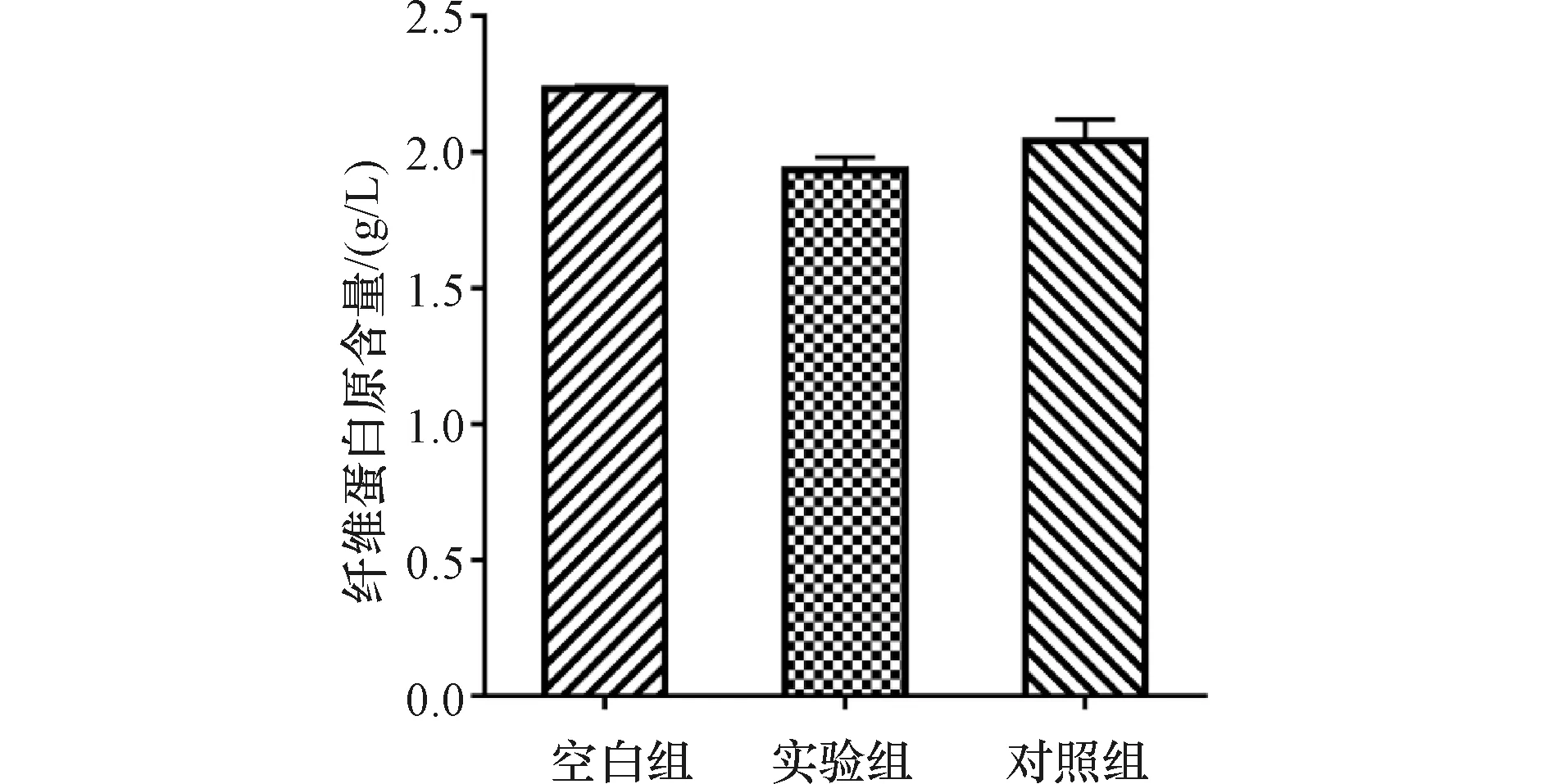
图2 体外血栓形成试验
3 讨论与结论
理想的可吸收止血材料应来源充足,易于裁剪和保存,降解能力强,具有较好的止血性能。本文在前人研究的基础上,通过羧甲基化改性棉短绒纱布制备出羧甲基化棉短绒止血纱布。该止血纱布不仅应有良好的理化性能,同时还应具有良好的生物相容性。
依据GB 16886.1—2011,皮肤刺激和致敏性是对医疗器械或材料生物相容性研究的必测项目。对机体来说,植入类的医疗器械或材料都是外来异物,均可能会引起机体的刺激作用和免疫应答,进而发生刺激和超敏反应。急性全身毒性试验是指在一次或多次大剂量给药后观察实验动物的身体状态和体质量变化等指标,评价医疗器械或材料是否有急性全身毒性反应。常用的给药方式有腹腔注射、尾静脉注射和经口灌胃等。有学者认为在标准浓度下这几种给药方式的结果无统计学差异[19],但尾静脉注射的给药方式具有起效快的优点[20]。然而因羧甲基化棉短绒止血纱布因具有凝血作用,尾静脉注射的给药方式并不适用。再结合羧甲基化棉短绒止血纱布的使用部位,经口灌胃的给药方式也不适用。因此,本试验采用腹腔注射的给药方式,并且选用极性浸提介质生理盐水和非极性浸提介质植物油。这更能够较全面体现羧甲基化棉短绒止血纱布对实验动物的急性全身毒性反应。
当医疗器械或材料植入机体后,会与机体中的血液接触并发生血液反应。体外血液相容性正是在体外环境下检测医疗器械或材料与血液接触时对血液的影响,主要有溶血率、体外凝血指标和体外血栓形成指标等。其中溶血试验能够较敏感地反映医疗器械或材料对血液中红细胞的影响,通过测定器械或材料与血液中血细胞在接触过程中红细胞的溶解和血红蛋白的游离程度来评价其在体外环境下的急性溶血活性[21]。体外凝血指标是体外血液相容性的重要内容。临床检测中PT、APTT和Fbg较为敏感[16],因此这三项已被广泛地应用于血液相容性的研究。体外血栓形成试验则是测试了血栓形成中血液凝固的程度。
综上所述,本研究通过对羧甲基化棉短绒止血纱布进行生物相容性研究,表明该止血纱布具有良好的生物安全性,为其在临床创面止血中的安全应用提供了可靠保障。

