乳清分离蛋白-苹果果胶协同稳定百里香精油Pickering乳液的制备及其抑菌保鲜性能研究
刘珍珍,辛颖*,张家豪,杨晨浩,刘昆仑*
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.郑州旅游职业学院烹饪食品学院,河南 郑州 450009)
精油被认为是芳香性植物的次生代谢产物,具有良好的抗菌、抗病毒和抗氧化能力[1-2]。其中,百里香精油(thyme essential oil,TEO)作为一种广谱抗菌剂和强抗氧化剂在果蔬涂膜保鲜中受到广泛关注[3-6]。然而,由于其是一种稳定性较差的油性液体,不仅遇光、遇氧或加热后容易挥发或分解,而且气味刺鼻、溶解度低、释放快,大大限制了其作为抑菌活性物质在果蔬保鲜方面的应用。为了克服TEO的易感性,对其进行封装缓释一直是研究热点。Pickering乳液作为一种由胶体颗粒稳定的乳状液,比表面活性剂稳定体系具有更高的抗挥发性,这意味着胶体颗粒稳定的精油Pickering乳液体系应用于果蔬保鲜时,具有更长的缓释作用[7-9],可进一步延长货架期。
目前,用于稳定Pickering乳液体系的胶体颗粒种类繁多,蛋白质-多糖复合体系因在改善颗粒表面活性方面存在协同效应而得以广泛研究[10-11]。乳清分离蛋白(whey protein isolate,WPI)具有突出的营养价值和理化性质,苹果果胶(apple pectin,AP)是一种阴离子多糖,在特定pH值范围内两者能够携带相反电荷而产生静电络合作用,形成蛋白质-多糖复合纳米颗粒,用于Pickering乳液的制备,但静电复合物具有较高的环境敏感性,导致其在涂膜保鲜中的应用受到极大的限制。已有研究表明,通过热诱导的方法能够制备出相对稳定的食品级蛋白质-多糖复合纳米颗粒[12-14]。因此,本研究采用热诱导法制备WPI-AP复合纳米颗粒稳定的负载TEO Pickering乳液,系统研究WPI与AP质量比、颗粒浓度、热改性温度以及超声强度对其包埋率和体系稳定性的影响,同时通过抑菌圈(diameter of inhibition zone,DIZ)、最小抑菌浓度(minimal inhibitory concentration,MIC)和鲜切苹果涂膜保鲜试验对其抑菌保鲜性能进行评价,为该乳液在鲜切果蔬涂膜保鲜中的研究与应用提供参考。
1 材料与方法
1.1 材料与试剂
百里香精油:吉安市中香天然植物有限公司;乳清分离蛋白(食品级):恒天然合作社集团有限公司;苹果果胶(食品级):宁波鼎元食品科技有限公司;冰乙酸、氢氧化钠、正己烷、丙三醇(均为分析纯):天津市天力化学试剂有限公司;无水乙酸钠(分析纯)、琼脂粉:天津市科密欧化学试剂有限公司;营养肉汤:北京奥博星生物技术有限责任公司;红富士苹果:市售。
1.2 仪器与设备
pH计(PHS-3C):上海仪电科学仪器股份有限公司;高速剪切分散乳化机(F18):上海弗鲁克科技发展有限公司;超声波细胞粉碎机(JY92-IIN):宁波新芝生物科技股份有限公司;激光粒度分析仪(BT-9300ST):丹东百特仪器有限公司;数显恒温水浴锅(FJS-6):上海维诚仪器有限公司;色彩色差仪(CR-400):柯尼卡美能达办公系统有限公司。
1.3 试验方法
1.3.1 Pickering乳液制备的单因素试验
1.3.1.1 WPI与AP质量比对Pickering乳液性质的影响
分别称取一定质量的WPI和AP溶于10 mmol/L、pH4.5的醋酸缓冲液中,使WPI和AP质量比分别为3 ∶1、2 ∶1、1 ∶1、1 ∶2、1 ∶3,磁力搅拌 12 h,使其充分溶解,得到质量浓度为1.5%的WPI-AP悬浮液。调节溶液pH值至4.5,80℃水浴加热15 min,立即采用冰浴冷却至25℃,即可得到WPI-AP复合纳米颗粒。向制得的纳米颗粒分散体系中,加入20%TEO,13 500 r/min剪切30 s制得粗乳液,然后在超声强度4.35 W/cm2条件下,使用超声波细胞破碎仪制备Pickering乳液。
1.3.1.2 纳米颗粒质量浓度对Pickering乳液性质的影响
在WPI与AP质量比1∶2的条件下,配制质量浓度分别为 0.9%、1.5%、2.1%、2.7%、3.3%的 WPI-AP悬浮液,调节溶液pH值至4.5,然后在热改性温度80℃以及超声强度4.35 W/cm2条件下,进行Pickering乳液的制备。
1.3.1.3 热改性温度对Pickering乳液性质的影响
在WPI与AP质量比1∶2的条件下,配制质量浓度为2.7%的WPI-AP悬浮液,调节溶液pH值至4.5,然后控制热改性温度分别为 75、80、85、90、95 ℃,超声强度4.35 W/cm2条件下进行Pickering乳液的制备。
1.3.1.4 超声强度对Pickering乳液性质的影响
固定WPI与AP质量比1∶2,颗粒质量浓度为2.7%,热改性温度80℃,分别在超声强度3.00、4.35、5.70、7.05、8.40 W/cm2条件下,使用超声波细胞破碎仪制备Pickering乳液。
1.3.2 Pickering乳液包埋率的测定
参照吴子涵等[15]的方法,并稍作修改。取1 mL Pickering乳液,加入5 mL正己烷,漩涡振荡20 s,5 000 r/min离心10 min,离心后上清液稀释100倍,274 nm处测定吸光度,通过标准曲线与下列公式计算乳液包埋率。

1.3.3 乳液粒径及多分散性的测定
采用激光粒度分析仪测定Pickering乳液的平均粒径及多分散性指数(polydispersity index,PDI)。仪器参数:折射率1.450,测试温度25℃,平衡时间30 s,每个样品测试3次。
1.3.4 负载TEO Pickering乳液抑菌性能考察
1.3.4.1 抑菌圈(DIZ)的测定
分别取108CFU/mL的金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌菌液各100 μL涂布于营养琼脂培养基上,待菌液吸收后用孔径6 mm的打孔器在琼脂平板上打孔。以无菌水为空白对照,向孔内加入一定体积过滤除菌的TEO和乳液(控制乳液中精油含量与纯精油含量一致)。水平放置于4℃冰箱中,待样品完全扩散后,置于37℃恒温培养箱中倒置培养24 h,培养结束,用十字交叉法测量各抑菌圈直径。每个菌种均重复试验3次,取平均值。
1.3.4.2 最小抑菌浓度(MIC)的测定
将一系列不同浓度的TEO Pickering乳液与100μL、浓度为108CFU/mL的菌悬液25℃混匀,然后将其均匀涂布于营养肉汤琼脂培养基上,以不加乳液作空白对照,置于37℃生物培养柜中培养24 h。以不生长菌样品的最低浓度作为TEO Pickering乳液对该菌的MIC值。每个菌种测试至少重复3次,取其平均值。
1.3.5 负载百里香精油Pickering乳液的涂膜液对鲜切苹果的保鲜试验
1.3.5.1 涂膜液的制备
用电子天平精确称取一定质量的WPI粉末,加入蒸馏水使其溶解,放在磁力搅拌器上搅拌均匀,制得10.5%的WPI溶液。然后在数显恒温水浴锅内90℃下搅拌30 min,取出冷却后加入60%的甘油再搅拌均匀,即得WPI涂膜液。而后加入0.5%的负载TEO Pickering乳液,磁力搅拌15 min,13 500 r/min高速剪切5 min,得到WPI-TEO Pickering乳液复合涂膜液。
1.3.5.2 鲜切苹果涂膜处理
在市场挑选大小、色泽接近且无损伤的“烟台红富士”苹果,然后在4℃冰箱中预冷24 h,先将苹果表面用清水清洗干净,然后在200 μL/L的次氯酸钠溶液中浸泡灭菌2 min,再用蒸馏水洗涤并在25℃下干燥;之后用预先消毒过的刀具去除苹果的果皮和果核,取与表皮和果核相同距离的中间组织部位,切成1 cm3的方块,混合均匀。将取样均匀的苹果块随机分成对照组(CK)、WPI处理组(W)和 WPI-Pickering乳液组(W+P),对照组浸泡在蒸馏水中,另外两组分别浸泡在对应的涂膜溶液中,均浸泡2 min。涂膜处理的样品在25℃晾至不再有液体滴落,而后转移至一次性保鲜盒中25℃下晾干。每组固定取30个苹果块测定失重率、腐烂率和色泽变化,每个处理均做3个平行。将处理好的苹果块置于8℃条件下储藏,每隔2 d对苹果进行取样测定。
1.3.5.3 腐烂率测定
统计每组苹果的腐烂情况(菌斑、腐烂、发黑),腐烂率按照下式计算[16]。

1.3.5.4 失重率测定
失重率按照下式计算[17]。

1.3.5.5 色泽测定
将样品从贮藏环境中取出后在25℃下平衡,用色差计测定L*、a*、b*值。每组测定3个果实。鲜切苹果的色泽指标选择亮度(L*)和颜色饱和度(C*)进行分析,计算公式如下[18]。
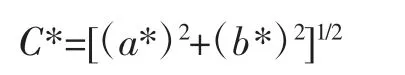
1.3.6 数据分析
采用SPSS 26.0和Origin 2021软件进行统计分析及作图,结果用平均值±标准差表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 WPI与AP质量比对Pickering乳液性质的影响
WPI与AP质量比对Pickering乳液性质的影响见图1。
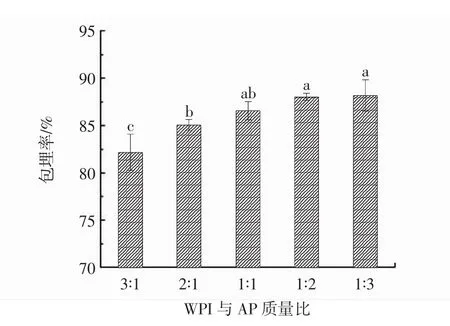
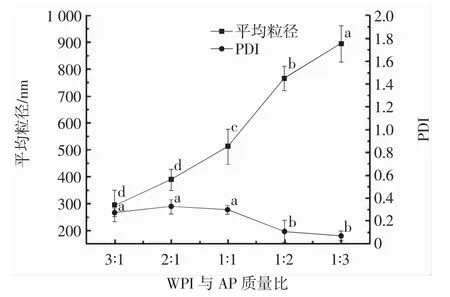
图1 WPI与AP质量比对Pickering乳液包埋率和平均粒径的影响Fig.1 Effect of WPI and AP ratio on Pickering emulsion embedding rate and average particle size
从图1可见,随着AP比例的增多,Pickering乳液的包埋率和平均粒径呈现逐渐上升趋势,这可能是由于AP分子之间会发生桥接效应,彼此缠绕结合在蛋白质的外部,颗粒整体形成一个核壳型结构,进而使复合物在精油表面具有更好的吸附效果和更强的稳定性[19-20]。然而,WPI与AP质量比为1∶2后,包埋率趋于稳定,且PDI较小并趋于稳定,这主要是由于在此质量比下精油表面空间能够被吸附的复合粒子已经达到极限,此时乳液具有较高的包埋率和较强的体系稳定性。因此,选定WPI与AP质量比1∶2作为制备Pickering乳液的最佳颗粒配比。
2.1.2 纳米颗粒质量浓度对Pickering乳液性质的影响
纳米颗粒质量浓度对Pickering乳液包埋率和平均粒径的影响见图2。

图2 纳米颗粒质量浓度对Pickering乳液包埋率和平均粒径的影响Fig.2 Effect of mass concentration of nanoparticles on Pickering emulsion embedding rate and average particle size
从图2可见,随着颗粒浓度的增加,Pickering乳液的包埋率呈现上升趋势,这主要是由于更多的颗粒数量能够充分将精油包裹起来[21-24]。当浓度达到2.1%后,包埋率趋于稳定。而当浓度超过2.7%后,包埋率呈现下降趋势,这可能是由于颗粒浓度过高,颗粒分散体流动性变差,导致乳液黏度增大,乳化不完全。另外,颗粒浓度为2.7%时乳液表现出较小的平均粒径和PDI。因此,选定颗粒浓度2.7%作为制备Pickering乳液的最佳颗粒浓度。
2.1.3 热改性温度对Pickering乳液性质的影响
热改性温度对Pickering乳液包埋率和平均粒径的影响见图3。
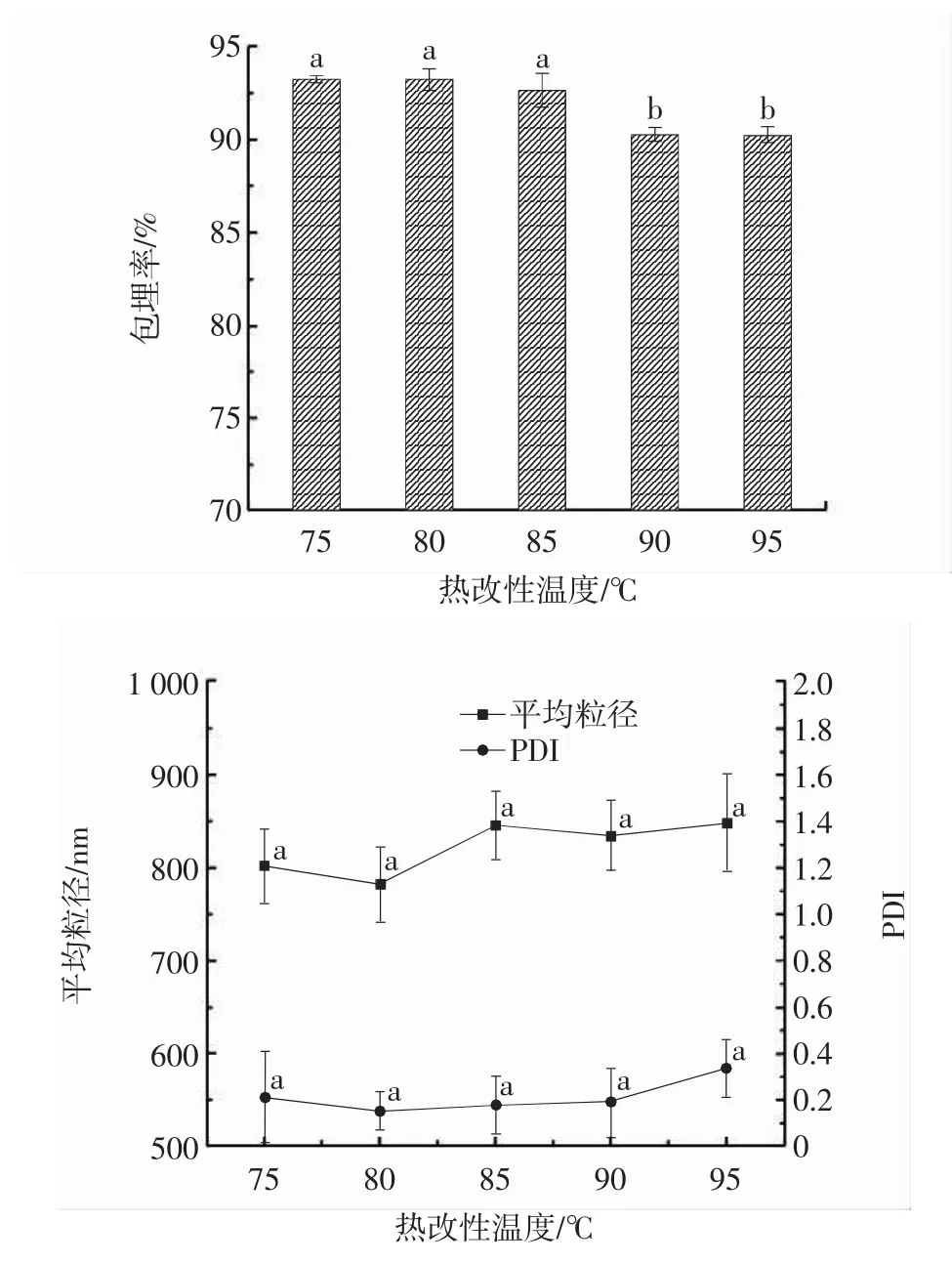
图3 热改性温度对Pickering乳液包埋率和平均粒径的影响Fig.3 Effect of thermal modification temperature on Pickering emulsion embedding rate and average particle size
从图3可见,热改性温度从75℃到85℃,Pickering乳液包埋率没有显著变化(P>0.05)。但是在80℃之后包埋率呈现下降趋势,这可能是由于温度升高,蛋白质变性程度增加,进而产生聚集现象,使得其乳化性和乳化稳定性下降[25]。从粒径结果也可以看出,Pickering乳液在80℃时表现出最小的平均粒径,80℃之后平均粒径和PDI出现变大趋势。因此,选定热改性温度80℃作为制备Pickering乳液的最佳热改性温度。
2.1.4 超声强度对Pickering乳液性质的影响
超声强度对Pickering乳液包埋率和平均粒径的影响见图4。
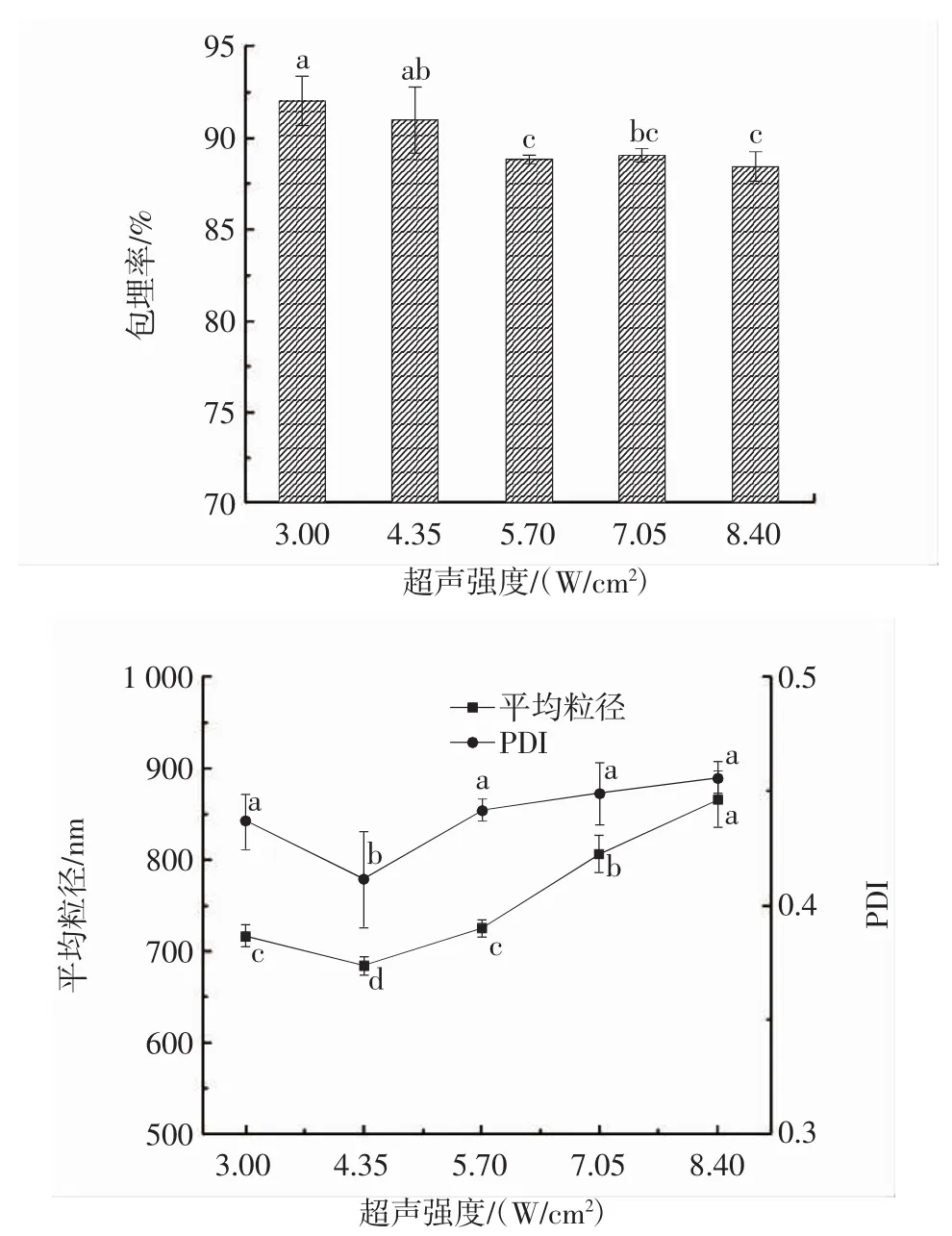
图4 超声强度对Pickering乳液包埋率和平均粒径的影响Fig.4 Effect of ultrasonic intensity on Pickering emulsion embedding rate and average particle size
从图4可见,随着超声强度的增大,Pickering乳液的包埋率呈现先下降后趋于稳定的趋势,而乳液的平均粒径和PDI呈先下降后上升趋势。在超声强度为4.35 W/cm2时,乳液的包埋率为(90.96±1.83)%,与超声强度3 W/cm2时的结果无显著性差异(P>0.05),而在4.35 W/cm2时平均粒径和PDI出现最小值。这可能是由于超声强度过大会在一定程度上破坏颗粒的稳定性,产生离解现象,使包埋率有所降低[26]。然而,在超声强度过小的情况下,产生的空化强度不足以使高速剪切后的粗乳液充分细化。因此,选定超声强度4.35 W/cm2作为制备Pickering乳液的最佳超声强度。
综上所述,选定WPI与AP质量比1∶2、颗粒质量浓度2.7%、热改性温度80℃以及超声强度4.35 W/cm2作为制备具有较高包埋率和良好体系稳定性的Pickering乳液的最佳条件。
2.2 负载TEO Pickering乳液抑菌性能测定结果
鲜切果蔬由于失去果皮的保护,表面流出的营养汁液会成为微生物的天然培养基,其中两大主要微生物类型为致病菌和致腐菌。金黄色葡萄球菌和单增李斯特菌均为能够引起食物中毒的较常见的食源性致病菌,枯草芽孢杆菌是易引起鲜切果蔬腐败变质的典型致腐菌之一[27-28]。
采用琼脂扩散法研究游离TEO和其Pickering乳液样品对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌的抑菌圈直径(DIZ),结果如图5和表1所示。
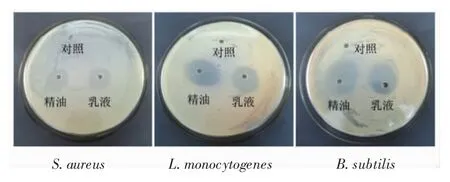
图5 TEO和其乳液对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌的抗菌活性Fig.5 Antibacterial activity of TEO and its emulsion against Staphylococcus aureus,Listeria monocytogenes and Bacillus subtilis
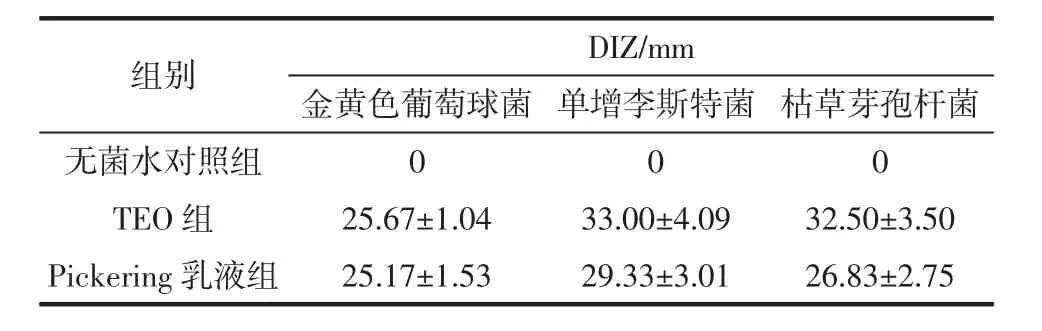
表1 TEO和其乳液对不同细菌抑菌圈的影响Table 1 Effects of TEO and its emulsion on different bacteriostatic circles
由表1可知,Pickering乳液对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌的DIZ值分别为(25.17±1.53)、(29.33±3.01)mm 和(26.83±2.75)mm,尽管小于TEO组的DIZ值,但均大于20 mm,说明两者均具有高度敏感抑菌作用[18]。Pickering乳液的包埋虽然在较短的时间内降低了其功能活性,但在存储期间会释放增强,这种现象能够使它们在不同的应用环境下和更长的时间内保持功能活性,例如在食品活性薄膜中的应用[7,29-31]。
采用二倍梯度稀释法测定TEO Pickering乳液对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌的MIC值,结果如图6所示。
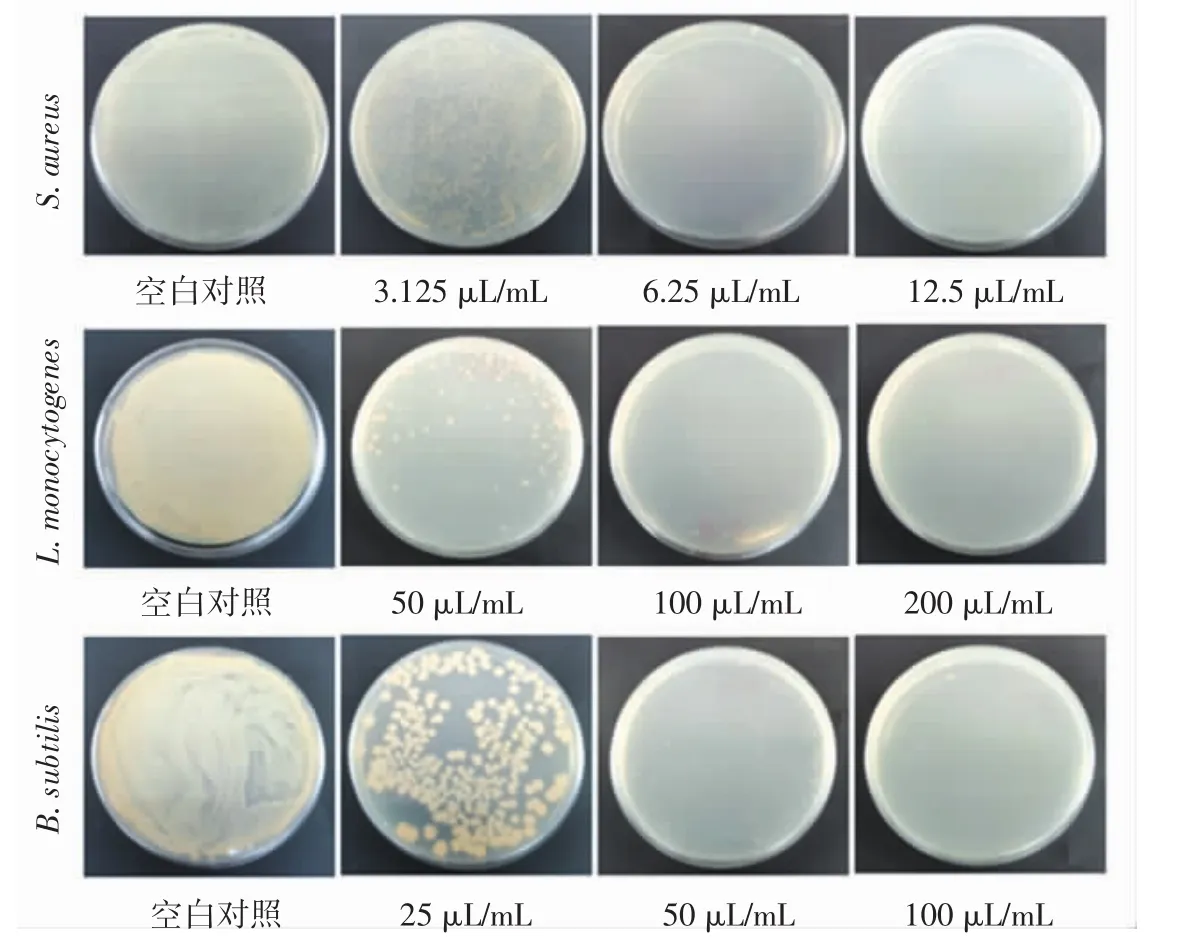
图6 TEO Pickering乳液对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌的MIC值测定照片Fig.6 Determination of MIC values of TEO Pickering emulsion against Staphylococcus aureus,Listeria monocytogenes and Bacillus subtilis
由图6可知,TEO Pickering乳液对金黄色葡萄球菌的MIC值为12.5 μL/mL,而对单增李斯特菌和枯草芽孢杆菌的MIC值则达到了200 μL/mL和100 μL/mL。结合抑菌圈试验结果可知,TEO Pickering乳液对金黄色葡萄球菌的抑菌效果良好。然而,TEO Pickering乳液对单增李斯特菌和枯草芽孢杆菌虽然具有更敏感的抑菌作用,但MIC值较大。
2.3 负载TEO Pickering乳液的涂膜液对鲜切苹果的保鲜作用
2.3.1 鲜切苹果腐烂率的测定结果
由于鲜切果蔬的果肉组织直接与外界接触,再加上鲜切加工过程中的机械损伤,极易受到微生物的污染发生腐败变质。不同处理组对鲜切苹果腐烂率的影响如图7所示。

图7 涂膜处理对鲜切苹果腐烂率的影响Fig.7 Effect of coating treatment on decayed rate of fresh-cut apple
由图7可知,在储藏期间的前4 d内,各处理组均未出现腐烂现象。从第4天开始,CK组和W组腐烂率均出现急剧上升趋势。在第8天时CK组和W组腐烂率分别达到了(92.22±1.92)%和(73.33±6.67)%。然而,W+P组的鲜切苹果在整个储藏期间几乎未发生腐烂现象。
2.3.2 鲜切苹果失重率的测定结果
储藏过程中,鲜切苹果由于果实组织的蒸腾作用使水分减少,造成质量损失,失重率是评价鲜切果蔬品质的一个重要指标。不同处理组对鲜切苹果失重率的影响如图8所示。
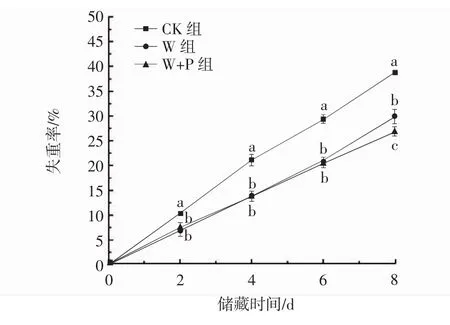
图8 涂膜处理对鲜切苹果失重率的影响Fig.8 Effect of coating treatment on weight loss rate of fresh cut apple
由图8可知,在整个储藏期间,各试验组的失重率均出现上升趋势。W组和W+P组的失重率显著低于CK组(P<0.05),这可能是由于涂膜处理在鲜切苹果表面形成了一层薄膜,这层乳清分离蛋白薄膜具有一定的阻水性能[32-33],阻止由于蒸腾作用造成的水分散失。从W组和W+P组4 d~8 d的失重率结果可以看出,W+P组的失重率低于W组,且趋势逐渐增大,且到第8天出现了显著性差异(P<0.05)。
2.3.3 鲜切苹果的色泽变化
鲜切果蔬的色泽是影响消费者对其品质感知的一个重要指标,也是影响其货架寿命的主要因素。不同处理组对鲜切苹果色泽的影响如图9所示。
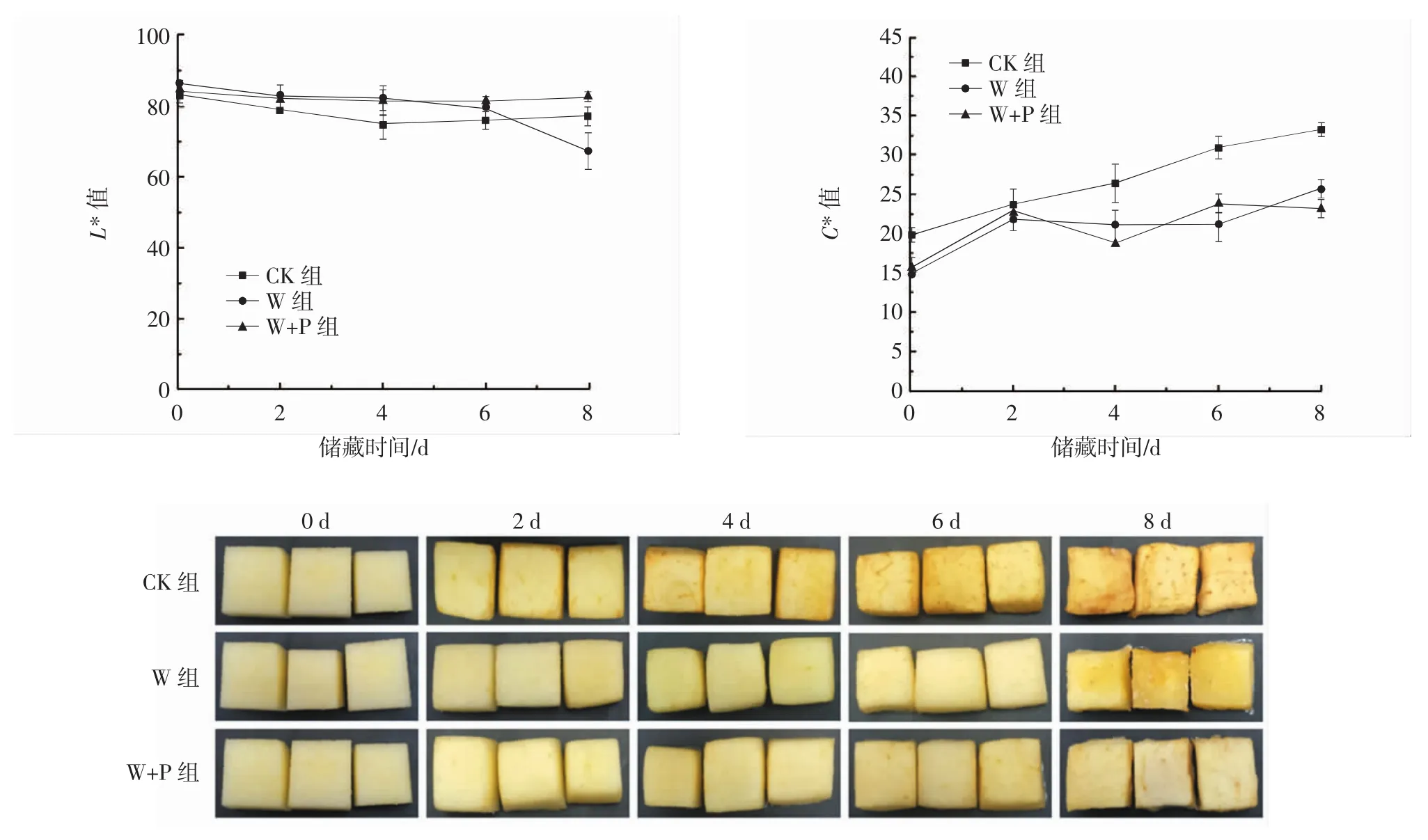
图9 涂膜处理对鲜切苹果L*值、C*值和外观色泽变化的影响Fig.9 Effect of coating treatment on L*value,C*value and appearance color change of fresh cut apple
L*值是评价鲜切苹果褐变程度的一个重要指标。L*值越低,表示储藏期间由酶促褐变或色素聚集而引起的水果褐变越严重。由图9可知,0~6 d,W组和W+P组的L*值均高于CK组,这是因为涂膜可以隔绝氧气,阻止鲜切苹果氧化褐变。另外,W+P组在整个储藏期间L*值无明显变化,说明TEO对鲜切苹果起到了良好的抗氧化作用。C*值表示样品的颜色饱和度,在整个储藏期间,CK组的C*值呈现明显上升趋势,且均高于W组和W+P组。
鲜切苹果的外观色泽变化可从图9比较直观地看出,W+P组的外观颜色优于其他组别。随着储藏时间的延长,CK组的鲜切苹果褐变程度逐渐加深;W组的苹果在前6 d内没有出现很明显的褐变现象,而在8 d时褐变现象明显。这些现象都与前面所测鲜切苹果L*值以及C*值数据保持一致。
3 结论
本文以包埋率和体系稳定性为评价指标,通过单因素试验得到负载TEO Pickering乳液最佳制备条件为WPI与AP质量比1∶2、颗粒质量浓度2.7%、热改性温度80℃、超声强度4.35 W/cm2。另外,抑菌试验结果表明,负载TEO Pickering乳液对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌均具有显著的抑菌活性。在对鲜切苹果的涂膜保鲜研究中,负载TEO Pickering乳液涂膜处理大大降低了鲜切苹果的腐烂率,并基本维持了其原有色泽。本研究对WPI-AP协同稳定TEO Pickering乳液在鲜切果蔬保鲜方面的应用提供了重要的参考价值。

