芪丹通脉片对ApoE-/-小鼠动脉粥样硬化易损斑块及NLRP3炎症小体的影响
杨槟钰,王南丁,马 振,李 哲,王李雯,张 莎,陈晋玉,全依晨
(1. 陕西中医药大学,陕西 咸阳 712046;2. 西安市中医医院,陕西 西安 710021;3. 陕西中医药大学第一临床医学院,陕西 咸阳 712046;4. 陕西中医药大学基础医学院,陕西 咸阳 712046)
统计资料显示,急性冠状动脉综合征(acute coronary syndrome,ACS)已成为致死率最高的冠心病临床类型[1],其发生的关键是动脉粥样硬化易损斑块的破裂或糜烂,诱发急性血栓形成[2]。所以干预易损斑块的形成及破裂对于临床防治ACS,降低死亡率至关重要。大量实验研究表明,易损斑块的形成、破裂与机体炎症反应的发生关系密切,炎症反应的发生会加速易损斑块的形成与破裂[3-4]。益气活血中药复方芪丹通脉片是治疗冠心病的常用药物,前期动物研究证实其能缩小颈动脉粥样硬化小鼠不稳定斑块,减少动脉内斑块数量,降低斑块脂质含量,抑制血管平滑肌细胞凋亡,可通过抑制TLR4/NF-κB信号通路,降低炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、C反应蛋白(CRP)水平,具有抗炎、稳定斑块的作用[5-6],但其作用机制仍有待明确。有实验证实NLR 家族的PPR能通过将炎性因子白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)的前体蛋白水解并切割成其活性形式来激活炎症细胞,激活炎症反应是一种有效的细胞内炎症机制[7-8]。本实验进一步从炎症角度,探讨芪丹通脉片是否能通过抑制NLRP3炎症小体的激活,达到抗炎、维持斑块稳定性的目的。
1 实验材料与方法
1.1实验动物 雄性SPF级ApoE-/-小鼠60只,体重19~21 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。本实验通过陕西中医药大学动物伦理委员会批准,小鼠自由饮水,标准化饲养。
1.2药物浸膏干粉的制备 芪丹通脉片浸膏干粉的具体制备工艺参见文献[9],其浸膏干粉相当于生药的2.86 g, 批号:2002ZL068;黄芪甲苷干粉每瓶约500 mg,纯度≥98%,购于上海阿拉丁生化科技股份有限公司,货号:A111275;丹参酮IIA干粉每瓶约1 g,纯度≥98%,购于上海阿拉丁生化科技股份有限公司,货号:T109795。
1.3实验方法 将小鼠随机分为对照组、不稳定斑块组、益气组、活血组和复方组,每组12只。实验过程中对照组小鼠给予普通饲料饲养,其余4组均给予高脂饲料(普通颗粒饲料中添加1.25%的胆固醇、15%脂肪的高脂饲料)喂养。同时益气组灌胃黄芪浸膏干粉溶剂(0.52 g生药/kg),活血组灌胃丹参浸膏干粉溶剂(1.31 g生药/kg),复方组灌胃芪丹通脉片浸膏干粉溶剂(2 g生药/kg),对照组和不稳定斑块组灌胃等体积生理盐水,均1次/d。连续灌胃14 d后,对各组小鼠进行右侧颈动脉外置管术(PCCP):腹腔注射戊巴比妥钠麻醉小鼠,切开颈部正中皮肤,分离右颈总动脉,右颈总动脉周围置入硅胶管(内径为0.3 mm),鞘管上中下三段用6-0丝线固定,复位颈总动脉,关闭颈部切口,归笼。术后各组继续原来干预12周。
1.4检测指标及方法
1.4.1外周血炎性因子水平 干预结束后,小鼠麻醉后摘眼球取血,放置于1.5 mL EP管中,室温静置2 h,于4 ℃下2 500×g离心25 min,去除沉淀,上清液保存于-20 ℃。采用ELISA法,按照试剂盒说明书检测血清IL-1β和IL-18水平,每组重复5次。
1.4.2颈动脉斑块HE染色组织学观察 小鼠麻醉后仰卧固定于手术台,剖开胸腔,左心室尖部穿刺注入PBS液,剪开右心房以灌注全身血管,5 min后换用4%多聚甲醛固定液灌注20 min。分离完整的右颈总动脉,用OCT包埋右侧颈总动脉血管标本于冰冻头上,冰冻切片机切成6 μm的冰冻切片并贴附于多聚赖氨酸载玻片上,-70 ℃条件下存放,常规HE染色观察斑块的大小、面积及结构。
1.4.3颈动脉组织中巨噬细胞(CD68)、平滑肌细胞(a-actin)表达免疫荧光染色观察 切片放于室温下回暖30 min,晾干其表面水分;用笔圈定组织范围,圆形直径5~10 mm;滴加4%多聚甲醛100 μL于圆圈内,室温下放置5 min,4 ℃下放置10 min;甩掉多聚甲醛,放于摇床上。使用磷酸盐缓冲溶液(PBS∶Tween=1 000∶1)洗涤3次,每次5 min;晾干薄片,滴加5%BSA 100 μL于圆圈内,室温下封闭40 min;甩掉BSA,滴加α-actin一抗(一抗∶5%BSA=1∶100 ),放于4 ℃冰箱内孵育过夜;按照相同方法洗涤3次,晾干玻片,然后滴加CD68一抗(一抗∶5%BSA=1∶100 ), 放于4 ℃冰箱内孵育过夜;照前法洗涤3次,晾干玻片,滴加二抗(二抗∶5%BSA=1∶200),室温下避光孵育1 h;再避光条件下洗涤3次,滴加DAPI防猝灭剂,盖上盖玻片,防止气泡残留。用荧光显微镜观察玻片组织的荧光染色情况。
1.4.4颈动脉斑块组织中NLRP3、Caspase-1 mRNA表达情况 采用RT-PCR法检测:Trizol法提取斑块组织的RNA,反转录成cDNA。运用TRIzol提取单核细胞和粥样硬化斑块组织中的总RNA,通过Primer Express software设计NLRP3、Caspase-1、NLRP1引物,以β-actin作为对照。扩增条件:50 ℃,2 min;95 ℃,10 min;95 ℃,30 s;60 ℃,30 s;40个循环。由Primer 5.0设计引物,引物从Gene Bank获得,合成由北京擎科新业生物技术有限公司负责。引物序列:GAPDH正向5’-GCTAAGAAGGACCAGCCAGA-3’,反向5’-CCAGCAAACCTATCCACTCC-3’;Caspase-1正向5’-TGGAAGGTAGGCAAGACT-3’,反向5’-ATAGTGGGCATcTGGGTC-3’;NLRP3正向5’-GCTAAGAAGGACCAGCCAGA-3’,反向5’-CCAGCAAACCTATCCACTCC-3’。计算机计算出CT值,以2-△△CT分析最终数据。
1.4.5颈动脉斑块组织中NLRP3、Caspase-1蛋白表达情况 采用Western blot法检测:裂解少量组织块,匀浆机匀浆,取上清,采用BCA法检测蛋白浓度,每泳道40 μg蛋白上样,通过SDS-PAGE电泳后,电转膜到PVDF膜,依次加入GADPH(1∶1 000)一抗、兔多抗NLRP3(1∶1000)及Caspase-1(1∶800),4 ℃孵育过夜。TBST缓冲液充分洗涤PVDF膜,5 min/次,洗涤5~6次。用封闭液1∶50 000稀释相应的HRP标记二抗,浸泡PVDF膜于二抗孵育液中,37 ℃下摇床孵育2 h。再次TBST缓冲液充分洗涤PVDF膜,5 min/次,洗涤5~6次。显色曝光后,采用BandScan 5.0分析胶片灰度值。

2 结 果
2.1各组小鼠血清IL-1β及IL-18水平比较不稳定斑块组血清IL-1β及IL-18水平均明显高于对照组(P均<0.05);益气组、活血组、复方组血清IL-1β及IL-18水平均明显低于不稳定斑块组(P均<0.05),且复方组均明显低于益气组、活血组(P均<0.05),益气组与活血组比较差异均无统计学意义(P均>0.05)。见图1。
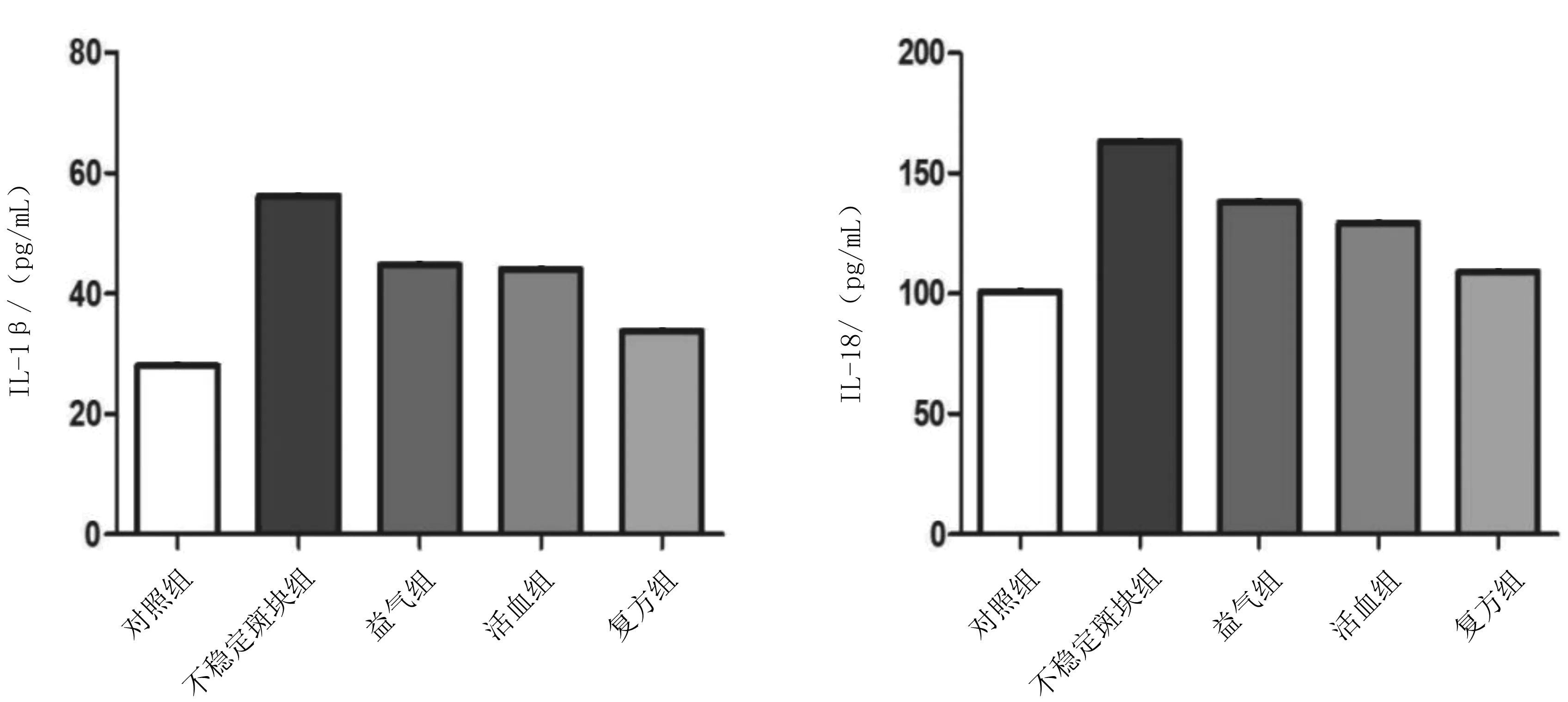
图1 对照组和颈动脉不稳定斑块各组小鼠血清IL-1β及IL-18水平
2.2各组小鼠颈动脉HE染色情况 对照组小鼠颈动脉壁光滑,无斑块;不稳定斑块组小鼠颈动脉管腔内存在大量斑块沉积,斑块内部脂质池较大,斑块结构较不稳定;与不稳定斑块组比较,益气组、活血组、复方组小鼠斑块内部脂质池缩小,斑块的结构趋于稳定,其中复方组病变最轻。见图2。
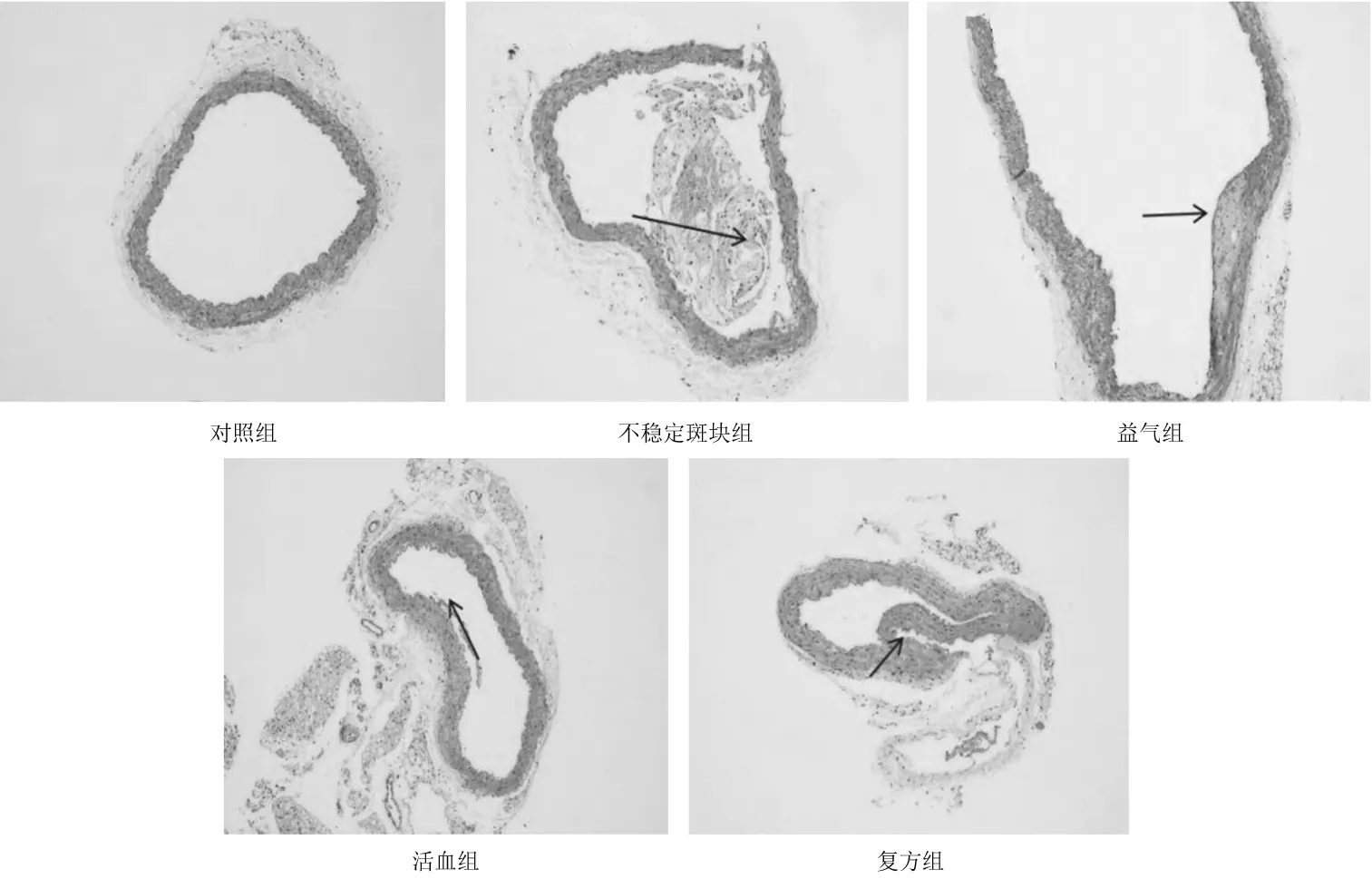
图2 对照组和颈动脉不稳定斑块各组小鼠颈动脉HE染色表现(×100)
2.3各组小鼠颈动脉组织中CD68、α-actin免疫荧光染色表现 对照组平滑肌细胞(红色)较多,巨噬细胞(绿色)非常少;不稳定斑块组巨噬细胞明显增多,平滑肌细胞显著减少;益气组、活血组、复方组巨噬细胞较不稳定斑块组明显减少,平滑肌细胞较不稳定斑块组增多,且复方组与益气组、活血组比较巨噬细胞少,平滑肌细胞多。见图3。

图3 对照组和颈动脉不稳定斑块各组小鼠CD68、α-actin免疫荧光染色情况
2.4各组小鼠颈动脉斑块组织中NLRP3、Caspase-1 mRNA表达情况 不稳定斑块组斑块组织中NLRP3、Caspase-1 mRNA相对表达量均明显高于对照组(P均<0.05);益气组、活血组、复方组斑块组织中NLRP3、Caspase-1 mRNA相对表达量均明显低于不稳定斑块组(P均<0.05),且复方组均明显低于益气组、活血组(P均<0.05),益气组与活血组比较差异均无统计学意义(P均>0.05)。见图4。
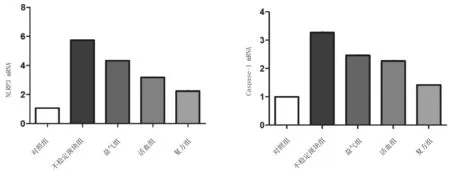
图4 对照组和颈动脉不稳定斑块各组小鼠斑块组织中NLRP3、Caspase-1 mRNA表达情况
2.5各组小鼠颈动脉斑块组织中NLRP3、Caspase-1蛋白表达情况 不稳定斑块组斑块组织中NLRP3、Caspase-1 蛋白相对表达量均明显高于对照组(P均<0.05);益气组、活血组、复方组斑块组织中NLRP3、Caspase-1蛋白相对表达量均明显低于不稳定斑块组(P均<0.05),且复方组均明显低于益气组、活血组(P均<0.05),益气组与活血组比较差异均无统计学意义(P均>0.05)。见图5。
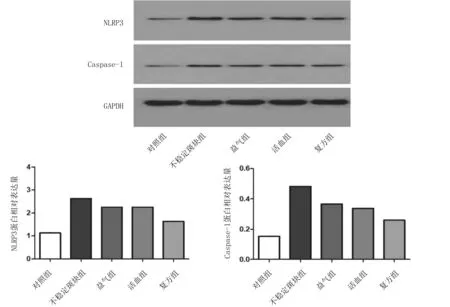
图5 对照组和颈动脉不稳定斑块各组小鼠斑块组织中NLRP3、Caspase-1蛋白表达情况
3 讨 论
目前研究表明,易损斑块的形成与破裂是ACS发病的关键病理基础[2],而脂质的代谢障碍、内皮细胞的损伤、炎症反应的发生在易损斑块的发生、发展过程中起着十分重要的作用。炎症是先天免疫系统应对不利刺激作出的一种防御性反应,机体在遭受到外源性感染或在内源性细胞组织损伤的情况下均会发生炎症反应[10-11]。组织损伤和稳态参数的改变均能诱导先天性免疫细胞激活并释放危险信号,释放出来的危险信号为危险相关分子模式(DAMPs),机体的防御系统须通过模式识别受体(PRRs)识别出DAMPs后才会被启动,然后再进一步激活炎症通路而引发炎症反应,炎性小体即是其中的一种PRRs[12-13]。NLRPS炎性小体活化需要2个信号,信号1是由PRRs(如TLRS)识别刺激信号,活化核因子κB(NF-κB)途径增加IL-1β和IL-18前体的合成[7];信号2是刺激信号激活NLRP3炎性小体,活化Caspase-1,剪切IL-1β和IL-18 前体,释放成熟的IL-1β和IL-18 参与炎症反应[14]。各种炎性因子的活化、NLRP3 炎性小体的激活可引起炎症细胞的募集,炎症反应发生,导致动脉粥样硬化斑块的形成[15-16]。
“冠心病”归属于中医学“胸痹”“心痛”的范畴,为本虚标实之证,本虚多为气虚,标实则多为血瘀,因此益气活血法是本病的基本治则之一[17]。
本实验观察了益气中药、活血中药与中药复方芪丹通脉片干预模型小鼠易损斑块的形成与发展及对NLRP3炎症小体的影响,结果显示不稳定斑块组大量斑块沉积且斑块最不稳定,吞噬细胞明显增多,平滑肌细胞显著减少,血清IL-1β、IL-18水平及斑块组织中NLRP3、Caspase-1 mRNA和蛋白相对表达量均明显增高;各药物组斑块结构趋于稳定,巨噬细胞明显减少,平滑肌细胞增多,血清IL-1β、IL-18水平及斑块组织中NLRP3、Caspase-1 mRNA和蛋白相对表达量均明显降低,其中复方组改变最明显。说明益气活血中药可以下调NLRP3、Caspase-1的表达,抑制NLRP3介导的炎症反应,从而减少不稳定斑块的形成,且芪丹通脉片的作用优于单纯活血或益气中药。
综上所述,炎症反应会促进易损斑块的形成与破裂,而NLRP3炎症小体激活会触发炎症反应,加速易损斑块的形成与破裂;芪丹通脉片可以通过抑制NLRP3炎症小体的激活,下调IL-1β、IL-18及Caspase-1表达而抑制炎症反应的发生,起到稳定斑块的作用。但由于机体发生炎症反应的机制复杂多样,中药干预炎症反应发生的各种机制之间是否存在相互作用,存在怎样的相互作用还需后期进一步实验验证。
利益冲突:所有作者均声明不存在利益冲突。

