正交法优化黄芩愈伤组织诱导条件
王玉芬,姚东作,马海会,牛颜冰,王德富
(山西农业大学 生命科学学院,山西 太谷 030801)
黄芩(Scutellaria baicalensisGeorgi)为唇形科(Lamiaceae)黄 芩 属(Scutellaria)多 年 生 草 本 植物[1],以干燥根入药,已有数千年的历史。其化学成分有黄酮类、挥发油、萜类和多糖等,主要活性成分为黄酮类化合物,包括黄芩素、黄芩苷、汉黄芩素、含黄芩苷、野黄芩素和野黄芩苷[2-3]。现代药理学实验表明,黄芩有抗炎、抑菌、抗氧化、抗肿瘤、抗癌、保护脑组织、心脑血管和保肝等作用[4-5],在临床上多与其他药物联合使用。近年来,黄芩市场需求量大幅增长,野生资源极度匮乏,不能满足市场需求,而人工栽培黄芩受遗传和环境因素影响,其种质差异较大,农药残留,连作障碍,药效成分含量偏低及其不稳定性已成为黄芩栽培过程中的最大问题[6]。
植物组织培养技术是一种很好的替代途径,自1902年HABERLANDTZ提出细胞全能性学说以来,组织培养得到了迅速发展,技术也日趋完善[7]。通过组织培养技术可以消除由遗传差异带来的影响,同时具备生长周期短、代谢产物的生产条件可调控、没有外界环境条件限制等优势,已成为诸多药用植物获取天然药用成分的途径之一。高山林等[8]研究发现,黄芩节间是诱导愈伤的最佳外植体,其次是节和叶片。齐香君等[9]以黄芩带节茎段为外植体进行愈伤组织诱导,发现黑暗处理下愈伤组织颜色呈淡黄色,褐化率低,生长良好。吴晓玲等[10]以黄芩的子叶、真叶和下胚轴为材料诱导黄芩愈伤组织,发现真叶为最佳外植体,MS+0.5 mg/L 2,4-D+1 mg/L 6-BA+0.5 mg/L NAA为最优培养基。万贵香等[11]探究不同浓度外源激素的添加对黄芩愈伤组织中有效成分的影响,发现单独添加2,4-D会影响黄芩愈伤组织的生长,且会加重褐化程度。
目前,关于黄芩愈伤组织的诱导已有诸多报道,但大部分研究多采用的激素组合为6-BA和NAA,外植体也多选择为茎段[12-13]。为进一步探究2,4-D单独或与其他激素组合使用在黄芩愈伤组织诱导中的作用及对根、茎段和叶片的诱导情况,本试验以黄芩根、茎段和叶片为材料,设立6-BA、NAA和2,4-D等3种激素不同浓度单因素及正交试验处理,探究6-BA、NAA和2,4-D单独或复配对黄芩愈伤组织诱导和生长的影响,进而筛选出适合黄芩愈伤组织诱导的最佳培养基配方,旨在为黄芩等其他药用植物愈伤组织诱导和优化体系的建立提供一定经验借鉴。
1 材料和方法
1.1 试验材料
选择生长4周龄、长势良好的黄芩组培苗,取黄芩叶片(约0.5 cm2)、茎段(约1 cm)和根部(约1 cm)为外植体。
1.2 试验方法
1.2.1 单因素试验设计 将处理好的黄芩外植体(叶片、茎段和根)分别接种于添加不同质量浓度6-BA(0、0.5、1.0、1.5、2.0 mg/L)、NAA(0、0.5、1.0、1.5、2.0 mg/L)和2,4-D(0、0.05、0.1、0.3、0.5、1.0、1.5、2.0 mg/L)的MS固体培养基上,每个处理10皿,每皿接种5个外植体,3次重复。随时观察其生长状况,14 d后,统计愈伤组织诱导率并分析其生长状态。
1.2.2 6-BA和NAA双因素试验设计 在单因素试验基础上,确定6-BA、NAA两激素的作用浓度范围以及诱导黄芩外植体形成愈伤组织的最佳浓度,其因素水平如表1所示,共9个处理。以MS培养基为基本培养基,每个处理10皿,每皿接种6个外植体,3次重复。随时观察其生长状况,28 d后统计其愈伤组织诱导率及生长情况。

表1 6-BA和NAA试验设计Tab.1 6-BA and NAA experimental design
1.2.3 正交试验设计 在单因素试验基础上,以6-BA、NAA和2,4-D为 条 件 进 行3因 素3水 平L9(33)正交试验(表2),考察黄芩外植体在不同条件下的诱导情况,明确6-BA、NAA和2,4-D的不同水平对黄芩外植体(诱导率高的外植体)诱导的影响,筛选诱导黄芩外植体形成愈伤组织的最优条件。以MS培养基为基本培养基,每个处理10皿,每皿接种5个外植体,3次重复。随时观察其生长状况,28 d后统计黄芩愈伤组织诱导率及生长情况。
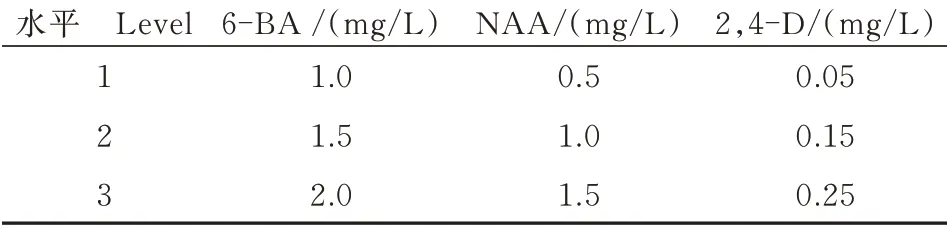
表2 正交试验设计Tab.2 Orthogonal design
1.3 数据分析
所得试验数据均用SPSS 21.0软件处理,采用极差和方差分析各因素对正交试验结果是否有统计学意义。
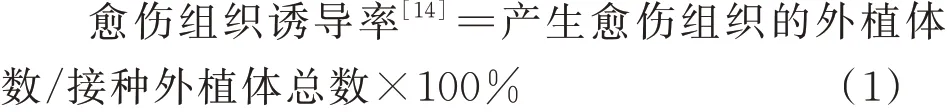
2 结果与分析
2.1 6-BA、NAA、2,4-D愈伤组织诱导的单因素试验结果
在激素6-BA处理下(图1-A),有且只有茎段在质量浓度为1.0、1.5、2.0 mg/L时可诱导出愈伤组织,诱导率分别为67.3%、87.3%和36.0%。在激素NAA处理下(图1-B),茎段均可诱导产生愈伤组织,诱导率分别为34.7%、63.7%、71.3%和72.0%;叶在低质量浓度(0.5、1.0 mg/L)下可诱导,诱导率分别为3.3%和4.9%,根仍无诱导发生。在激素2,4-D处理下(图1-C),根、茎段和叶片均可诱导产生愈伤组织,其中茎段诱导率显著高于根和叶片,均高于90%;在0.1 mg/L时,茎段有最大诱导率,可达98.3%。

图1 6-BA、NAA和2,4-D不同浓度对黄芩根、茎和叶的诱导率Fig.1 Induction rate of different concentrations of 6-BA,NAA,and 2,4-D on the roots,stems,and leaves of Scutellaria baicalensis
在激素6-BA处理下,黄芩愈伤组织呈淡黄色至黄棕色,并伴随长根和出芽现象。在NAA处理下,愈伤组织为淡黄色,黏性,分化程度较低,但在2.0 mg/L时已有褐化趋势,结构致密,为黄褐色,故此浓度不适合进行诱导。在2,4-D处理下,低浓度下愈伤组织为乳白色,结构致密,质地较硬;随浓度增加,颜色逐步加深,质地逐步变软,水渍化程度加深;在激素浓度为2.0 mg/L时,褐化程度最严重,呈灰褐色。综上,结合愈伤组织诱导率及其生长状态,选用茎段为外植体,以1.0、1.5、2.0 mg/L的6-BA;0.5、1.0、1.5 mg/L的NAA和0.05、0.15、0.25 mg/L的2,4-D进行双因素和正交试验。
2.2 6-BA和NAA愈伤组织诱导的双因素试验结果
6-BA和NAA组合愈伤组织诱导的双因素试验结果如表3所示。
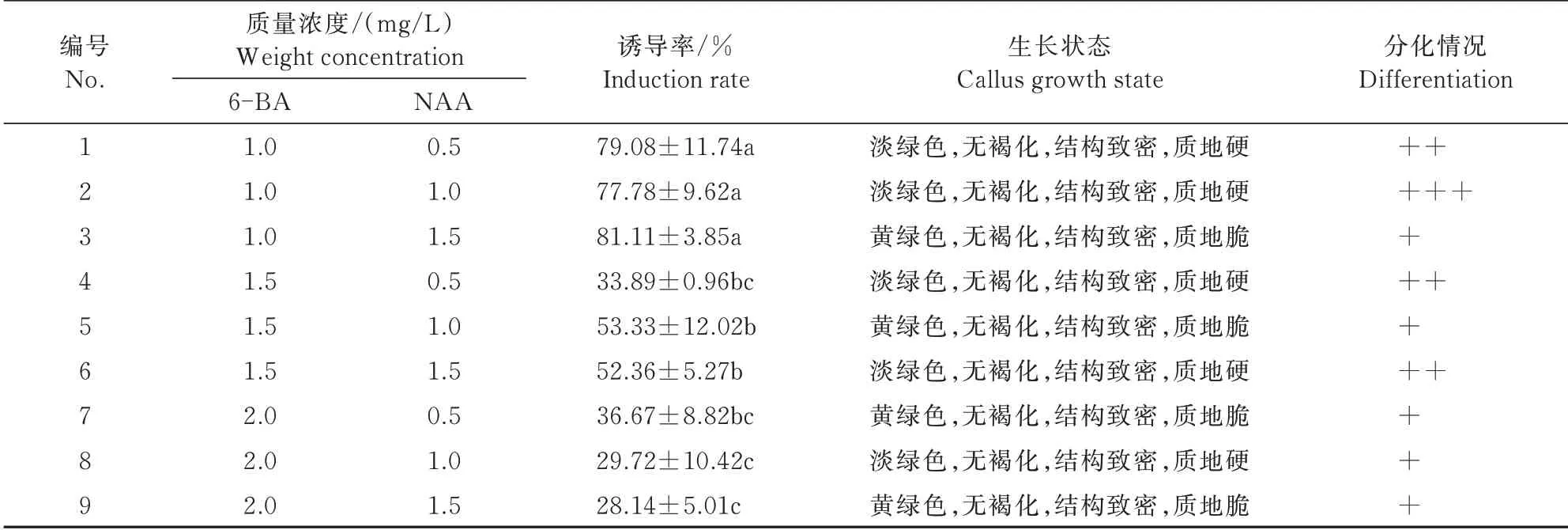
表3 6-BA和NAA组合试验结果Tab.3 6-BA and NAA combination test results
在单因素试验基础上,以黄芩茎段为材料,不同质量浓度的6-BA(1.0、1.5、2.0 mg/L)和NAA(0.5、1.0、1.5 mg/L)进行双因素试验,共9个处理(表3)。9个不同处理均能诱导产生黄芩愈伤组织,且颜色为淡绿色或黄绿色,结构紧密,质地较硬,但伴随有不同程度分化现象(图2)。当6-BA质量浓度为1.0 mg/L时,黄芩愈伤组织诱导率相对较高;NAA质量浓度为1.0 mg/mL时,黄芩愈伤组织分化程度较高,芽增殖系数大,NAA质量浓度为1.5 mg/mL时,愈伤组织诱导率最高,为81.11%。虽然9个处理均能诱导黄芩茎段形成愈伤组织,但都表现出不同程度的分化长芽现象,不适合进行继代培养。因此,6-BA和NAA在此质量浓度范围内均不适合进行黄芩愈伤组织诱导,但可用于黄芩无菌苗继代过程中芽的增殖,培养基选择为MS+1.0 mg/L 6-BA+1.0 mg/L NAA或MS+1.0 mg/L 6-BA+1.5 mg/L NAA。

图2 6-BA和NAA激素组合对黄芩茎段的诱导情况Fig.2 Induction of 6-BA and NAA hormone combination on the stem segments of Scutellaria baicalensis
2.3 正交试验结果与分析
在单因素试验的基础上,确定外植体为茎段,同时以6-BA(1.0、1.5、2.0 mg/L)、NAA(0.5、1.0、1.5 mg/L)和2,4-D(0.05、0.15、0.25 mg/L)为条件,设计3因素3水平的正交试验,共9组,正交试验结果如表4所示,9个处理均能成功诱导出愈伤组织,其中MS+1.0 mg/L 6-BA+1.0 mg/L NAA+0.25 mg/L 2,4-D的愈伤诱导率最高,为94.16%。由极差R分析可知,6-BA对黄芩茎段诱导愈伤组织的影响最大且差异显著(P<0.05,表5),2,4-D次之,NAA影响最小,后二者差异不显著。由均值K值分析可知,6-BA的K值大小为K1>K2>K3,说明随着6-BA质量浓度的增加,黄芩愈伤组织诱导率逐步降低,激素最佳作用质量浓度为1.0 mg/L;NAA的K值大小为K2>K1>K3,说明随着NAA质量浓度的增加,黄芩愈伤组织的诱导率呈先升高后降低的趋势,最佳作用质量浓度为1.0 mg/L;2,4-D的K值大小为K2>K3>K1,说明随着2,4-D质量浓度的增加,黄芩茎段愈伤组织的诱导率呈先升高后降低的趋势,激素最佳作用质量浓度为0.15 mg/L。故以茎段为外植体,理论最佳试验处理条件为MS+1.0 mg/L 6-BA+1.0 mg/L NAA+0.15 mg/L 2,4-D,而在本试验中,实际得到的最佳试验组合为MS+1.0 mg/L 6-BA+1.0 mg/L NAA+0.25 mg/L 2,4-D,激素2,4-D浓度稍有不同。此外,由图3可知,除7、8号培养基(图3-7、8)诱导的愈伤组织发生褐化、颜色呈黄棕色外,其他处理诱导的愈伤组织均生长良好,且颜色呈淡黄色或黄绿色,结构较疏松,无明显分化现象,可用于继代培养。

图3 6-BA、NAA和2,4-D激素组合对黄芩茎段的诱导情况Fig.3 Induction of 6-BA,NAA and 2,4-D hormone combination on the stem segments of Scutellaria baicalensis
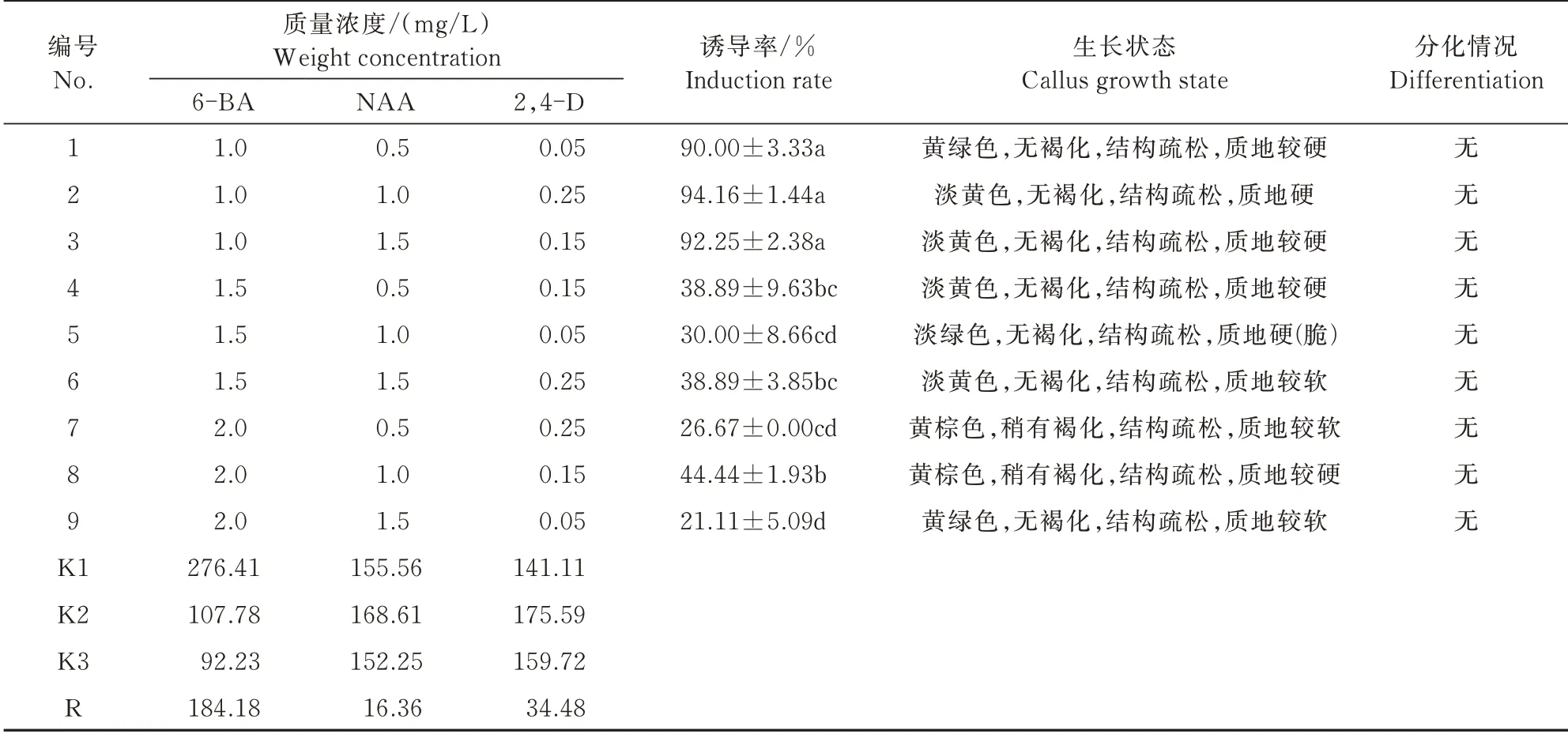
表4 正交试验结果分析Tab.4 Orthogonal test analysis
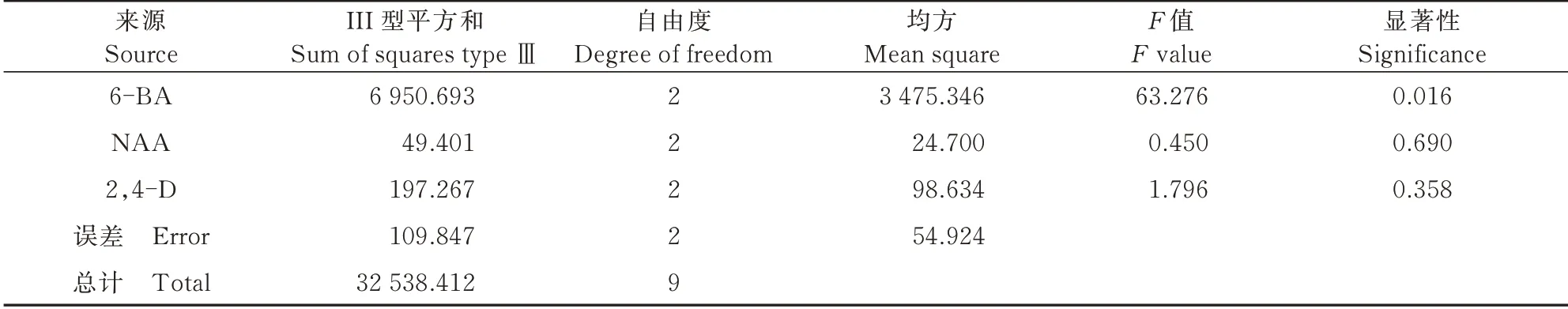
表5 方差分析Tab.5 Variance analysis
3 结论与讨论
自1958年第1例植物离体培养成功以来,植物组织培养技术飞速发展,药用植物组织培养也随之发展。影响植物组织培养的因素有很多,包括培养基中大量元素(C、N、P和K源)和微量元素、外植体、植物激素和培养条件(温度、光照和湿度等)等[15-16]。相关研究表明,6-BA的添加会提高多酚氧化酶(Polyphenol oxidase,PPO)的活性,而黄芩苷作为黄芩的主要活性成分,其结构上存在多个酚羟基,极易被POD氧化,从而导致愈伤组织发生褐化现象,影响其生长[17-18]。本试验发现,黄芩愈伤组织随着6-BA质量浓度增加,其褐化现象会愈发严重,生长停滞,与前人研究结果一致。生长素类激素,如IAA(吲哚乙酸)、IBA(吲哚丁酸)和NAA在植物组织培养中多用于诱导植物产生不定根[19]。本研究也得到类似的结果,3种外植体在NAA作用下均可发生不同程度的生根现象,且外植体稍有膨大,原因可能是由于NAA刺激了愈伤相关基因的表达。在2,4-D诱导黄芩愈伤组织试验中,发现低浓度下愈伤组织呈乳白色,而高浓度下愈伤组织呈黄褐色,褐化严重,说明低浓度2,4-D适合诱导愈伤组织,高浓度2,4-D则抑制生长,这与武羿君等[20]的研究结果一致,高浓度下细胞分裂速度快,生长不均衡,易褐化死亡。
在植物愈伤组织培养中,不同浓度和类型的激素组合对愈伤组织的诱导情况均有差异。在本研究中,6-BA和NAA诱导的愈伤组织呈淡绿色,结构致密,发生分化,这与孟书亦[13]、罗毓健[21]研究结果不同。本研究前期愈伤组织表现为整体膨大,呈淡绿色,无分化现象,而20 d之后,绿色芽点开始出现,产生分化,可能是由环境和内外源激素共同影响所致。在正交试验中,黄芩愈伤组织呈淡黄色,生长良好,增殖迅速,无分化现象。方差分析表明,2,4-D对诱导黄芩愈伤组织的产生无显著影响,但结合双因素结果可知,添加2,4-D能显著提高黄芩愈伤组织的诱导率,且极大降低分化程度,故认为添加低质量浓度的2,4-D对黄芩愈伤组织的诱导作用明显。2.0 mg/L 6-BA处理发生明显褐化,推测应当是较高浓度6-BA和2,4-D共同作用从而提高多酚氧化酶活性,导致生长不均衡,发生褐化现象。
关于黄芩愈伤组织褐化问题,也是植物组织培养的普遍问题,已有诸多研究。一方面可以调节外源激素的种类和浓度,另一方面也可通过添加微量Vc(抗坏血酸)、CA(柠檬酸)、AC(活性炭)、PVP(聚乙烯吡咯烷酮)和活性炭来减缓[22-23],但不同抗褐变剂对不同植物材料作用效果有所差异。目前,黄芩愈伤组织的诱导体系已初步建立,但激素之间的相互作用机制还尚未可知,科学界已对某些植物的诱导机制进行了揭示,如拟南芥愈伤组织的中层细胞具有干细胞特征,其属性由特征转录因子WOX5/7维 持,WOX5/7通过与PLT和ARR12蛋白结合调控内源生长素或细胞分裂素的产生,进而调控愈伤组织的进一步分化和器官再生[24-25]。但关于黄芩愈伤组织是如何通过植物激素调控其状态及分化还需进一步研究。
本试验以黄芩根、茎段和叶片为材料进行黄芩愈伤组织诱导试验,结果表明,诱导黄芩愈伤组织的最适外植体依次为茎段>根>叶片,适合分化长芽的培养基为MS+1.0 mg/L 6-BA+1.0 mg/L NAA,适合诱导愈伤组织的培养基为MS+1.0 mg/L 6-BA+1.0 mg/L NAA+0.25 mg/L 2,4-D。结果可为后续利用黄芩愈伤组织进行大规模培养和活性成分的直接生产奠定基础。

