上调miR-138-5p对舌鳞状细胞癌细胞增殖及上皮间质转化的影响
杨晋,张娟,高杰,马素伟,王焱,靳昊
(保定市第二中心医院口腔科,河北 保定 072750)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是头颈部最常见的恶性肿瘤,转移性和复发率高,预后差[1]。化疗、放疗和手术治疗均会产生一定的副作用,因此寻找新的治疗TSCC的靶向分子指标已成为当下研究的热点。微小RNA(microRNA,miRNA)可通过靶向调控其目的基因的表达,影响多种细胞功能。其中,miR-138-5p可通过直接靶向RHBDD1基因抑制乳腺癌细胞迁移、侵袭和上皮间质转化(epithelial mesenchymal transition,EMT)[2],通过靶向ZEB2基因抑制肺腺癌细胞EMT、生长和转移[3],且miR-138在口腔鳞状细胞癌中下调[4]。而组蛋白甲基化转移酶(enhancer of zeste homolog 2,EZH2)是细胞增殖、细胞周期、癌细胞转移、肿瘤发生等多种生物进程的表观遗传调控因子[5],敲低EZH2表达可抑制TSCC细胞侵袭迁移能力[6]。但是,目前miR-138-5p和EZH2在TSCC中的相互作用机制尚未见报道,因此,本研究通过上调miR-138-5p表达,观察其对TSCC细胞Tca-8113增殖、凋亡、EMT进程及EZH2蛋白表达的影响,并探讨其潜在的作用机制。
1 材料
1.1 细胞株
永生化的舌上皮株Hacta细胞和舌鳞癌细胞株Tca-8113均购自中国科学院典型培养物保存委员会细胞库。
1.2 主要试剂及仪器
野生型和突变型EZH2 3'UTR荧光素酶报告基因载体(EZH2 WT、EZH2 MUT);miR-138-5p NC(miR-138-5p阴性对照)、miR-138-5p模拟物(miR-138-5p mimics)、si-EZH2(EZH2小干扰RNA)、si-NC(EZH2小干扰RNA阴性对照)、pcDNA NC(过表达EZH2阴性对照质粒)、pcDNA EZH2(过表达EZH2重组质粒)以及miR-138-5p、EZH2、U6和β-actin引物均由上海生工生物工程有限公司合成;Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;β-联蛋白(β-catenin)、上皮钙黏素(E-cadherin)、神经钙黏素(N-cadherin)和波形蛋白(vimentin)鼠抗和辣根过氧化物酶标记羊抗鼠IgG二抗均购自美国Abcam公司;尼康SMZ745光学显微镜购自上海普赫生物科技有限公司;FACSCanto流式细胞仪购自美国Beckman公司;全能型凝胶成像分析系统ChemiDoc-MP购自山东三瑞科技有限公司。
2 方法
2.1 细胞培养与分组
Hacta和Tca-8113细胞使用含10%(φ)胎牛血清的DMEM/F12培养基,置于37℃,5%(φ)CO2培养箱中培养。
本研究共分为以下几组:Hacta组(永生化的舌上皮细胞株)、Tca-8113组(未转染Tca-8113细胞)、miR-138-5p NC组(Tca-8113细胞转染miR-138-5p NC)、miR-138-5p mimics组(Tca-8113细 胞 转 染miR-138-5p mimics)、si-NC组(Tca-8113细 胞转si-NC)、si-EZH2组(Tca-8113细胞转染si-EZH2)、miR-138-5p mimics+pcDNA NC组(Tca-8113细胞共转染转miR-138-5p mimics和pcDNA NC)、miR-138-5p mimics+pcDNA EZH2组(Tca-8113细胞共转染miR-138-5p mimics和pcDNA EZH2);取生长密度 达50%~60%的Tca-8113细 胞,使 用Lipofectamine 2000转染试剂盒进行转染后,培养24 h。
2.2 qRT-PCR检测细胞中miR-138-5p和EZH2 mRNA表达水平
采用RNA抽提试剂盒提取细胞总RNA,逆转录试剂盒得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒说明书配置PCR反应体系:2×SYBR mix 10 μL,H2O 8 μL,上下游引物各0.5 μL,10×cDNA模板1 μL。反应条件设定为:95℃预变性5 min、95℃变性15 s、60℃退火50 s、40个循环、72℃延伸10 min。分别以β-actin、U6作为内参,根据2-ΔΔCt算法,计算EZH2 mRNA、miR-138-5p表达水平。miR-138-5p、EZH2、U6及β-actin引物序列见表1。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequence
2.3 生物信息学预测和双荧光素酶验证miR-138-5p和EZH2的靶向关系
采 用TargetScan在 线 网 站(http://www.targetscan.org/mmu_72/)对miR-138-5p作用的靶基因进行预测,发现EZH2为其可能的靶分子。取对数生长期的Tca-8113细胞接种于96孔板,常规培养24 h后,将细胞分为miR-138-5p mimics+EZH2 WT组、miR-138-5p NC+EZH2 WT组、miR-138-5p mimics+EZH2 MUT组和miR-138-5p NC+EZH2 MUT组,每组设6个复孔,使用Lipofectamine 2000转染试剂盒进行细胞共转染。转染48 h后,使用双荧光素酶检测试剂盒检测荧光素酶活性,验证miR-138-5p与EZH2的靶向关系。
2.4 CCK-8法检测细胞增殖活性
收集培养24 h后各组细胞,每组设置6个复孔,以8×103/mL接种至96孔板,各加10 μL CCK-8溶液避光孵育2 h,采用酶标仪检测各孔450 nm处吸光度(A)值。A值越大表明其增殖活性越高。
2.5 流式细胞术检测细胞凋亡率
收集培养24 h后各组细胞,1 200 r/min离心5 min,弃上清,用PBS洗涤2次后,加入400 μL结合缓冲液悬浮细胞,再加入5 μL Annexin V染液,轻轻混匀后置于2~8℃避光条件下孵育15 min;然后加入10 μL PI轻轻混匀,于2~8℃避光下继续孵育5 min后,上流式细胞仪检测细胞凋亡率。
2.6 Transwell小室法检测各组细胞迁移和侵袭能力
迁移能力检测:取各组细胞,用不含FBS的DMEM/F12培养基,制成细胞悬液,调整细胞浓度为1×108个/mL,按照Transwell小室试剂盒说明书进行操作,光学显微镜下观察并计数穿过微孔膜的细胞。侵袭能力检测:取Matrigel胶铺于Transwell小室的上室,其余步骤同细胞迁移能力检测实验。
2.7 Western blot检测各组细胞EMT相关蛋白βcatenin、E-cadherin、N-cadherin和vimentin表达水平
收集培养24 h后各组细胞,提取总蛋白,对蛋白进行定量。然后进行SDS-聚丙烯酰胺凝胶电泳、转PVDF膜、5%脱脂奶粉封闭1 h、1∶2 000浓度稀释后的β-catenin、E-cadherin、N-cadherin、vimentin、GAPDH鼠抗4℃过夜孵育、含辣根过氧化物酶标记的二抗室温孵育2 h,用ECL显色试剂盒显色,全能型凝胶成像分析系统拍照,以GAPDH为内参,分析各组蛋白表达水平。
2.8 统计学分析
采用SPSS 22.0软件进行统计分析,计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用snk-q检验,P<0.05为差异有统计学意义。
3 结果
3.1 Hacta和Tca-8113细胞中miR-138-5p、EZH2表达水平比较
与Hacta组相比,Tca-8113组细胞miR-138-5p表达水平显著降低,EZH2 mRNA和蛋白表达水平显著升高(P<0.05)。见图1。
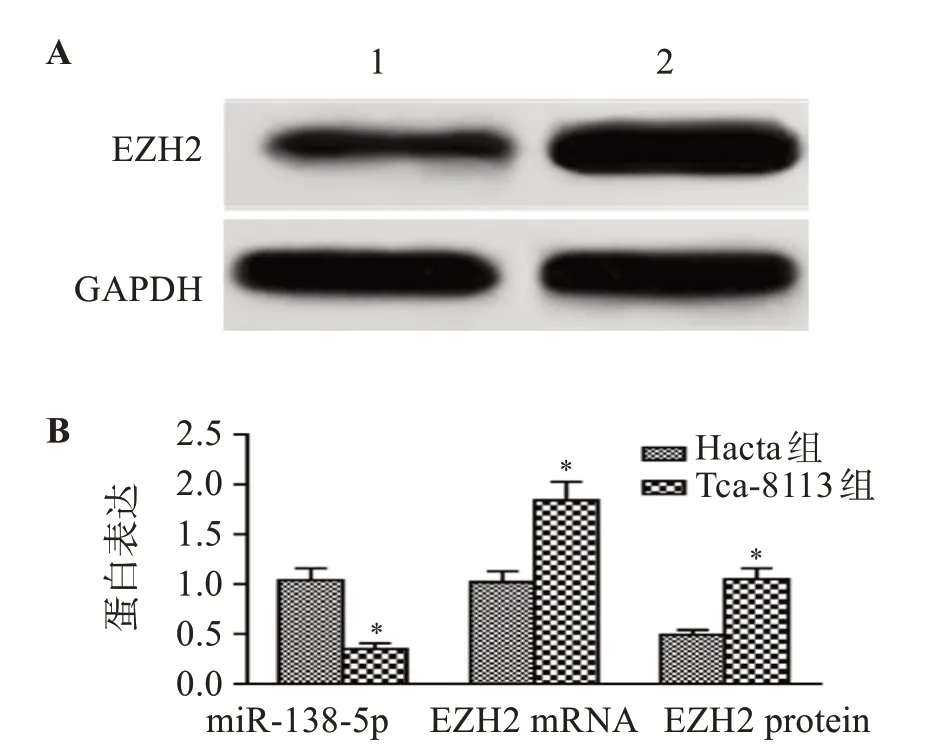
图1 Hacta和Tca-8113细胞中miR-138-5p、EZH2 mRNA和蛋白表达水平Figure 1 Expression of miR-138-5p,EZH2 mRNA and protein in Hacta and Tca-8113 cells
3.2 上调miR-138-5p对Tca-8113细胞EZH2 mRNA和蛋白表达的影响
与Tca-8113组和miR-138-5p NC组相比,miR-138-5p mimics组Tca-8113细胞miR-138-5p表达水平显著升高(P<0.05),EZH2 mRNA和蛋白表达水平显著降低(P<0.05)。见图2。
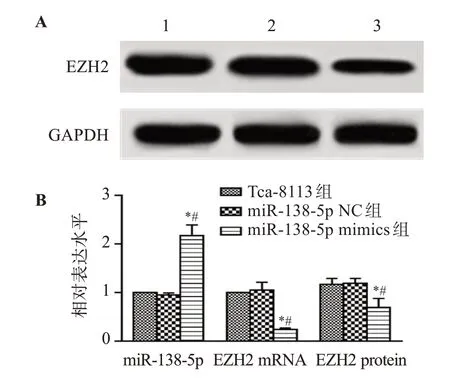
图2 上调miR-138-5p对Tca-8113细胞miR-138-5p和EZH2表达水平的影响Figure 2 Effect of upregulation of miR-138-5p on miR-138-5p and EZH2 expression in Tca-8113 cells
3.3 上调miR-138-5p对Tca-8113细胞增殖、凋亡的影响
与Tca-8113组和miR-138-5p NC组相比,miR-138-5p mimics组Tca-8113细胞增殖活性显著降低(P<0.05),凋亡率显著升高(P<0.05)。见图3。

图3 上调miR-138-5p对Tca-8113细胞增殖、凋亡的影响Figure 3 Effect of upregulation of miR-138-5p on proliferation and apoptosis of Tca-8113 cells
3.4 上调miR-138-5p对Tca-8113细胞侵袭迁移能力的影响
与Tca-8113组和miR-138-5p NC组相比,miR-138-5p mimics组Tca-8113细胞迁移和侵袭能力显著降低(P<0.05)。见图4。
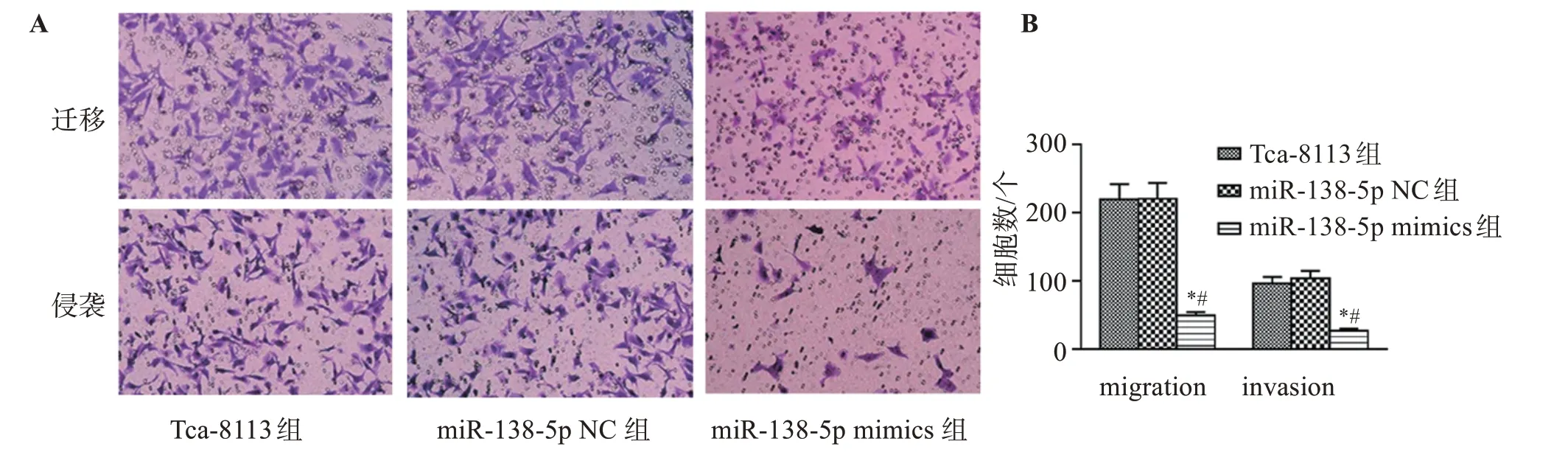
图4 上调miR-138-5p对Tca-8113细胞侵袭迁移能力的影响Figure 4 Effect of upregulation of miR-138-5p on invasion and migration of Tca-8113 cells
3.5 上调miR-138-5p对Tca-8113细胞EMT进程的影响
与Tca-8113组和miR-138-5p NC组相比,miR-138-5p mimics组Tca-8113细胞β-catenin和E-cadherin表达水平显著升高(P<0.05),N-cadherin和vimentin表达水平显著降低(P<0.05)。见图5。
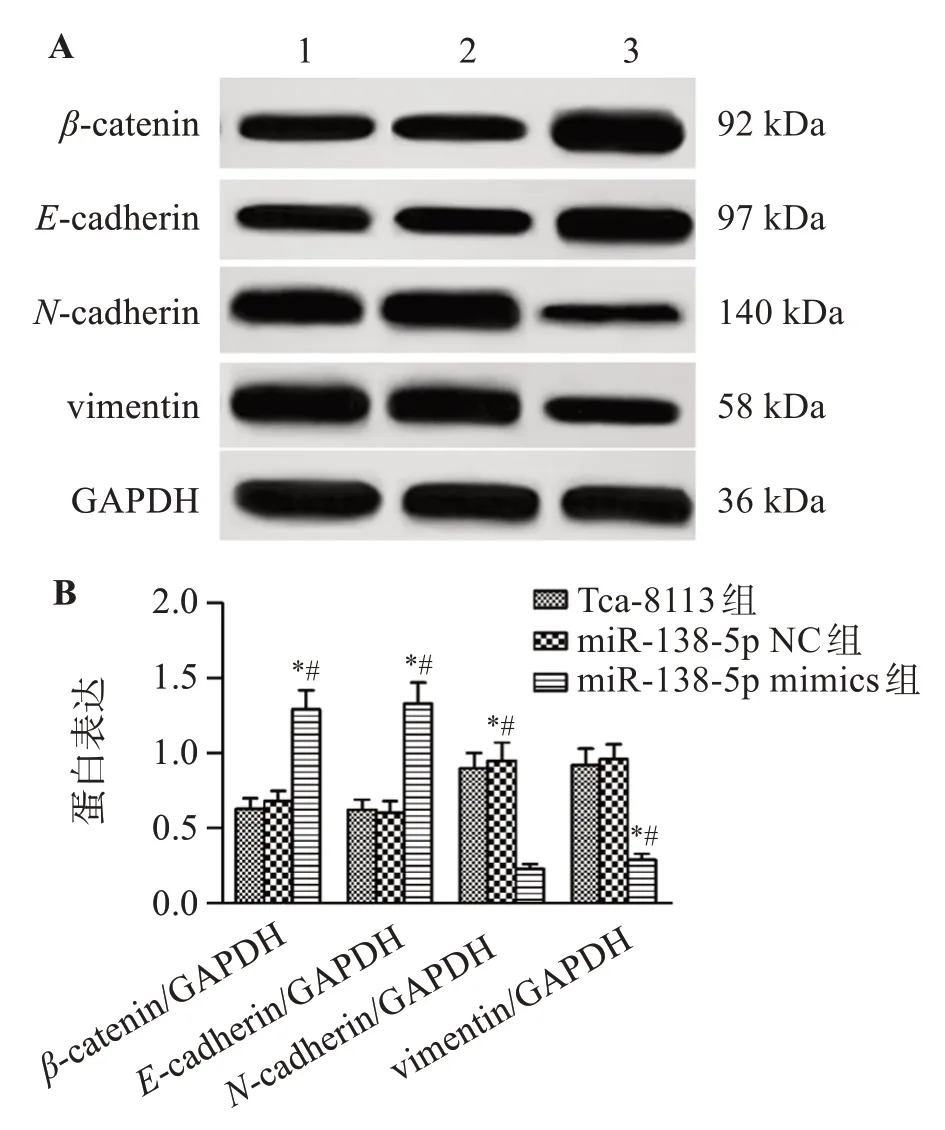
图5 上调miR-138-5p对Tca-8113细胞EMT相关蛋白表达水平的影响Figure 5 Effect of upregulation of miR-138-5p on EMT related protein expression in Tca-8113 cells
3.6 miR-138-5p和EZH2的靶向关系
生物信息学预测结果显示,miR-138-5p序列上存在与EZH2 3'UTR结合的连续位点。与miR-138-5p NC+EZH2 WT组 相 比,miR-138-5p mimics+EZH2 WT组荧光素酶活性显著降低(P<0.05),而miR-138-5p mimics+EZH2 MUT组和miR-138-5p NC+EZH2 MUT组荧光素酶活性无明显变化。见图6-7。
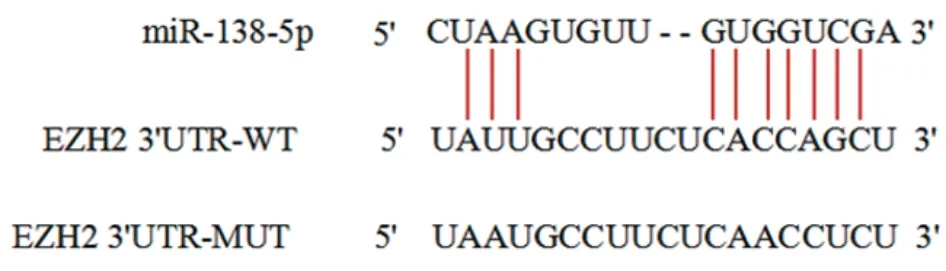
图6 生物信息学预测miR-138-5p和EZH2 3'UTR结合位点Figure 6 Bioinformatics prediction of miR-138-5p and EZH2 3'UTR binding sites
3.7 干扰EZH2对Tca-8113细胞增殖和EMT的影响
与Tca-8113组和si-NC组相比,si-EZH2组Tca-8113细胞β-catenin和E-cadherin表达水平显著升高(P<0.05),EZH2 mRNA表达水平增殖活性、N-cadherin和vimentin表达水平显著降低(P<0.05)。见图8。

图8 干扰EZH2对Tca-8113细胞增殖活性和EMT相关蛋白表达的影响Figure 8 Effect of EZH2 interference on the proliferation activity and EMT-related protein expression of Tca-8113 cells
3.8 过表达EZH2逆转上调miR-138-5p对Tca-8113细胞凋亡、迁移和侵袭的影响
与miR-138-5p mimics组和miR-138-5p mimics+pcDNA NC组相比,miR-138-5p mimics+pcDNA EZH2组细胞增殖活性、迁移和侵袭能力显著升高,细胞凋亡率显著降低(P<0.05)。见图9。
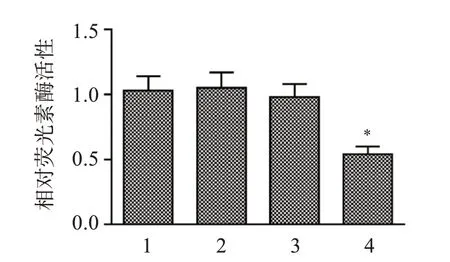
图7 双荧光素酶报告实验检测miR-138-5p和EZH2的靶向关系Figure 7 Targeting relationship between miR-138-5p and EZH2 detected by double luciferase reporter experiment

图9 过表达EZH2逆转上调miR-138-5p对Tca-8113细胞凋亡、迁移和侵袭的影响Figure 9 Overexpression of EZH2 reverses the effect of upregulation of miR-138-5p on apoptosis,migration and invasion of Tca-8113 cells
3.9 过表达EZH2逆转上调miR-138-5p对Tca-8113细胞EMT进程的影响
与miR-138-5p mimics组和miR-138-5p mimics+pcDNA NC组 相 比,miR-138-5p mimics+pcDNA EZH2组Tca-8113细 胞β-catenin和E-cadherin表达水平显著降低(P<0.05),N-cadherin和vimentin表达水平显著升高(P<0.05)。见图10。
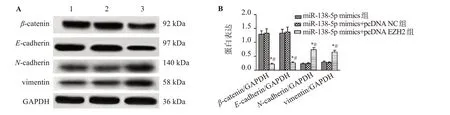
图10 过表达EZH2逆转上调miR-138-5p对Tca-8113细胞EMT相关蛋白表达的影响Figure 10 Overexpression of EZH2 reverses the effect of upregulation of miR-138-5p on the expression of EMT-related proteins in Tca-8113 cells
4 讨论
TSCC是一种常见的口腔癌,约占口腔癌的25%~40%,晚期TSCC患者多产生癌细胞局部浸润和淋巴结转移,且术后常出现复发[7],所以探索新的生物标志物对TSCC早期的诊断治疗具有重要的临床意义。
本研究发现,与永生化的舌上皮细胞株Hacta相比,Tca-8113癌细胞miR-138-5p表达水平显著降低,EZH2 mRNA和蛋白表达水平升高,提示miR-138-5p在TSCC中 低 表 达,EZH2在TSCC中 高 表达。本研究进一步通过生物信息学预测及双荧光素酶实验验证发现,miR-138-5p和EZH2存在靶向关系。另有研究发现,miR-138-5p对肺癌[8]等癌细胞的增殖、迁移具有抑制作用,其中miR-138-5p可通过靶向调控TCF3基因抑制胃癌细胞SGC-7901的侵袭和迁移[9],miR-138靶向AKT1参与舌鳞状细胞癌的迁移和侵袭[10]。本研究发现,上调miR-138-5p可提高Tca-8113细胞凋亡率及上皮标志蛋白β-catenin、E-cadherin表达水平,降低其增殖活性、侵袭迁移能力及间质标记蛋白N-cadherin、vimentin表达水平,提示上调miR-138-5p可提高Tca-8113细胞凋亡率,降低其增殖活性和EMT的发生,且上调miR-138-5p表达也可显著提高Tca-8113细胞EZH2 mRNA和蛋白表达水平。而EZH2通常在人类癌症组织中上调,Jia等[11]研究发现沉默EZH2可抑制TSCC的增殖和转移,Shih等[12]研究发现EZH2可作为TSCC发生的预测因子,促进TSCC转移。本研究亦发现,干扰EZH2可抑制Tca-8113增殖活性和EMT进程,而过表达EZH2可逆转上调miR-138-5p对Tca-8113细胞凋亡、迁移、侵袭和EMT进程的影响。Zhang等[13]研究发现抑制miR-138-5p可通过调控EZH2的表达,逆转卵巢癌细胞对顺铂的耐药性,而下调miR-138-5p可通过激活EZH2,诱导前列腺癌细胞提高多西他赛耐药性[14],均与本研究结果相似。提示miR-138-5p可通过靶向抑制EZH2蛋白表达,抑制Tca-8113细胞增殖、迁移侵袭及EMT进程,促进细胞凋亡。
综上所述,上调miR-138-5p可通过靶向抑制EZH2的表达,促进TSCC细胞Tca-8113凋亡,降低其增殖、侵袭迁移能力和EMT进程,有望为TSCC的临床研究提供潜在可行的靶点。但是miR-138-5p靶基因较多,miR-138-5p也可能通过调控其他因子或信号通路,影响TSCC细胞生物学行为,这有待后续深入研究。

