新疆部分地区规模猪场PEDV、TGEV和RV的流行情况调查
陈强斌
(新疆生产建设兵团第八师动物疫病预防控制中心,新疆 石河子 832000)
我国的生猪养殖业不断趋向于集约化和规模化发展,支撑着我国畜牧产业的壮大,但是随着我国猪场的规模化发展,各种猪的流行病也在我国的猪场中肆虐起来,特别是猪病毒性腹泻,严重影响着我国养猪业的发展壮大[1]。猪病毒性腹泻是规模化养猪场常见的一种猪肠道疾病,有着非常复杂的致病机理,不论是细菌、病毒的感染,还是寄生虫的感染,都有可能导致病毒性腹泻。猪病毒性腹泻的传播速度非常快,致死率也非常高,尤其是在规模化养猪场中,一旦流行起来,就有可能造成大量种猪和仔猪死亡。近年来,新疆的很多猪场都发生过不同程度的猪病毒性腹泻,引起这些病毒性腹泻的3种典型性病毒分别为猪轮状病毒(RV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)等。一般来说,这3种病毒一般以混合交叉感染的方式或者单一感染的方式在猪群中传播,发病非常急,对于仔猪来说更是可以造成百分之百的致死率。目前,仅从病理解剖和肠道病变很难区分TGE(猪传染性胃肠炎)、PED(猪流行性腹泻)、轮状病毒感染,因为感染了猪病毒性腹泻的猪都有相同的临床表现,那就是消瘦、有水样肠道病变、食欲不振、精神状态差等,会让感染病猪发生各种各样的肠道病变。虽然生猪养殖有很大的利润,但是因为猪场流行病毒性腹泻,导致大量生猪死亡,会对养殖户造成巨大的经济损失。特别是新疆部分地区,由于猪的规模化养殖起步时间不长,养殖技术和疾病防治技术都不发达,很多养殖场对猪流行性腹泻的流行状况并不了解,甚至不管猪感染何种病毒,都盲目使用猪腹泻疫苗,不但不能阻碍猪病毒性腹泻的传播,还对养殖户造成了更加严重的经济损失,因此采用科学的方法对新疆部分地区规模猪场的PED、TGE和RV流行情况调查是非常有必要的。
1 材料与方法
1.1 试验时间和地点
试验于2019年12月在新疆生产建设兵团第八师动物疫病预防控制中心进行。
1.2 试验材料
1.2.1 病料来源 收集来自新疆部分规模化猪场疑似TGEV、PEDV和RV的组织病料。
1.2.2 主要试验仪器设备 梯度型PCR仪(山东龙煤工矿机械有限公司);TG16-WS高速离心机(常州市亿能实验仪器厂);MIX2000漩涡混合器(杭州瑞诚仪器有限公司):HH-80数显恒温水浴锅(常州市亿能实验仪器厂);迷你离心机WTL-6K(湘仪离心机仪器有限公司);Tanon 2500凝胶成像系统(苏州阿尔法生物实验器材有限公司);DYCP-44P快速凝胶电泳槽(北京合众博普科技发展有限公司);格兰仕微波炉(格兰仕集团);伊若达DSX-280KB30灭菌器(南京伊若达仪器设备有限公司);博科96孔板混匀仪VORTEX-2(山东博科生物产业有限公司);电子精密天平JA3003(上海恒平科学仪器有限公司);705型超低温冰箱(美国Thermo公司)。
1.2.3 主要试剂 血样/组织DNA提取试剂盒、总RNA提取试剂盒、DNA分子量标准、Trizol裂解液、2×TaqPCR Master Mix;反转录试剂盒。
1.3 引物设计
PEDV、TGEV和RV的检测参考前人建立的方法[2-5]。各病原检测引物信息见表1。
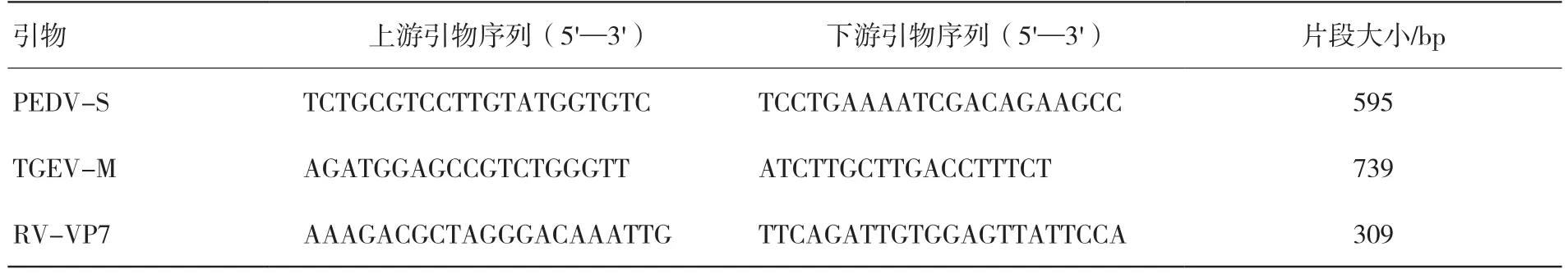
表1 引物序列和片段大小
1.4 方法
1.4.1 病料的处理 将采集的病料用研磨器进行研磨,再用PBS缓冲液作10倍稀释,经过反复冻融3次,然后在5℃ 8 000 r/min离心20 min,取上清液,并且将样品的相应信息进行标注,进行下一步的检测。
1.4.2 核酸的提取 按照试剂盒提供的步骤进行操作。
1.4.3 RT-PCR
(1)将无菌操作台充分消毒通风后,取一个无菌的PCR离心管,添加样品及试剂,随机引物(Random Primer)1 µL;样品病料RNA 2 µL;H2O 9 µL;5×RT Buffer 4 µL;dNTPs 2 µL;RNase Inhibitor 1 µL;Reverse Tra Ace 1 µL。
(2)将上述20 µL混合液PCR管混匀,低速离心后,置于RT-PCR反应仪器中,反应温度见表2,反应结束后在4 ℃保存。

表2 反应温度
(3)PCR扩增反应(25 µL体系)。试剂添加:10×PCR buffer2.5 µL;dNTP2.0 µL;上游引物1.0 µL;下游引物1.0 µL;灭菌去离子水17.0 µL;DNA模板1.0 µL;Taq酶0.5 µL。扩增反应条件:95℃预变性5 min;94 ℃变性30 s,52.2 ℃退火30 s,72 ℃延伸30 s,反复30个循环;72 ℃延伸10 min,4 ℃终止循环。
将PCR产物于1%琼脂糖凝胶中进行电泳,在电压5~10 V/cm条件下30 min,同时与DNA Marker DL 2 000进行比较,即可得出试验结果。
2 结果与分析
采用RT-PCR方法对来自新疆维吾尔自治区50个规模化猪场的131份疑似猪病毒性腹泻病料进行检测[6],结果如下。
2.1 猪病毒性腹泻病料RT-PCR检测结果
不同地区猪病毒性腹泻病料RT-PCR检测结果见表3。收集的131份病料中PEDV阳性份数74份,阳性率为56.5%;TGEV阳性份数17份,阳性率为13.0%;RV阳性份数18份,阳性率为13.7%,表明新疆维吾尔自治区规模猪场引起猪病毒性腹泻的主要病原为PEDV,阳性率最高,其次是RV,最后是TGEV。
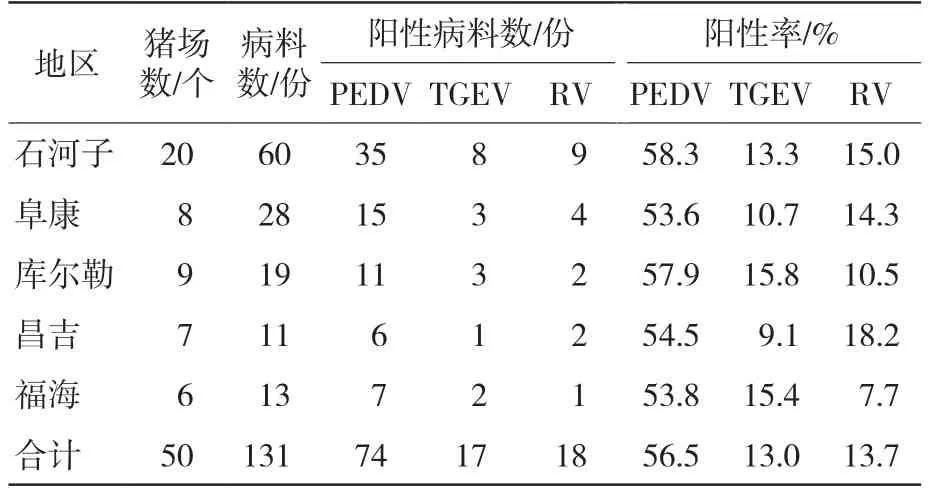
表3 猪病毒性腹泻病料RT-PCR检测结果
新疆维吾尔自治区不同地区的PEDV、TGEV和RV的阳性率有所差异,其中PEDV在石河子和库尔勒阳性率最高,分别为58.3%和57.9%,TGEV在库尔勒和福海最高,分别为15.8%和15.4%,RV阳性率在昌吉和石河子最高,分别为18.2%和15.0%,说明猪病毒性腹泻流行特点存在地域性差异,这可能与地貌差异、天气变化、温湿度不同等因素有关,有待进一步研究分析[7]。
2.2 不同季节PEDV、TGEV和RV阳性率
PEDV、TGEV和RV在一年四季的阳性率见表4。春、冬季节PEDV阳性率分别为52.1%和52.9%,均高于夏季(34.8%)和秋季(34.6%)的阳性率;春、冬季节的TGEV阳性率分别为8.3%和5.9%,均高于夏季(4.3%)和秋季(3.8%)的阳性率;春、冬季节的RV阳性率分别为6.2%、8.8%,均高于夏季(4.3%)和秋季(3.8%),表明猪病毒性腹泻在不同季节的阳性率有差异,冬季和春季暴发严重,阳性率高。PEDV在一年四季的阳性率均大于TGEV和RV[8]。
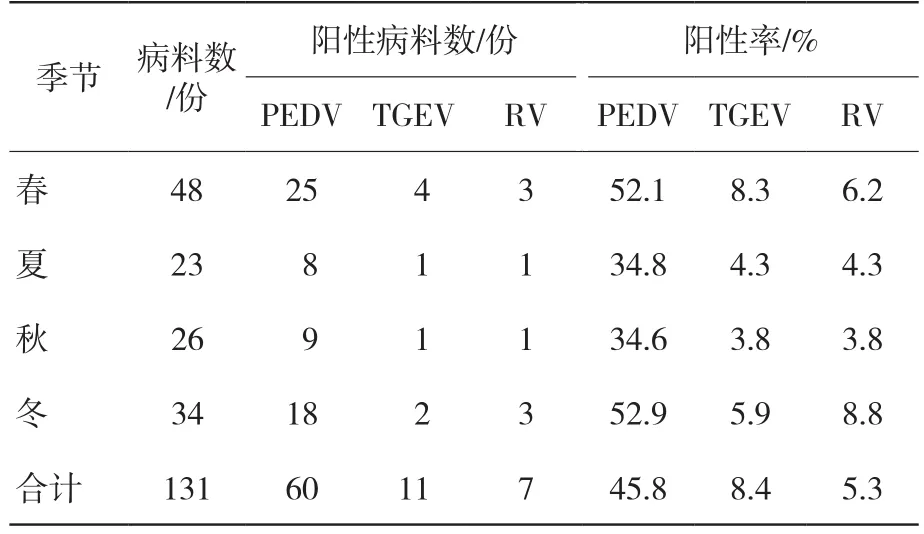
表4 PEDV、TGEV和RV在一年四季的阳性率
2.3 猪不同发育阶段PEDV、TGEV和RV阳性率
猪不同发育阶段的PEDV、TGEV和RV阳性率见表5。在猪不同发育阶段PEDV、TGEV和RV的阳性率存在显著差异,PEDV、TGEV和RV主要在7d内哺乳仔猪和7~25d哺乳仔猪阳性率较高,分别为PEDV 62.5%和65.1%、TGEV 7.1%和9.3%、RV 5.4%和9.3%。仔猪在出生25d内易受病毒感染引起腹泻,到了保育期阶段,PEDV、TGEV和RV阳性率均有明显下降,且到了肥育期阶段,几乎没有检测到由TGEV和RV引起的病毒性腹泻情况。
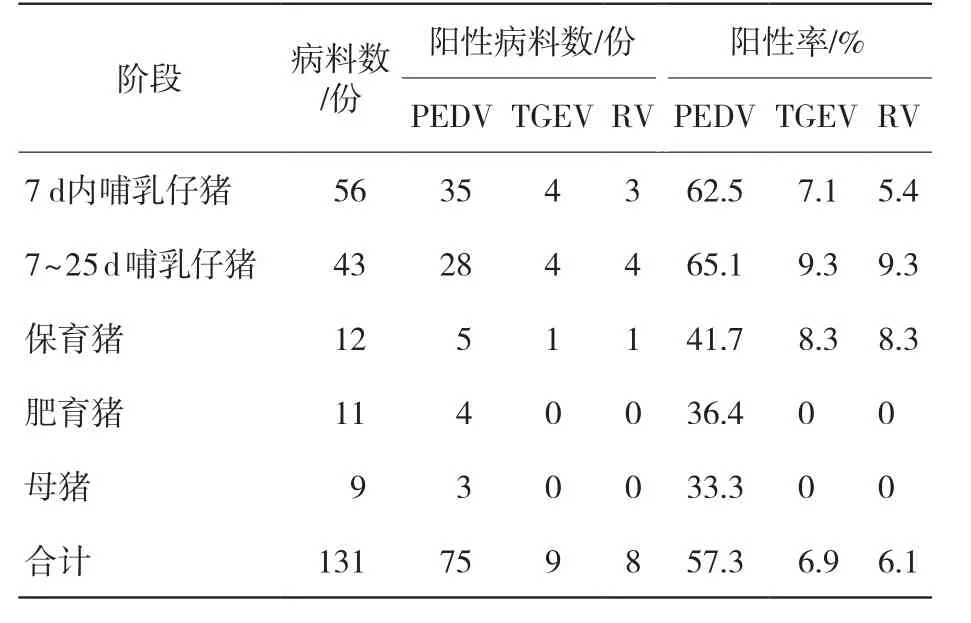
表5 猪不同发育阶段PEDV、TGEV和RV阳性率
3 讨论
猪病毒性腹泻是目前我国规模化猪场常见的疾病,一旦猪感染了猪病毒性腹泻,则会出现消瘦、脱水、严重腹泻等症状,死亡率极高,严重制约我国养猪业的发展,对猪场造成严重的经济损失[9]。为了解新疆部分地区规模猪场的猪病毒性腹泻情况,研究使用了RT-PCR对新疆维吾尔自治区的50个规模化猪场(包括石河子、阜康、库尔勒、昌吉、福海)疑似131份猪病毒性腹泻病料进行了实验室检测,结果表明,PEDV阳性率最高,为56.5%;TGEV和RV阳性率较低,分别为13.0%和13.7%。不同地区的阳性率有一定的差异,说明猪病毒性腹泻流行特点存在地域性差异,这可能与地貌差异、天气变化、温湿度不同等因素有关,有待进一步研究分析。春、冬季节PEDV阳性率分别为52.1%和52.9%,均高于夏季(34.8%)和秋季(34.6%)的阳性率,春、冬季节的TGEV阳性率分别为8.3%和5.9%,均高于夏季(4.3%)和秋季(3.8%)的阳性率,春、冬季节的RV阳性率分别为6.2%、8.8%,均高于夏季(4.3%)、秋季(3.8%),表明猪病毒性腹泻在不同季节的阳性率有差异,冬季和春季暴发严重,阳性率高,可能是因为春季、冬季比较寒冷,导致猪的免疫力低下,更容易感染猪腹泻病毒。通过本文的数据不难发现,PEDV在一年四季的阳性率均大于TGEV和RV。在猪不同发育阶段PEDV、TGEV和RV阳性率存在显著差异,PEDV、TGEV和RV主要在7d内仔猪和7~25d哺乳仔猪阳性率较高,分别为PEDV 62.5%和65.1%、TGEV 7.1%和9.3%、RV 5.4%和9.3%,仔猪在出生25d内易受病毒感染引起腹泻。到了保育期阶段,PEDV、TGEV和RV阳性率均有明显下降,而到了肥育期阶段,几乎没有检测到由TGEV和RV引起的病毒性腹泻情况,这是因为仔猪的免疫力比较低下,更容易受到腹泻病毒的侵袭。本研究通过对猪病毒性腹泻流行情况调查,为新疆维吾尔自治区猪病毒性腹泻研究提供科学依据和防控方向。

