DNMT3A调控Drp1对肝星状细胞活化增殖和迁移能力的影响
王 娟,孙 峰,杨晶晶,鲁 超
(1.安徽医科大学药学院,安徽 合肥 230032;2.安徽医科大学第二附属医院药物临床试验研究中心,安徽 合肥 230601; 3.安徽理工大学第一附属医院,安徽 淮南 232001)
肝纤维化(hepatic fibrosis)是营养代谢和病毒感染等引发的慢性肝脏疾病,最终导致细胞外基质(extracellular matrix,ECM)在肝脏中过度积聚[1-2]。肝星状细胞(hepatic stellate cells,HSCs)是肝纤维化发生的主体细胞类型,其活化会影响肝纤维化疾病的转归,但目前关于HSCs活化的分子机制尚未了解完全[3]。证据表明,线粒体裂变在细胞活化增殖和纤维化疾病中发挥重要作用[4-5]。线粒体裂变(mitochondrial fission)是指一个线粒体变成两个线粒体,并且外膜完全分离,与线粒体融合动态变化维持线粒体稳态[6-7]。在哺乳动物细胞里,这个过程主要由线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)来介导的。Wang等[4]研究表明,Drp1在活化的成纤维细胞中表达上调,提示Drp1表达上调促进了成纤维细胞的活化增殖,但Drp1是否参与调控HSCs活化增殖尚不清楚,值得进一步研究。
研究表明表观遗传修饰在线粒体裂变中发挥重要作用,可通过调控Drp1的表达来调节线粒体裂变的发生促进纤维化发生发展[8]。作为DNA甲基化关键酶之一的DNA甲基转移酶3A(DNA methyltransferase 3A,DNMT3A)在HSCs活化增殖中发挥重要作用[9-10]。那么在活化的HSCs中Drp1的表达升高是否是由DNMT3A介导的甲基化修饰引起的?DNMT3A是否通过调控Drp1从而促进HSCs活化增殖及肝纤维化?这一科学问题目前尚未见报道,值得我们进一步研究。本研究拟通过探究DNMT3A对Drp1的调控,并观察对HSCs活化增殖和迁移能力的影响,明确DNMT3A是否通过调控Drp1介导的线粒体裂变促进HSCs活化,从而为肝纤维化的临床治疗提供新的理论依据和作用靶点。
1 材料
1.1 细胞株大鼠肝星状细胞株(HSC-T6)购自武汉普诺赛生命科技有限公司。
1.2 药物处理TGF-β1购自PeproTech公司。实验前先用柠檬酸盐缓冲液(10 nmol·L-1,pH 3.0)配成浓度为0.1 g·L-1的储备液,置于-20 ℃冰箱保存;临用时稀释成浓度为2 mg·L-1的工作液,置于4 ℃冰箱保存。
1.3 主要试剂DMEM 培养基(Hylcone)、胎牛血清(Gibco,USA);胰蛋白酶(Multicell);Transwell小室(Corning);CCK-8试剂盒(Biosharp);BCA试剂盒(碧云天);TRIzol试剂(Invitrogen);逆转录和RT-qPCR试剂盒(艾科瑞生物);兔源一抗GAPDH、CollagenⅠ、α-SMA、Drpl和Fis1(Proteintech);兔源一抗DNMT3A(Abcam);兔源二抗(Bioworld)。引物序列由上海生工公司合成,见Tab 1。
1.4 主要仪器细胞培养超净工作台(苏州净化);高压灭菌锅(博迅);倒置荧光显微镜(蔡司),CO2培养箱(赛默飞),实时荧光定量PCR仪(Bio-Rad),酶标仪(Varioskan LUX),低温离心机(德国艾本德);电子天平(赛多利斯)。

Tab 1 The primer sequences
2 方法
2.1 细胞培养采用含10%胎牛血清的高糖DMEM培养基,置于37 ℃,5% CO2培养箱中孵育,培养至铺满瓶底,然后传代,保留5代后方可进行后续实验研究。
2.2 TGF-β1诱导HSCs细胞活化HSC-T6细胞以30%的密度接种于6孔板,于37 ℃的CO2培养箱中培养过夜;次日用含5 μg·L-1TGF-β1的无血清DMEM培养基替代,再培养24 h。待其他分组处理后收集细胞,制作提取RNA和总蛋白的样品。
2.3 DNMT3A慢病毒转染按照吉玛基因慢病毒操作手册,首先通过预实验确认感染方法和感染参数。将对数期的HSC-T6消化计数至1×108L-1铺板于6孔板中,贴壁后用5 μg·L-1TGF-β1刺激24 h活化。取DNMT3A慢病毒,按MOI值为30的滴度与无血清培养基混合稀释,并加入终浓度为5 mg·L-1的Polybrene(聚凝胺)用来增加转染效率;同时设置相同MOI滴度的病毒阴性对照组;24 h后更换新鲜培养基,感染72 h后在荧光倒置显微镜下观察荧光并用于后续实验。
2.4 实时荧光定量PCR(RT-qPCR)细胞如上处理后,每孔加入1 mL TRIzol试剂慢提RNA。于260 nm波长处检测其浓度,按照试剂盒(艾科瑞)要求以不超过50 mg·L-1浓度进行逆转录得cDNA。再按照qPCR试剂盒(艾科瑞)要求混合液体,以两步法PCR反应程序进行扩增,以GAPDH作为内参,2-ΔΔCT法计算mRNA的相对表达量。
2.5 Western blot细胞分组处理后加入RIPA裂解液提取蛋白,BCA法测定蛋白浓度。SDS-PAGE蛋白电泳,转膜,脱脂牛奶封闭,洗膜,4 ℃过夜孵育一抗,次日取出洗膜,室温孵育二抗1 h,洗膜,用ECL法显影。结果采用ImageJ软件进行灰度值分析,以GAPDH作为内参,实验重复3次。
2.6 细胞增殖实验(CCK-8)用胰蛋白酶消化对数生长期细胞,制备细胞悬液。以每孔2 000个接种于96孔板中,置于5%CO2培养箱中37 ℃下培养4 h,贴壁后进行后续处理,每组设6个复孔,用无菌PBS填充边缘孔。慢病毒转染结束后,每孔加入10 μL CCK-8溶液,轻轻敲击混匀96孔板,在培养箱中孵育2 h后,用酶标仪测定450 nm处的吸光度。根据增殖率/%=(实验组 - 空白对照)/(阴性对照 - 空白对照)×100%计算,实验重复3次。
2.7 细胞划痕实验按“2.3”处理后的细胞以过夜长满的密度铺在提前在底部划横线的6孔板上,48 h后用200 μL的无菌枪头垂直底部平行线进行划痕,用PBS清洗3~4次后,加入无血清DMEM,置于37 ℃的5% CO2培养箱中。分别用倒置显微镜观察0 h,48 h伤口宽度的变化规律,并对划痕面积进行ImageJ统计。迁移率/%=(初始划痕面积-48 h后划痕面积)/初始划痕面积×100%,每孔随机选取3个视野,每孔重复3次。
2.8 Transwell迁移实验Transwell下室提前1 h加入无血清培养基进行基底膜水化。将慢病毒处理好的各组细胞用胰酶消化离心,然后重悬于DMEM中,并稀释为5×108L-1。取100 μL接种于上室中,并加入适量10%FBS于下室,孵育30~40 h。小室洗涤后用4%的多聚甲醛室温固定30 min,晾干;随后用0.1%的结晶紫水溶液室温下染色20 min。用棉签轻轻除去上室膜细胞,洗涤后每孔任意选择5个视野进行拍照,用ImageJ进行计数分析,每组3个复孔,取平均值。
2.9 统计学分析采用 Graphpad Prism 6.0软件进行统计分析。组间差异采用t检验和单因素方差分析。
3 结果
3.1 DNMT3A在HSCs细胞中的表达情况在用TGF-β1刺激HSC-T6细胞后,DNMT3A的含量升高,结果如Fig 1所示。用MOI值为30的DNMT3A慢病毒感染72 h后,Fig 1A,B结果显示,与NC组比较,病毒感染组DNMT3A水平明显降低(P<0.01),病毒感染成功,DNMT3A沉默模型成功构建。

Fig 1 Expression of DNMT3A in each group after lentivirus infection n=3)A:qPCR of DNMT3A;B:Western blot of DNMT3A,1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A;*P<0.05,**P<0.01 vs Control group;##P<0.01 vs TGF-β1+ LV5-NC group.
3.2 DNMT3A调控collagen Ⅰ,α-SMA mRNA的表达Fig 2结果显示,用TGF-β1刺激HSCs细胞后,与正常组相比,Collagen Ⅰ、α-SMA mRNA含量明显升高(P<0.05);而DNMT3A慢病毒感染后,Collagen Ⅰ、α-SMA mRNA含量明显低于NC组(P<0.01),提示DNMT3A被抑制,HSCs的活化也被抑制。
3.3 DNMT3A调控collagen Ⅰ,α-SMA 蛋白的表达Fig 3结果显示,用TGF-β1刺激HSCs细胞后,与正常组比较,Collagen Ⅰ,α-SMA蛋白含量明显升高(P<0.01),HSCs被活化;而DNMT3A慢病毒感染后,Collagen Ⅰ、α-SMA蛋白水平明显低于NC组(P<0.01),提示DNMT3A被抑制,纤维化水平被抑制。

Fig 2 Effect of DNMT3A on collagen Ⅰ,*P<0.05,**P<0.01 vs Control group;#P<0.05 vs TGF-β1+ LV5-NC group.

Fig 3 Effect of DNMT3A on expression of collagen Ⅰ,1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A.*P<0.05,**P<0.01 vs Control group.##P<0.01 vs TGF-β1+ LV5-NC group.
3.4 DNMT3A调控Drp1 mRNA的表达Fig 4结果显示,用TGF-β1刺激HSCs细胞后,与正常组比较,Drp1 mRNA的含量明显升高(P<0.01);而DNMT3A慢病毒感染后,Drp1 mRNA含量明显低于NC组(P<0.05),提示DNMT3A被抑制,线粒体裂变也被抑制。
3.5 DNMT3A调控Drp1蛋白的表达Fig 5结果显示,用TGF-β1刺激HSCs细胞后,与正常组比较,Drp1蛋白含量明显升高(P<0.01);而DNMT3A慢病毒感染后,Drp1蛋白含量明显低于NC组(P<0.01),提示DNMT3A被抑制,与线粒体裂变有关的蛋白也被抑制。

Fig 4 Effect of DNMT3A on Drp1 mRNA expression n=3)1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A.**P<0.01 vs Control group;#P<0.05 vs TGF-β1+LV5-NC group.

Fig 5 Effect of DNMT3A on expression of 1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A.**P<0.01 vs Control group;##P<0.01 vs TGF-β1+LV5-NC group.
3.6 DNMT3A调控HSCs的增殖Fig 6结果显示,用TGF-β1刺激HSCs细胞后,与正常组比较,细胞活化增殖活性明显升高(P<0.01);而DNMT3A慢病毒感染后,细胞活化增殖活性明显低于NC组(P<0.01),提示DNMT3A被抑制,细胞活化增殖活性也被抑制。
3.7 DNMT3A调控HSCs的迁移Transwell迁移实验结果显示,用TGF-β1刺激HSCs细胞后,细胞迁移能力较正常组明显升高(P<0.01);而DNMT3A慢病毒感染后,细胞迁移能力明显低于NC组(P<0.01),提示DNMT3A被抑制,细胞迁移能力也被抑制(Fig 7A)。如Fig 7B所示,划痕实验也证实了上述结果。
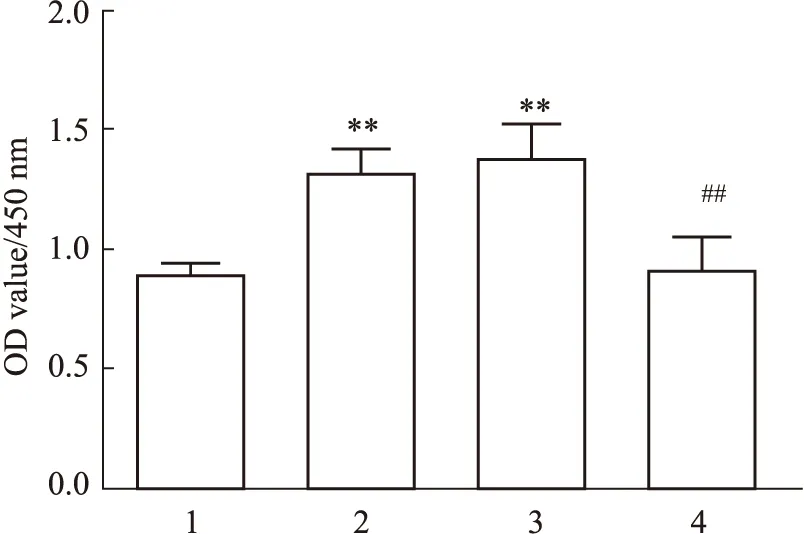
Fig 6 Effect of DNMT3A on HSCs proliferation n=6)1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A.**P<0.01 vs Control group;##P<0.01 vs TGF-β1+ LV5-NC group.
4 讨论
线粒体的生物发生和动力学是协调的,为保持线粒体稳态,线粒体分裂蛋白会做相应的表达变化[7]。Drp1是线粒体裂变的标志性分子,其在线粒体发生分裂过程中合成和表达增多且它的功能是必需的[11]。已有文献报道,Drp1在肾脏和血管纤维化中发挥重要作用,Drp1的上调会导致线粒体裂变增加,进而促进纤维化细胞活化增殖,促进纤维化发展[4-5]。但Drp1在肝纤维化中的作用不明确。Das等[12]研究表明,线粒体裂变的增加可促进HSCs的活化增殖,HSCs活化增殖的增强可进一步促进肝纤维化的发生发展。本研究结果发现,活化的HSCs中Drp1的合成和表达增多,提示Drp1介导的线粒体裂变可能在HSCs的活化过程中发挥重要作用,调控Drp1的关键分子可能是抗肝纤维化的潜在靶点。但具体机制有待进一步研究。
DNMT3A作为一种稳定可遗传的表观遗传机制,在基因组中通过CpG岛从头甲基化过程来调控纤维化的发生发展[13-14]。然而,DNMT3A在HSCs活化和肝纤维化进展中的作用在国内外很少报道。我们课题组前期的研究发现,DNA甲基化与HSCs的增殖状态密切相关,可参与调控HSCs活化增殖[15]。在本实验中,使用TGF-β1刺激HSCs后,Collagen Ⅰ和α-SMA表达升高,细胞的增殖和迁移能力增强,说明HSCs活化增殖模型建立成功,此时DNMT3A水平显著升高,提示在活化的HSCs中DNMT3A可能发挥重要作用。
Du等[16]的研究表明,表观遗传修饰调控线粒体裂变在肝脏缺血/再灌注中发挥重要作用,但DNMT3A是否调控Drp1介导的线粒体裂变促进HSCs活化增殖还未见报道。为了进一步明确DNMT3A和Drp1的关系,我们利用慢病毒感染沉默DNMT3A后发现,HSCs合成的collagen Ⅰ、α-SMA的表达下调,并且HSCs细胞的增殖和迁移能力受到抑制,同时Drp1的含量也明显降低,提示沉默DNMT3A可以抑制Drp1表达,同时有效地降低了HSCs增殖与迁移能力。实验结果提示,DNMT3A在Drp1的表达调控中具有重要的作用,DNMT3A可能通过影响线粒体裂变发挥抑制HSCs活化作用。

Fig 7 Effect of DNMT3A on HSCs migration ability n=5)A:Representative results of transwell migration (×200).B:Representative results of wound healing (×200).C:Statistical analysis of the effect of DNMT3A on HSCs on the migration ability;D:Statistical analysis of the effect of DNMT3A on HSCs on the migration and healing ability.1:Control;2:TGF-β1;3:TGF-β1+LV5-NC;4:TGF-β1+LV5-DNMT3A.*P<0.05,**P<0.01 vs Control group.##P<0.01 vs TGF-β1+LV5-NC group.
综上,DNMT3A可能通过调控Drp1介导的线粒体裂变促进肝星状细胞活化增殖和迁移能力,进而促进肝纤维化发生。预期研究成果将有利于从表观遗传学方向结合线粒体裂变角度深入理解肝纤维化发病的分子作用机制,从而为肝纤维化的临床治疗提供新的理论依据和新的作用靶点。

