毛萼乙素通过Wnt/β-catenin通路抑制结肠癌细胞上皮间质转化Δ
匡微,郑银彬,李雨奇,田平平,苏强,向小聪(.川北医学院附属南充市中心医院组织工程与干细胞研究所,四川南充 67000;.川北医学院附属南充市中心医院心胸外科,四川南充 67000;.安徽医学高等专科学校医学技术学院,合肥 060;4.川北医学院附属南充市中心医院药学部,四川南充 67000)
结肠癌是一种高异质性疾病,尽管其早期患者可以通过手术和辅助方案治疗,但治疗后仍有部分患者容易复发[1―2],且大多数患者在诊断时已经处于中晚期阶段,常规疗法已经很难有效[3―4],亟需寻找新的有效治疗方案。目前,结肠癌细胞的高转移特性是导致结肠癌预后不良的主要原因,其中上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤转移的重要因素。因此,开发可有效抑制结肠癌细胞EMT的药物尤为重要。
毛萼乙素是从疏花毛萼香茶菜中提取的一种具抗癌活性的二萜类化合物,已有报道显示,其在急性髓系白血病[5]、乳腺癌[6]、胰腺癌[7]等恶性肿瘤中发挥了较好的治疗作用,但其是否可用于治疗结肠癌尚不明确。目前已有研究发现,异常的Wnt/β-联蛋白(β-catenin)激活可直接驱动结肠癌的进展和转移[8―10],但毛萼乙素是否可通过该信号通路治疗结肠癌尚不明确。基于此,笔者以结肠癌细胞HT29、HCT116为研究对象,探讨毛萼乙素对上述2种细胞侵袭、迁移的影响,并基于Wnt/β-catenin信号通路初探毛萼乙素对结肠癌细胞EMT的作用,以期为毛萼乙素治疗结肠癌提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有TS100F型荧光倒置显微镜(日本Nikon公司)、DMi8型倒置显微镜(德国Leica公司)、810FUGE型低温高速离心机(美国Thermo Fisher Scientific公司)、TD-5Z型台式低速多管架离心机(四川蜀科仪器有限公司)、DYY-6D型电泳仪(北京六一生物科技有限公司)、Gel Doc XR+全自动凝胶成像系统(上海艾研生物科技有限公司)等。
1.2 主要药品与试剂
毛萼乙素(货号84745-95-9)购自云南西力生物技术股份有限公司;Licl(Wnt/β-catenin信号通路激活剂)购自北京伊诺凯科技有限公司(货号A53473);XAV939(Wnt/β-catenin信号通路抑制剂)购自美国MCE公司(货号284028-89-3);兔源原癌基因蛋白质c-myc、N-钙黏蛋白(N-cadherin)、E-钙黏蛋白(E-cadherin)、β-catenin、T细胞因子4(TCF4)、细胞周期蛋白D1(cyclin D1)、锌指转录抑制因子Snail、β-肌动蛋白(β-actin)均购自山东华安生物科技有限公司(货号分别为HA721182、ET107-37、ET1607-15、ET1601-5、R1401-11、ER0722、EM1706-65、ET1701-80);羊抗免疫球蛋白G二抗购自美国Sigma公司(货号A6154);ECL化学发光试剂购自上海雅酶生物科技有限公司(货号SQ201);McCoy’s 5A培养基、胎牛血清购自美国Gibco公司(货号分别为16600108、10100147)。
1.3 细胞
结肠癌细胞HT29、HCT116购自中国科学院细胞库。
2 方法
2.1 细胞培养
将HT29细胞或HCT116细胞培养于含10%胎牛血清的McCoy’s 5A完全培养基中,置于37℃、5%CO2培养箱中培养。
2.2 毛萼乙素对结肠癌细胞迁移能力的影响
将6孔板背面用记号笔画3条横穿过孔的直线,然后将HT29或HCT116细胞以1.5×105个/孔接种于6孔板中,待细胞完全贴壁后,使用枪头在细胞生长面垂直于背后直线划痕,并用磷酸盐缓冲液(PBS)清洗掉落的细胞。将上述2种细胞分为对照组和毛萼乙素不同浓度组(1.0、1.5 μmol/L,浓度参考文献[5]设置),每组设3个复孔。培养0、24、48 h后,采用倒置显微镜观察划痕的愈合情况,并拍照。采用Image J v1.8.0软件测量划痕的距离,计算细胞迁移率[细胞迁移率=(0 h划痕宽度-不同时间点划痕宽度)/0 h划痕宽度×100%]。
2.3 毛萼乙素对结肠癌细胞侵袭、迁移的影响
2.3.1 Transwell侵袭实验 取对数生长期的HT29、HCT116细胞,制成细胞密度为5×105mL-1的无血清细胞悬液,分别给予0(对照组)、1.0 μmol/L(浓度根据“2.2”项下实验结果设置,下同)的毛萼乙素刺激,每组设置3个复孔。取上述细胞悬液200 μL加到Transwell小室上层,下层中加入含20%胎牛血清的McCoy’s 5A培养基600 μL。将细胞侵袭小室置于培养箱中培养24 h,然后以4%多聚甲醛固定30 min,再用1%结晶紫染色30 min后,于倒置显微镜下观察穿过基底膜的侵袭细胞数。每个样本观察5个视野,取平均值作为检测结果。实验重复3次,然后计算细胞侵袭率[细胞侵袭率=(对照组侵袭数-实验组侵袭数)/对照组侵袭数×100%]。
2.3.2 Transwell迁移实验 实验前,在Transwell小室内膜上均匀铺入稀释后的Matrigel 50 μL,待其凝结后,取对数生长期的HT29、HCT116细胞,制成细胞密度为1×106mL-1的无血清细胞悬液,分别给予0(对照组)、1.0 μmol/L的毛萼乙素刺激,每组设置3个复孔。其余操作同“2.3.1”项,然后计算细胞迁移率[细胞迁移率=(对照组迁移数-实验组迁移数)/对照组迁移数×100%]。
2.4 毛萼乙素对结肠癌细胞中EMT相关蛋白表达的影响
采用Western blot法进行实验。取HT29细胞或HCT116细胞按2×105个/孔接种于6孔板后分为对照组和毛萼乙素0.5、1.0、1.5 μmol/L组。培养24 h后,收集细胞,加入RIPA裂解液裂解20 min,离心,取上清液,经BCA法检测蛋白浓度后,进行变性、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和转膜;以5%脱脂奶粉溶液封闭1 h,PBST缓冲液清洗5 min×3次后,加入E-cadherin、N-cadherin、Snail、β-actin一抗(稀释度均为1∶500)孵育过夜;以PBST缓冲液清洗5 min×3次,加入二抗(稀释度为1∶5 000)孵育1 h;加入ECL化学发光试剂显色,以全自动凝胶成像系统成像,采用Image J v1.8.0软件进行分析,以目的蛋白与内参(β-actin)的灰度值比值表示其表达水平。
2.5 毛萼乙素联合Wnt/β-catenin信号通路激动剂对该信号通路相关蛋白及N-cadherin蛋白表达的影响
采用Western blot法进行实验。取HT29细胞或HCT116细胞按2×105个/孔接种于6孔板后,分为对照组、毛萼乙素组(1.0 μmol/L)、Licl[11]组(10 mmol/L)、毛萼乙素+Licl组(1.0 μmol/L毛萼乙素+10 mmol/L Licl)。培养24 h后,收集细胞,按“2.4”项下方法处理细胞并进行电泳,然后加入β-catenin、c-myc、cyclin D1、TCF4、N-cadherin、β-actin一抗(稀释度均为1∶500)孵育过夜;以PBST缓冲液清洗5 min×3次,加入二抗(稀释度为1∶5 000)孵育1 h,按“2.4”项下方法进行显色及灰度值分析。
2.6 毛萼乙素联合Wnt/β-catenin信号通路抑制剂对结肠癌细胞迁移率及β-catenin、N-cadherin、E-cadherin蛋白表达的影响
将6孔板背面用记号笔画3条横穿过孔的直线,然后将HT29细胞或HCT116细胞按1.5×105个/孔接种于6孔板中,待细胞完全贴壁后,分别给予0(对照组)、1.0 μmol/L 的毛萼乙素以及 10 μmol/L XAV939[12]和 1.0 μmol/L毛萼乙素+10 μmol/L XAV939刺激,每组设置3个复孔,同“2.2”项下方法进行划痕愈合实验,并检测培养24、48 h后的细胞迁移率。取HT29细胞或HCT116细胞按2×105个/孔接种于6孔板后分为对照组、毛萼乙素组(1.0 μmol/L)、XAV939组(10 μmol/L)、毛萼乙素+XAV939组(1.0 μmol/L毛萼乙素+10 μmol/L XAV939)。培养24 h后,收集细胞,按“2.4”项下方法处理细胞并进行电泳,然后加入β-catenin、N-cadherin、E-cadherin、β-actin一抗(稀释度均为1∶500)孵育过夜;以PBST缓冲液清洗5 min×3次,加入二抗(稀释度为1∶5 000)孵育1 h,按“2.4”项下方法进行显色及灰度值分析。
2.7 统计学方法
所有数据使用GraphPad Prism 7.0软件进行统计学分析。呈正态分布的计量资料以±s表示,多组间比较采用单因素方差分析及SNK-q检验,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 毛萼乙素对结肠癌细胞迁移能力的影响结果
与对照组比较,毛萼乙素1.0、1.5 μmol/L组2种结肠癌细胞的迁移率均显著降低(P<0.01),且呈一定浓度和时间依赖趋势。结果见图1。

图1 毛萼乙素对2种结肠癌细胞迁移能力的影响结果
3.2 毛萼乙素对结肠癌细胞侵袭、迁移的影响结果
与对照组比较,毛萼乙素1.0 μmol/L组2种结肠癌细胞的侵袭率及迁移率均显著降低(P<0.01)。结果见图2。
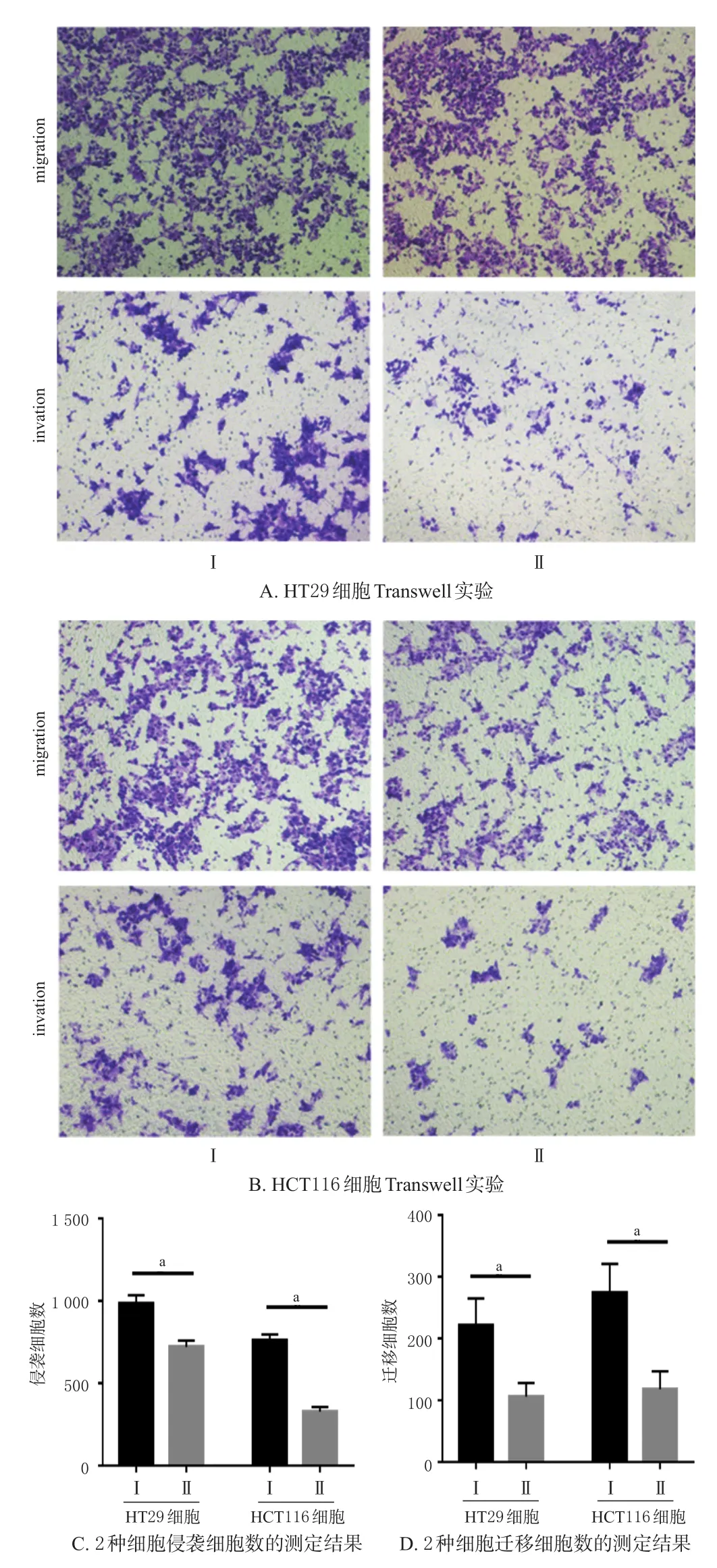
图2 毛萼乙素对2种结肠癌细胞侵袭、迁移的影响结果
3.3 毛萼乙素对结肠癌细胞EMT相关蛋白表达的影响结果
与对照组比较,毛萼乙素1.0、1.5 μmol/L组2种结肠癌细胞中N-cadherin、Snail表达水平均显著降低(P<0.01),E-cadherin表达水平均显著升高(P<0.01);毛萼乙素0.5 μmol/L组HT29中E-cadherin表达水平显著升高(P<0.01),HCT116细胞中Snail表达水平显著降低(P<0.05),表明毛萼乙素可以抑制结肠癌细胞EMT。结果见图3、表1。
表1 2种结肠癌细胞中EMT相关蛋白表达水平的检测结果(±s,n=3,%%)
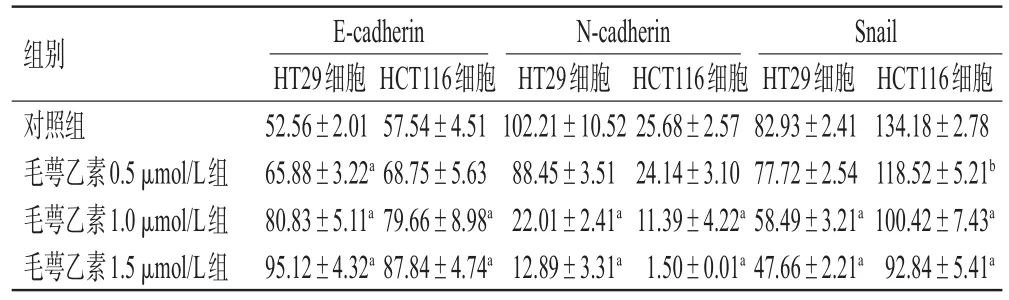
表1 2种结肠癌细胞中EMT相关蛋白表达水平的检测结果(±s,n=3,%%)
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05
组别对照组毛萼乙素0.5μmol/L组毛萼乙素1.0μmol/L组毛萼乙素1.5μmol/L组HCT116细胞134.18±2.78 118.52±5.21b 100.42±7.43a 92.84±5.41a E-cadherin HT29细胞52.56±2.01 65.88±3.22a 80.83±5.11a 95.12±4.32a HCT116细胞57.54±4.51 68.75±5.63 79.66±8.98a 87.84±4.74a N-cadherin HT29细胞102.21±10.52 88.45±3.51 22.01±2.41a 12.89±3.31a HCT116细胞25.68±2.57 24.14±3.10 11.39±4.22a 1.50±0.01a Snail HT29细胞82.93±2.41 77.72±2.54 58.49±3.21a 47.66±2.21a

图3 2种结肠癌细胞中EMT相关蛋白表达的电泳图
3.4 毛萼乙素联合Wnt/β-catenin信号通路激动剂对该信号通路相关蛋白及N-cadherin蛋白表达的影响结果
与对照组比较,毛萼乙素组2种结肠癌细胞中Wnt/β-catenin信号通路相关蛋白(β-catenin、c-myc、cyclin D1、TCF4)及N-cadherin的表达水平均显著降低(P<0.05或P<0.01);Licl组2种结肠癌细胞中上述几种蛋白的表达水平均显著升高(P<0.05或P<0.01)。与毛萼乙素组比较,毛萼乙素+Licl组2种结肠癌细胞中上述几种蛋白的表达水平被显著逆转(P<0.05或P<0.01)。结果见图4、表2。
表2 2种结肠癌细胞中Wnt/β-catenin信号通路相关蛋白及N-cadherin蛋白表达水平的检测结果(±s,n=3,%%)

表2 2种结肠癌细胞中Wnt/β-catenin信号通路相关蛋白及N-cadherin蛋白表达水平的检测结果(±s,n=3,%%)
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05;c:与毛萼乙素组比较,P<0.05;d:与毛萼乙素组比较,P<0.01
组别c-myc对照组毛萼乙素组Licl组毛萼乙素+Licl组β-catenin HT29细胞134.79±5.67 106.03±5.64a 149.65±4.21b 121.53±6.54c HCT116细胞104.24±5.47 82.62±8.12b 120.56±5.12b 101.08±8.12c HT29细胞40.64±1.53 19.68±4.57a 50.89±4.25b 35.31±3.21d HCT116细胞77.92±2.04 62.31±2.64b 106.10±4.25a 95.8±11.64d cyclinD1 HT29细胞18.85±3.21 12.39±1.19b 29.94±1.21a 24.79±3.92d HCT116细胞116.48±2.32 84.31±1.52a 128.66±3.41b 104.73±7.21d TCF4 HT29细胞69.07±5.21 18.00±3.11a 95.81±4.85a 64.95±3.47d HCT116细胞77.62±1.69 13.34±4.41a 86.54±2.21b 75.90±3.21d N-cadherin HT29细胞17.67±2.51 0.92±0.01a 23.68±0.95b 21.21±3.29d HCT116细胞25.15±4.21 7.86±0.59a 78.17±1.12a 28.15±3.13d

图4 2种结肠癌细胞中Wnt/β-catenin信号通路相关蛋白及N-cadherin表达的电泳图
3.5 毛萼乙素联合Wnt/β-catenin信号通路抑制剂对结肠癌细胞迁移率和β-catenin、N-cadherin、E-cadherin蛋白表达的影响
与对照组比较,毛萼乙素组2种结肠癌细胞的迁移率及β-catenin、N-cadherin表达水平均显著降低(P<0.01),E-cadherin表达水平显著升高(P<0.05或P<0.01)。与毛萼乙素组比较,毛萼乙素+XAV939组2种结肠癌细胞的迁移率及β-catenin、N-cadherin表达水平均进一步降低(P<0.05或P<0.01),E-cadherin表达水平进一步升高(P<0.01)。结果见图5、表3。
表3 2种结肠癌细胞中 β-catenin、N-cadherin、E-cadherin蛋白表达水平的检测结果(±s,n=3,%%)
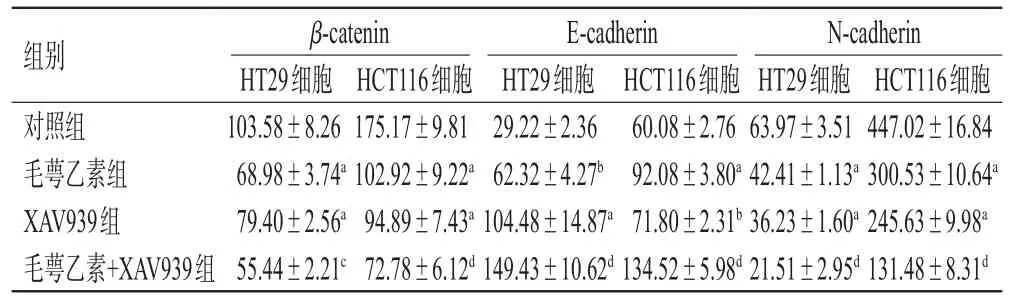
表3 2种结肠癌细胞中 β-catenin、N-cadherin、E-cadherin蛋白表达水平的检测结果(±s,n=3,%%)
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05;c:与毛萼乙素组比较,P<0.05;d:与毛萼乙素组比较,P<0.01
HCT116细胞447.02±16.84 300.53±10.64a 245.63±9.98a 131.48±8.31d组别对照组毛萼乙素组XAV939组毛萼乙素+XAV939组β-catenin HT29细胞103.58±8.26 68.98±3.74a 79.40±2.56a 55.44±2.21c HCT116细胞175.17±9.81 102.92±9.22a 94.89±7.43a 72.78±6.12d E-cadherin HT29细胞29.22±2.36 62.32±4.27b 104.48±14.87a 149.43±10.62d HCT116细胞60.08±2.76 92.08±3.80a 71.80±2.31b 134.52±5.98d N-cadherin HT29细胞63.97±3.51 42.41±1.13a 36.23±1.60a 21.51±2.95d
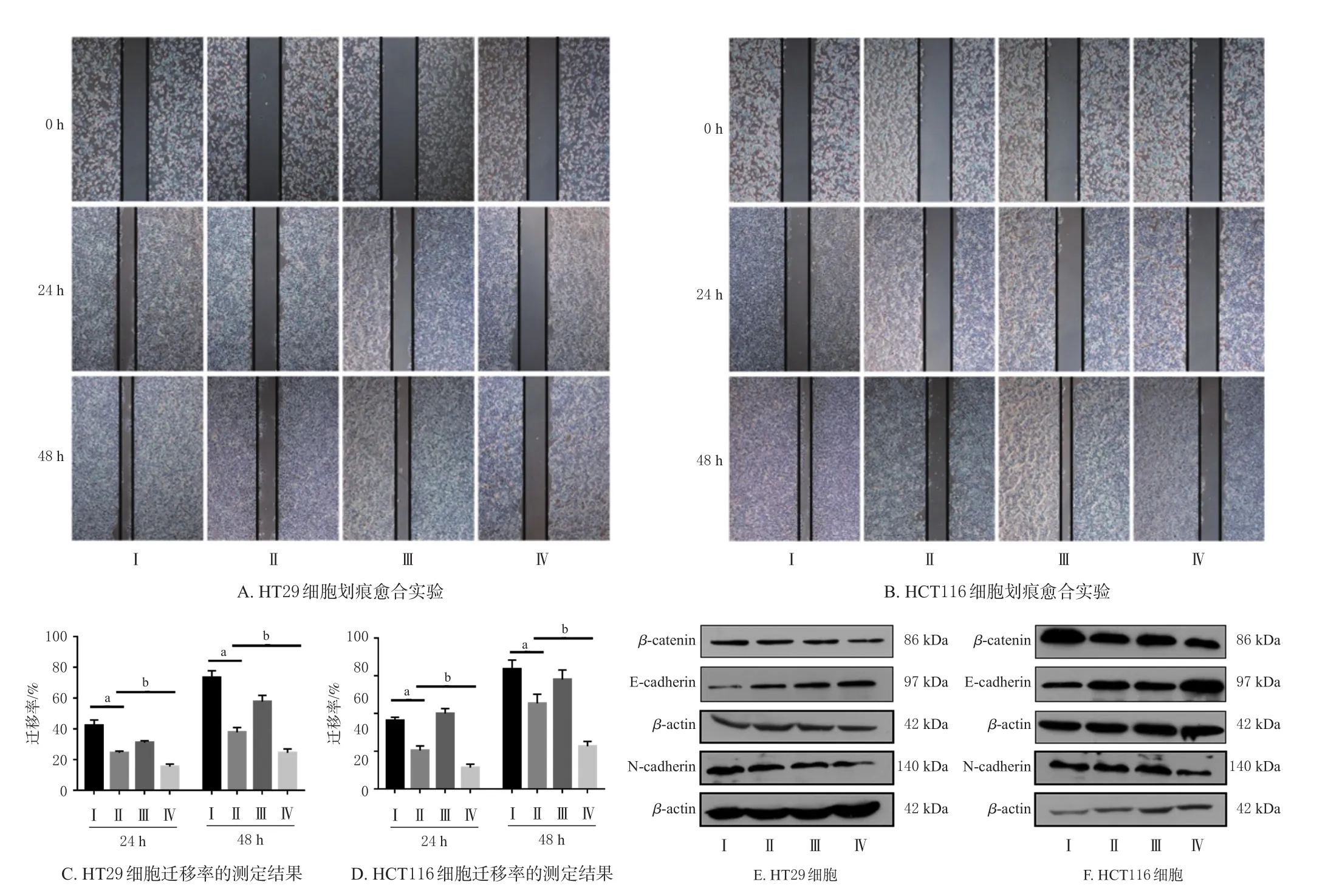
图5 毛萼乙素联合XAV939对2种结肠癌细胞迁移能力及β-catenin、N-cadherin、E-cadherin蛋白表达的影响
4 讨论
肿瘤转移是结肠癌相关死亡的主要原因[13―14],转移性结肠癌预后较差,传统的治疗方法如手术切除和化疗并不能有效防止肿瘤转移[15]。目前临床仍缺乏能够有效抑制结肠癌细胞转移的方案,因此,开发抗结肠癌细胞转移药物显得尤为重要。
细胞的侵袭和迁移是结肠癌发生转移的重要过程[16]。本研究通过划痕愈合实验和Transwell实验检测毛萼乙素抑制结肠癌细胞侵袭和迁移的能力,结果发现毛萼乙素能够显著降低结肠癌细胞的侵袭率和迁移率,且其迁移能力具有一定浓度和时间依赖趋势。
EMT是肿瘤细胞转移最主要的原因[17],故本研究检测不同浓度毛萼乙素处理结肠癌细胞后EMT相关蛋白的表达水平。结果发现,毛萼乙素能够抑制结肠癌间质细胞标志物N-cadherin以及与EMT呈正相关的转录因子Snail的表达,同时还能促进上皮细胞表型标志物E-cadherin的表达,这表明毛萼乙素可以抑制结肠癌细胞EMT。
目前研究显示,Wnt/β-catenin信号通路是调节结肠癌EMT的关键信号通路[18],且其在结肠癌中被高度激活[19―20],因此,抑制该信号通路活性对结肠癌的治疗具有重要作用。本研究通过检测Wnt/β-catenin信号通路相关蛋白β-catenin及其下游靶蛋白(c-myc、cyclin D1、TCF4)的表达情况,并通过利用该信号通路激活剂Licl进行功能回复实验,以探讨毛萼乙素抑制结肠癌细胞EMT是否与抑制Wnt/β-catenin信号通路激活有关。结果发现,毛萼乙素可以抑制Wnt/β-catenin信号通路相关蛋白的表达,且该抑制作用能被该信号通路激活剂Licl逆转,这表明毛萼乙素可通过抑制Wnt/β-catenin信号通路激活抑制结肠癌细胞EMT。
为进一步研究毛萼乙素在今后临床转化中的应用价值,本研究检测毛萼乙素与Wnt/β-catenin通路抑制剂XAV939的相互作用。结果发现,两者联用后,结肠癌细胞迁移率及β-catenin、N-cadherin蛋白表达水平进一步降低,这表明毛萼乙素与Wnt/β-catenin信号通路抑制剂XAV939之间存在协同作用。
综上所述,毛萼乙素可通过抑制Wnt/β-catenin信号通路激活抑制结肠癌细胞EMT。

