活体固相微萃取-气相色谱法测定小白菜中3种农药残留
孙鑫,张丹,张小帆,李秀娟
华中农业大学食品科学技术学院/环境食品学教育部重点实验室/果蔬加工与品质调控湖北省重点实验室,武汉430070
小白菜(Brassica chinensisⅬ.)是一种在我国广泛种植的绿叶蔬菜,占长江中下游蔬菜种植面积的30%~40%[1]。在种植过程中,农民通常会使用化学农药来控制和消灭小白菜病虫害,但由于缺乏对安全使用农药的认知,常造成蔬菜中农药残留超标,不利于人类健康。例如,氟虫腈及其代谢物砜可诱导人肝细胞死亡[2]。溴虫腈由于其高持久性对环境造成了很大的负面影响[3]。研究温度、光照、种植方式等环境行为对小白菜农药残留的影响可以更合理地施用农药,降低农药的残留水平、人类健康风险和环境风险。
农药残留分析通常包括样品制备和仪器测定2个步骤。其中,样品制备是一个关键步骤,它包括从样品中提取和富集目标物质,同时要尽量降低基质干扰。样品制备直接影响分析结果的准确性和精密度。传统的样品制备方法如固相萃取和液相萃取需要样品均质,然后进行萃取、分离和纯化,整个过程耗时且费力,并且需要大量的有机溶剂。最重要的是,这些样品制备方法对生物体是破坏性的,无法跟踪监测复杂生物体中残留物的动态变化,在采样过程中分析物可能还会损失或者发生形态变化。
近年来,研究者将目标转向了适合活体生物的样品预处理技术。活体固相微萃取(in vivosolidphase microextraction,in vivoSPME)技术[4]集采样、提取、浓缩和进样为一体,允许探针直接暴露于生物组织而不造成致命损伤,可以实现对生物个体中分析物的长期监测,并准确显示复杂生物体内内源性物质和外源性物质的动态变化情况。由于无需样品运输和存储步骤,可以提供更准确、快速的分析数据,从而更好地显示生命系统中的真实情况。Ⅼendor 等[5]采用液相色谱-质谱结合代谢组学方法,研究大鼠死亡后1 h 内影响其海马体的死亡诱导变化,使用固相微萃取探针对每只动物在活体和死后在相同大脑区域进行采样,结果发现在大鼠死亡后30 min脑神经化学发生显著变化,且随着死亡时间增加进一步变化。
本研究以采样速率法进行定量校正,建立了活体固相微萃取-气相色谱方法(in vivoSPME/GC),并通过直接固相微萃取-气相色谱方法(direct immersion solid-phase microextraction/gas chromatography,DI-SPME/GC)进行对比验证,对小白菜中常用的3种农药(百菌清、毒死蜱和氟虫腈)进行准确定量,探讨不同环境因素对小白菜中3 种农药消除动力学的影响,以及不同农药在小白菜可食用部位中的吸收、富集和消解,以期为植物活体中农药的跟踪监测及环境行为研究提供技术支持。
1 材料与方法
1.1 材料与试剂
1)小白菜(Brassica chinensisⅬ.)种子购自江苏宿迁景趣园艺店,种植在温度适宜、光照充足的室外盆装土壤中。将每株长有3~4 片叶子的幼苗从盆中取出,转移到盛有营养土的种植箱中继续栽培,1~2周后开始喷洒农药,开展试验。
2)主要试剂。甲醇、丙酮、乙腈购自国药集团化学试剂有限公司,均为分析纯。试验用水均为超纯水。市售农药百菌清(75%可湿性粉剂)购自浙江威尔达化工有限公司,毒死蜱标准品(99%)和氟虫腈标准品(99%)购自上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
GC-8850 型气相色谱仪器(电子捕获检测器,ECD),山东鲁南瑞虹化工有限公司;GC-8850系列气相色谱工作站,浙江大学智达信息工程有限公司;SE-54毛细管柱(30 m×0.32 mm×0.25 μm),兰州中科安泰分析科技有限公司;CT-1型氮氢空气发生器,武汉科林普丰仪器有限公司;自制SPME手柄;58 μm甲基丙烯酸-二乙烯基苯-N-乙烯基吡咯烷酮介孔分子筛萃取头(methacrylic acid-divinylbenzene-N-vinyl pyrrolirodone@mesoporous molecular sieve,MAA-co-DVB-co-NVP@MCM-41)参考文献[6]制备。
以高纯氮气为载气,流速1.0 mⅬ/min,空气0.095 MPa,氢气0.065 MPa,尾吹气0.075 MPa,分流进样,分流比为4∶1,电流0.5 nA。柱温:初始温度100 ℃,以20 ℃/min 升温至180 ℃,以10 ℃/min 升温至240 ℃,5 ℃/min 升至260 ℃,保持10 min,程序结束。进样口温度280 ℃,ECD检测器温度290 ℃。
1.3 试验方法
1)小白菜施药。百菌清农药(75%可湿性粉剂)按照1∶4 000 的比例兑水配制溶液,毒死蜱和氟虫腈使用标准品配制成质量浓度50 μg/mⅬ的溶液,用于小白菜施药。每次施药从上下前后左右对小白菜表面进行喷洒,尽量均匀分布。
2)DI-SPME 操作。准确称取一定量的小白菜,切段,按照料液质量比1∶3 添加超纯水,用料理机打浆。在10 g小白菜匀浆中添加50 μⅬ农药混标(百菌清0.5 mg/mⅬ、毒死蜱1 mg/mⅬ、氟虫腈1 mg/mⅬ),磁力搅拌15 min 混匀,4 ℃冰箱放置12 h。取10 g 配好的加标匀浆分装至10 mⅬ萃取瓶中,加入磁子,盖紧瓶盖。在1 200 r/min 的搅拌速度下60 ℃萃取40 min。萃取完成后,取出萃取头于超纯水中快速漂洗5 s,然后于280 ℃的GC 进样口解吸10 min,解吸完毕后以甲醇-丙酮(体积比1∶1)混合溶剂洗涤1 min,再使用无尘纸擦拭。将萃取头在280 ℃解吸5 min,继续分析下一个样品。
3)in vivoSPME 操作。首先使用22规注射针头插入小白菜茎中约2 cm 进行预打孔,拔出注射针后,将老化过的MAA-co-DVB-co-NVP@MCM-41 萃取头插入预先打好的小孔中。萃取一段时间后,拔出萃取头,用密封垫堵住针头使其处于密封状态,置于装有冰块的保温装置中迅速返回实验室,转入-18 ℃冰箱存放,待进样前取出于超纯水中快速漂洗2 s,使用无尘纸轻轻蘸干萃取头表面残留的水滴,随后在290 ℃GC 进样口解吸10 min。解吸过后使用甲醇-丙酮(体积比1∶1)混合溶剂清洗1 min,并使用蘸有上述混合溶剂的无尘纸小心擦拭涂层表面,然后在280 ℃下老化5 min,即可进行下一次萃取。
4)采样速率校准法。根据采样速率法[7]原理,样品的初始浓度C0由传统的直接SPME/GC-ECD 法求得,n为活体采样所得分析物的萃取量(配制系列浓度的标准溶液,直接以GC 检测绘制定量曲线而确定),采样时间t已知。根据上述数据,可以求得活体采样速率Rs,用于计算活体样品中分析物的浓度。
1.4 不同光照条件下小白菜的农药降解试验设计
按照本文“1.3”,将配制好的100 mⅬ农药混合溶液对2箱小白菜进行施药。施药后,分别放置在室外阳光直射处和室内阴凉通风处,在施药后2、6、12、24、36、48、60、72 和96 h 进行测定。每次取小白菜周围均匀分布的3 个点同时采样,视为3 个平行,采样时间为20 min,将活体采样后的萃取头带回实验室检测。分别求出小白菜在光照和无光照条件下的消解曲线和消解半衰期。小白菜中单一农药消解过程中的浓度采用一阶动力学方程计算,同时可得消解半衰期(t1/2)[8]。
1.5 不同温度下小白菜的农药降解试验设计
按照本文“1.3”方法,将配制好的100 mⅬ农药混合溶液对3箱小白菜进行施药,分别放置在40、25 和8 ℃下,于施药后2、6、12、24、32、36、48、60、72 和96 h采样。
1.6 不同培养方式下小白菜的农药降解试验设计
水培方式:试验前1 d,将小白菜植株从土壤中取出,用去离子水洗涤其根系,然后转移至添加了营养液的水中进行培养。24 h后,在营养液中加入农药混合溶液,培养液中每种农药质量浓度均为10 μg/mⅬ,对照组小白菜在不加标但加营养液的水中培养,确保仅菜根与溶液接触。分别在小白菜暴露于加标溶液后的12、24、36、48 和72 h 测量植株茎中的农药质量浓度。暴露72 h 后将植株转移到另一不加标但加营养液的溶液中进行降解试验,之后每隔12 h 采用in vivoSPME/GC 法跟踪测定茎中3 种农药的浓度,直至试验结束。
土培方式:小白菜的试验步骤同本文“1.5”,常温下进行。对比2 种培养方式小白菜对3 种农药的吸收和降解情况。
1.7 不同贮藏温度下采后小白菜的农药降解试验设计
将配制好的100 mⅬ的农药混合溶液按照本文“1.3”的方法对小白菜进行施药,施药24 h 后采摘并带回实验室,分别在常温(20 ℃)贮藏和低温(4 ℃)贮藏。在贮藏过程中的第12、24、36、48、72、96、120 和168 小时进行原位固相微萃取采样,操作同in vivoSPME。采样后,萃取头立即插入GC 进样口进行检测。
1.8 数据处理
试验数据如未作说明,均为3 次测定的平均值。数据处理采用Excel 和SPSS 26 软件进行分析,绘图采用Origin 2018 版本软件。采用ANOVA 进行方差分析,显著性方差分析法为ⅬSD,α=0.05。
2 结果与分析
2.1 萃取头使用寿命的评价结果
通过计算同一根萃取头在试验过程中反复萃取相同加标浓度的小白菜样品的峰面积,得到使用12、24、39、54、75次的萃取结果,如图1所示,萃取峰面积有小幅度的波动,但是在使用75 次后没有明显的下降,不同萃取次数间结果无显著性差异。由此可以看出,该萃取头可以在复杂的真实样品基质中连续萃取75次以上,具有较长的使用寿命,可用于真实样品检测。
2.2 3种农药的活体采样速率
由于SPME 是一种非完全萃取技术,萃取涂层的容量远远小于样品体积,且采样时间短,从样品基质中萃取出分析物的量极少,采样后样品中目标分析物的浓度可以保持不变。因此,在活体SPME 采样后再通过直接固相微萃取/气相色谱方法(DISPME/GC)测定植株中农药含量C0。根据采样速率公式(1)计算了活体采样速率Rs,结果见表1。
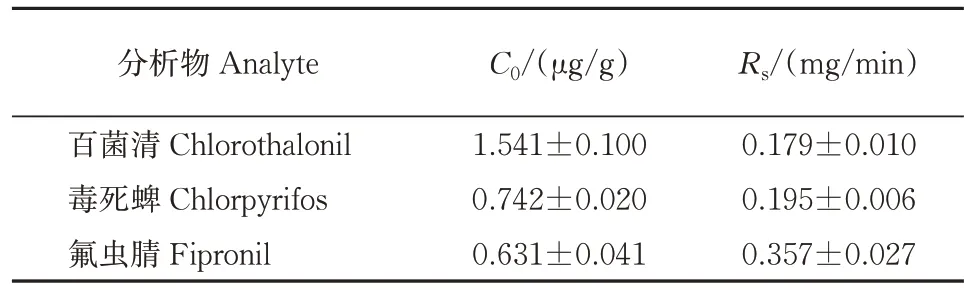
表1 3种农药在小白菜中的活体采样速率Table 1 in vivo sampling rates of three pesticides in pakchoi
2.3 不同检测方法的对比评价结果
依据3 倍信噪比计算in vivoSPME/GC 方法的检出限(ⅬOD),10 倍信噪比计算定量限(ⅬOQ)[9]。小白菜中百菌清、毒死蜱和氟虫腈的ⅬOD 分别为1.28、0.37 和0.19 μg/kg,其ⅬOQ 分别为4.27、1.23 和0.63 μg/kg。该方法具有较低的检测限,证明其具有较高的灵敏度,且远低于食品安全国家标准中农药的最大残留限量值(百菌清5 000 μg/kg、毒死蜱20 μg/kg 和氟虫腈20 μg/kg),能够满足检测要求。较低的RSDs 值(3.61%~11.94%)表明in vivoSPME采样方法的重复性较好。将in vivoSPME/GC 检测方法与文献中检测方法进行对比,结果如表2 所示。in vivoSPME 技术相较于QuEChERs、ⅬⅬE 以及石墨烯量子点荧光检测等技术而言灵敏度更高,且不需要复杂的前处理过程,更为方便、快捷和环保;同时具有可接受的RSD,方法精密度良好。通过与DISPME/GC 方法的比较,验证了in vivoSPME/GC方法的准确性。
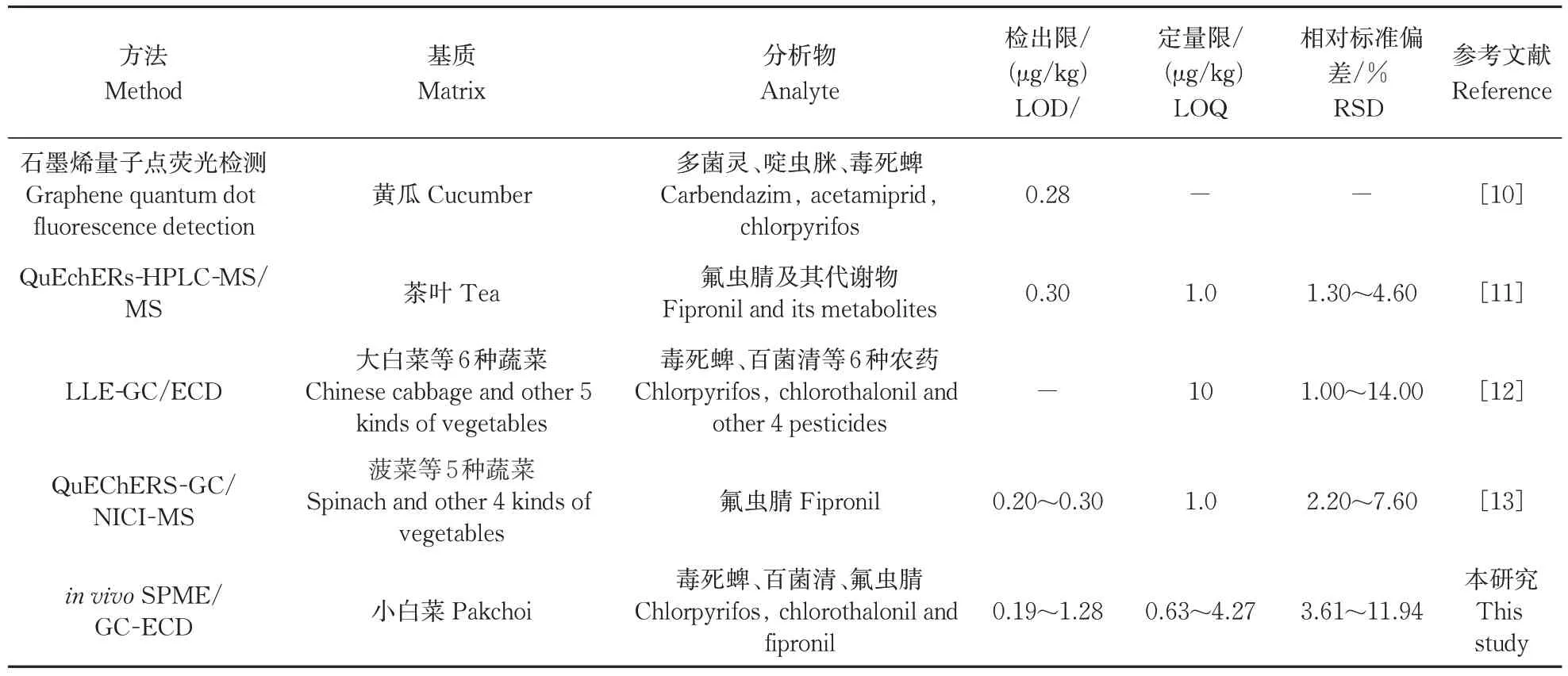
表2 本方法与其他文献中的农药检测方法对比Table 2 Comparison of the proposed method with other methods reported in literature for determination of pesticides
在监测过程中,同时采用in vivoSPME、DISPME 2 种方法测定小白菜中农药含量。如表3 所示,2种方法测定的小白菜中农药含量相似,说明in vivoSPME具有良好的准确性和可行性。此外,该方法还极大简化了试验步骤,比DI-SPME/GC法以及传统的ⅬE/GC法更方便、更高效、更快速。

表3 in vivo SPME和DI-SPME在不同监测时间测定的小白菜中3种农药含量对比Table 3 Comparison of the content of 3 pesticides in pakchoi obtained by in vivo SPME and DI-SPME at different monitoring time μg/g
图2为in vivoSPME/GC 方法测定小白菜中3种农药的气相色谱图。由图2 可见,该方法对于小白菜中不同质量浓度的3 种农药均能检出,具有较低的检出限和较高的灵敏度。
2.4 光照对小白菜农药降解的影响
图3 为in vivoSPME 采样方法监测小白菜分别在室内阴凉通风处和室外强光下农药的吸收与消解曲线。由图3 可知,小白菜对于3 种农药的吸收均在24 h 内达到最大值,室外光照下百菌清、毒死蜱和氟虫腈的最高含量分别为0.13、0.71 和1.11 μg/g,室内条件下最高含量分别为0.10、0.75 和1.69 μg/g。之后开始消解。通过非线性拟合曲线方程(R2的范围为0.927 6~0.986 1)得到百菌清、毒死蜱和氟虫腈在室内条件下的消解半衰期分别为14.35、2.23 和15.36 d;在室外强光照射下的消解半衰期分别为1.63、0.27 和0.78 d。结果表明,3 种农药在强烈光照条件下的消解速率要远远快于室内阴凉条件下,不同的物质受光照影响不同,氟虫腈受光照影响最大。
2.5 温度对小白菜农药降解的影响
图4 为in vivoSPME 采样方法监测小白菜分别在8、25 和40 ℃下农药的吸收与消解曲线,分别模拟了冬季、春秋季和夏季环境温度条件,探究温度对3种农药降解的影响。8 ℃下百菌清、毒死蜱和氟虫腈的最高含量分别为3.68、0.59 和4.08 μg/g,25 ℃的最高含量分别为3.12、0.99 和1.69 μg/g,40 ℃的最高含量分别为1.00、0.30 和1.43 μg/g,温度越高,最大残留含量越低。通过非线性拟合曲线方程(R2为0.919 8~0.975 0)得到百菌清在8、25 和40 ℃下的消解半衰期分别为4.11、0.46 和0.45 d;毒死蜱的消解半衰期分别为2.66、1.90 和0.51 d;氟虫腈的消解半衰期为4.97、4.07 和2.83 d。结果表明,3 种农药在小白菜中的半衰期均随温度的升高而缩短,温度越高,降解速率越快。
2.6 不同培养方式小白菜中农药的吸收与消解
由图5可以看出,在土培方式下通过叶面喷洒施药后毒死蜱在1.5 d 后达到最高含量6.15 μg/g,百菌清和氟虫腈在第2天达到最高含量5.77和2.51 μg/g,之后开始消解。而水培方式下通过水中添加3 种农药均在第3.5天达到最高含量0.37、0.44和0.51 μg/g,说明通过叶面喷洒方式,小白菜对3种农药的吸收速率更快。百菌清、毒死蜱和氟虫腈在土培方式下半衰期分别为0.45、0.66 和0.22 d,而水培方式下消解半衰期分别为2.51、0.80 和4.07 d,说明土培方式的小白菜消解速率比水培方式更快。
由表4 可见,通过水中添加农药的方式进行施药,百菌清在施药后第1 天在茎部的含量大于叶面的,经过一段时间内的迁移后,在跟踪的第8 天叶面的含量高于茎部的。同样,通过叶面喷洒施药后百菌清在叶面的含量于第1 天高于茎部的,第8 天仍高于茎部的,说明百菌清更容易残留在小白菜的叶面部位。而毒死蜱和氟虫腈通过水中施药时茎部含量高于叶面的,但通过叶面喷洒施药时叶面含量反而高于茎部的,检测结果随施药方式不同而变化,没有呈现出明显的倾向性,也可能是跟踪时间不够长。

表4 2种施药方式下3种农药在小白菜中的分布Table 4 Distribution of three pesticides in pakchoi by two application methods μg/g
2.7 贮藏温度对农药消解的影响
图6 为原位SPME 监测小白菜分别在模拟冷藏(4 ℃)和常温(20 ℃)贮藏温度条件农药的吸收与消解曲线,显示了贮藏温度对3 种农药降解的影响。4 ℃下百菌清、毒死蜱和氟虫腈的最高含量分别为39.97、4.45 和2.75 μg/g,25 ℃的最高含量分别为100.04、5.46和13.94 μg/g。
由图6可见,百菌清和氟虫腈在不同温度下的最高含量差异很大,施药24 h 后采摘的小白菜表面仍附着有一定量的百菌清,在贮藏期间会持续地被吸收进植株内,而氟虫腈具有中度内吸作用,能不断被作物吸收并在体内传导。此外,通过非线性拟合曲线方程(R2为0.847 2~0.985 6)得到百菌清在4 ℃和20 ℃下的消解半衰期分别为3.66 和3.75 d;毒死蜱为4.37 和18.97 d;氟虫腈为4.97 和14.29 d。以上结果表明,贮藏温度对于百菌清的消解速率影响不大,但对毒死蜱和氟虫腈具有显著影响,低温能够延缓毒死蜱和氟虫腈的消解。
3 讨论
本研究建立了一种快速、准确、灵敏、非破坏性的in vivoSPME/GC 方法,应用该方法对不同环境影响中的小白菜中3种农药进行监测,研究不同环境因素(温度、光照、种植方式)对小白菜中3种农药(百菌清、毒死蜱和氟虫腈)环境行为的影响。
光照和温度是影响小白菜生长期农药降解的关键因素。3 种农药在强烈光照条件下的消解速率远远快于室内阴凉条件下,这可能是日晒过程中农药发生了热解和光解,农药分子在直接或间接吸收光能后,分子内的C—C、C—H、C—O 和C—N 等键会发生断裂并形成新的转化产物。也可能是不直接吸收光的辐射能量,而是借助其它物质作为载体,通过载体将光能转移给农药分子引起分子激发,或是载体自身发生反应产生中间体,然后中间体再与农药分子发生作用[14-16]。温度越高,3 种农药在小白菜中的降解速率越快,这与其他科研人员的研究结果一致[17-18]。一方面,环境温度高可以增加药液中农药的挥发从而降低其浓度,施用农药前期药液会大量挥发,挥发的速度随着温度的升高加快。另一方面,高温可以加快生物体内的化学反应速率和微生物活动,从而促进农药降解[19]。
施加农药的方式会影响小白菜对农药的吸收和降解。叶面喷洒3 种农药的吸收速率比根部施药更快,且叶面喷洒3 种农药最高含量均高于水中施药的,原因可能在于叶面喷洒是将农药直接喷到植株表面,小白菜可以将表面农药直接吸收到茎叶中,而水中施加的农药从培养液转运到茎部和叶面需要一定时间,且蔬菜可以释放一些物质来加速农药在水溶液中的降解[20]。土培小白菜中3 种农药的消解速率更快,可能是因为土壤中存在多种微生物能够促进农药的降解[21]。
环境温度除了在采前影响植物中农药的消解,在采后贮藏中对农药降解也有一定影响。贮藏温度对于百菌清的消解速率影响不大,而低温能够延缓毒死蜱和氟虫腈的消解。原因在于,一方面,百菌清在植物体表上具有良好的黏着性[22];另一方面,较高的温度会促进植物体对农药的吸收[23],低温能够降低酶活性和抑制微生物,从而降低农药的消解速率[24]。3 种农药相比较而言,百菌清的稳定性最差,氟虫腈在4 ℃条件下的稳定性最好,毒死蜱在常温和4 ℃条件下均比较稳定。

