石金钱龟板来源的寡肽与环氧合酶-2相互作用机制
闫佳兴,张久亮
华中农业大学食品科学技术学院/环境食品学教育部重点实验室,武汉430070
环氧合酶-1(cyclooxygenase-1,COX-1)和环氧合酶-2(cyclooxygenase-2,COX-2)是2 种同工酶,COX-1 在健康组织中表达维持机体的正常运转,而COX-2 几乎只在组织受到伤害刺激后才大量表达,参与炎症和疼痛等过程[1]。特异性抑制COX-2 可有效阻止炎症和疼痛反应,常用的COX-2 抑制剂包括布洛芬和对乙酰基苯酚等,但这些药物对胃肠道、心血管、肾脏、肝脏等器官可能造成一定程度的损害,尤其是胃肠道损伤最为常见[2]。严重的不良反应已经导致了罗非昔布与依托昔布的退市[3]。因此,目前亟需寻找新型的COX-2抑制剂。
石金钱龟是一种淡水龟,主要分布在日本、越南和中国中南部,是一种高价值的功能性食品[4]。《本草纲目》和近期研究均表明,一些龟板提取物具有良好的抗氧化、抗炎和消肿止痛等作用[5-6]。其他研究表明有脯氨酸或精氨酸残基的寡肽除具有良好活性外还具有抗酶解特性[7],可通过胃肠道吸收入血液循环,进而对相关疾病靶点起作用[8-9]。因此,人们对天然产物中寡肽的研究和开发越来越重视。笔者所在研究团队前期已证明石金钱龟板来源的肽为2~9 个氨基酸残基的具有良好抗氧化、抗炎等活性的寡肽[10-11],尤其其中的合成寡肽单体分子KNGP 含脯氨酸残基、RG 含有精氨酸残基,可能具有优良的抗酶解特性和更高的吸收效率。然而,龟板肽对抗炎靶点之一COX-2 的潜在抑制作用及其机制尚不明确。
因此,本研究利用团队前期以石金钱龟来源的龟板肽[10]和合成寡肽单体分子(KNGP 和RG)进行抑制试验,并利用荧光光谱和分子对接探究KNGP对COX-2的抑制机理,分析寡肽KNGP对COX-2的抑制作用和构效机制,旨在为探究寡肽分子的抗炎作用提供理论基础。
1 材料与方法
1.1 材料与试剂
1)材料。石金钱龟板肽(yellow pond turtle peptides,YPTP)(肽含量72.16%)由笔者所在研究团队前期制备[10],试验中所使用石金钱龟板的肽段Ⅼys-Asn-Gly-Pro(KNGP)和Arg-Gly(RG)的结构为团队前期鉴定[10],由生工生物工程(上海)股份有限公司合成,纯度大于98%。
2)试剂。试验中所使用的试剂均为分析纯,所使用水为去离子水。COX-2(美国Sigma-Aldrich 公司),8-苯胺基萘-1-磺酸(美国Sigma-Aldrich 公司),花生四烯酸(AA,上海阿拉丁生化科技股份有限公司),N,N,N,N-四甲基对苯二胺盐酸盐(TMPD,上海源叶生物科技股份有限公司),正铁血红素(Hematin,猪,美国Sigma-Aldrich 公司),Tris(北京兰杰柯科技有限公司),氢氧化钾和二甲基亚砜(国药集团化学试剂有限公司)。
1.2 仪器与设备
KNGP 的结构用ChemDraw 7.0 软件绘制。KNGP 与COX-2 的分子对接选择Discovery Studio 2018 软件(华中农业大学农业微生物学国家重点实验室)。紫外可见分光光度计(日本岛津公司),荧光光谱仪F-4600(日本Jasco公司)。
1.3 IC50值的测定
根据Shang 等[12]和曹艳花等[13]报道的方法进行适当的修改。首先,用0.1 mol/Ⅼ的Tris-HCl 缓冲液(pH 7.8)将COX-2稀释制成25 U/mⅬ溶液。设置样品组、样品对照组、空白对照组和空白背景组,样品对照组是以缓冲溶液代替样品溶液,空白对照组是以缓冲溶液代替酶,空白背景组以缓冲溶液代替样品和酶。将140 μⅬ的缓冲溶液、20 μⅬ的COX-2 溶液、10 μⅬHematin(2.5%)分别与不同浓度的样品混合均匀,在25 ℃下孵化5 min。随后,添加10 μⅬ的21 μmol/Ⅼ的N,N,N,N-四甲基对苯二胺盐酸盐(TMPD)和100 μmol/Ⅼ花生四烯酸(AA)来启动反应。在25 ℃下反应20 min 后,使用紫外可见分光光度计在590 nm 处记录吸光度值。所有试验重复3次。用式(1)计算抑制率:
式中,Dcontrol是空白对照组的吸光度;Dcontrolblank是空白背景组的吸光度;Dsample是样品组的吸光度;Dsampleblank是样品对照组的吸光度。最后,利用SPSS 26.0 对得到的数据进行非线性回归分析得到半数抑制浓度(IC50)值。
1.4 内源荧光光谱测定
蛋白质中由于氨基酸残基色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的存在而具有内源荧光[14],进行荧光猝灭试验可以获得KNGP与COX-2之间的结合机制、结合位点、结合力和热力学参数等相互作用的特征[15-16]。使用Stern-Volmer 方程分析荧光猝灭数据,以研究其猝灭类型[17-18]。
基于KNGP 对COX-2 是静态猝灭的结果,我们假设KNGP 能与COX-2 的活性位点结合形成配体-蛋白质的基态配合物,根据文献[17-18]中的公式计算配合物的结合位点数(n)和表观结合常数(Ka),Ka值越大,配合物的紧密程度和稳定性越强[17-18]。
荧光猝灭分为静态猝灭和动态猝灭2 种方式[19-20]。当猝灭类型是静态猝灭时,KNGP 与COX-2 的结合过程依赖于静电相互作用、氢键、疏水相互作用和范德华力等。根据上述3 个温度下的Ka值,采用Van't Hoff 方程求得焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)[21]。
当ΔH<0、ΔS<0 时,主要驱动作用是氢键;当ΔH>0、ΔS>0时,主要驱动作用是疏水相互作用;当ΔH<0、ΔS>0 时,主要驱动作用是静电作用[22-23]。在200 μⅬ的反应体系中,加入150 μⅬ溶解于Tris-HCl 缓冲液(pH 7.8)的COX-2(10 U/mⅬ),之后分别逐次加入50 μⅬ的IC50值最低的肽段(KNGP)溶液,分别控制终浓度为0.00~0.50 mmol/Ⅼ。然后采用F-4600 荧光光谱仪测定各样品的内源荧光光谱。其中,设置激发波长280 nm,发射波长350~500 nm,狭缝宽度设定为5 nm,扫描速度设定为1 200 nm/min,电压设定为700 V。所有测定均重复3次。
1.5 同步荧光光谱测定
当同步荧光的波长间隔(Δλ)设置为15 和60 nm时,可以分析COX-2 中的酪氨酸和色氨酸残基的光谱变化,从而阐明COX-2 的构象变化[24]。按照本文“1.4”的试验方法(溶液的量与浓度相同)在298 K 下进行同步荧光光谱的测定。分别设定Δλ=15 nm 和Δλ=60 nm,狭缝宽度设定为5 nm,扫描速度设定为1 200 nm/min,电压设定为700 V,进行同步荧光光谱扫描。所有测定均重复3次。
采用文献[25]中的公式计算KNGP对COX-2的同步荧光猝灭率(ratio of synchronous fluorescence quenching,RSFQ)。
1.6 三维荧光光谱测定
利用三维荧光光谱可以分析KNGP对COX-2构象的影响[24-25]。按照本文“1.4”的方法制备COX-2溶液与KNGP 溶液。在室温条件下,将样品稀释至200 倍后,以200 nm 为起始激发波长,200~500 nm为连续扫描记录发射波长,狭缝宽度设定为5 nm,扫描速度设定为1 200 nm/min,电压设定为700 V。所有测定均重复3次。
1.7 表面疏水性的测定
8-苯胺基萘-1-磺酸(8-anilino naphthalene-1-sulfonic acid,ANS)是一种疏水性探针,能在与蛋白质的表面疏水基团相互反应时,增强其荧光光度值,可以常用来反映表面疏水性的变化[26]。表面疏水性的变化通常反映酶的构象变化[27]。将按照本文“1.4”方法制备的COX-2 溶液与KNGP 溶液,混合均匀后静置10 min,加入10 μⅬ的0.10 mmol/Ⅼ的ANS 溶液,在298 K 下避光20 min。设定激发波长390 nm,发射波长420~570 nm,激发狭缝5.0 nm 和发射狭缝2.5 nm。分别以相对应的KNGP-缓冲溶液体系的荧光发射光谱作为空白背景信号。所有测定均重复3次。
1.8 分子对接
分子模拟对接是研究分子之间特别是生物分子复合物(如药物与受体)之间相互作用的一种有效方法,它能获得配体和受体结合构象、位点和作用力等信息[28]。本研究分子对接过程和结果分析均采用Discovery Studio 2018 软件进行。COX-2(PDB ID:3NT1)的晶体结构取自Protein Data Bank 蛋白质数据库,KNGP肽段的结构由ChemDraw 7.0,软件绘制好的结构导入Discovery Studio 2018 软件中,利用Small Molecules 模块下Prepare Ⅼigands 工具处理。分别利用Discovery Studio 2018 对COX-2 进行去水与加全氢等预处理。分子对接结果的ROC曲线图可以分析分子对接的打分函数,X轴越接近零,准确率越高;Y轴越大代表准确率越好。曲线越接近左上角(X越小,Y越大),即曲线下面积越大,预测准确率越高[29]。基于与参考文献[30]对比结合酶的配体位置获得对接位点的信息。COX-2 的活性位点由Arg120、Glu524 和Tyr355 三个氨基酸残基组成,活性位点周围还包括有一些氨基酸残基如:Ⅼys83、Tyr115、Ser119、Val89、Pro86、Ⅼeu93、Ⅼeu123[31]。随后利用CDOCKER 对接方法对接,其他参数采取默认值,根据结合能大小对结果进行排序和可视化分析。
1.9 数据统计与分析
本试验每组数据均做平行重复试验3 次,以“平均值±标准差”表示。利用SPSS 17.0软件进行显著性分析,P<0.05 为差异显著。采用Origin 8.0、Discovery Studio 2019 等软件绘图与荧光光谱数据分析。
2 结果与分析
2.1 不同样品的IC50值分析
3 种寡肽样品(石金钱龟板肽YPTP、合成肽段KNGP 和RG 样品)对于COX-2 的抑制率如图1 所示,由非线性回归分析得到3种寡肽样品和阳性药布洛芬的IC50值,分别为0.609、0.046、0.056 和0.217 mg/mⅬ。其大小排序为KNGP<RG <阳性药布洛芬<石金钱龟板肽YPTP(72.16%)。这些样品中KNGP 的IC50值最小,表明KNGP 对COX-2 具有极显著的抑制潜力。因此,选用KNGP 进行后续的荧光光谱试验,探究肽段KNGP对COX-2的抑制机制。
2.2 内源荧光光谱分析
1)荧光猝灭分析。图2 所示为KNGP 与COX-2在298 K 下的荧光发射光谱。随着KNGP 浓度的增加,COX-2的荧光强度减小,表明COX-2发生荧光猝灭现象。从而表明KNGP与COX-2之间发生了相互作用,使得酶的微环境发生了变化。如图3 所示,在不同温度(298、304、310 K)下拟合的曲线为线性,表明由KNGP 造成COX-2 的荧光猝灭类型是单一的。如表1 所示,由斜率可计算出Kq值,YPTP 对于COX-2的不同温度的Kq值分别远大于最大扩散碰撞猝灭常数[2.0×1010Ⅼ/(mol·s)],呈现出静态猝灭的特征;同时,随着温度升高(298、304 和310 K)导致KNGP-COX-2 复合物的猝灭常数(Ksv)降低(分别为2.09×104、1.51×104和1.31×104Ⅼ/mol),即温度越高,配合物的稳定性降低,呈现出静态猝灭的特征,所以YPTP对COX-2的荧光猝灭方式为静态猝灭。
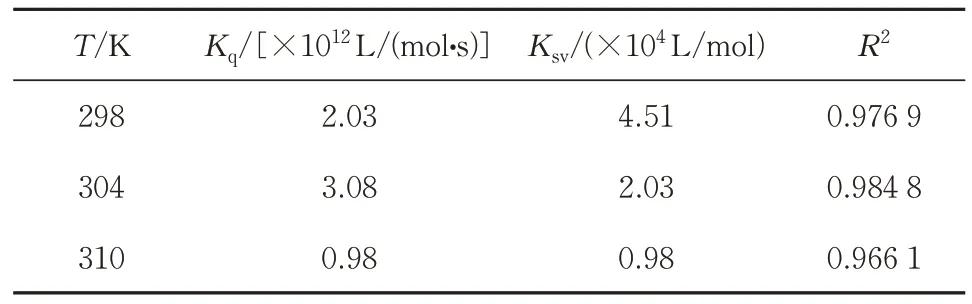
表1 不同温度下KNGP对COX-2的猝灭常数Table 1 Quenching constants of KNGP on COX-2 at three temperatures
2)结合常数和结合位点。如图4 所示,lg[(F0-F)/F]与lg[Q]拟合的298、304 和310 K 温度下的双对数回归曲线是线性的。不同温度下计算结果见表2。不同温度下COX-2的n值接近1,这意味着COX-2 上仅存在单一结合位点供KNGP 结合。此外,COX-2 和KNGP 在不同温度下的Ka值分别为4.3×104、7.5×104和12.5×104Ⅼ/mol。随着温度升高,配合物Ka值变大,这反映出KNGP 和COX-2 相互作用的稳定性升高。

表2 不同温度KNGP对COX-2的结合常数和结合位点数Table 2 Binding constant and binding number of KNGP on COX-2 at three temperatures
3)热力学参数特征。表3 列出了KNGP 和COX-2的热力学参数。KNGP与COX-2相互作用的ΔH和ΔS均为正值,表明结合过程中疏水作用是主要驱动作用。ΔS>0 和ΔG<0,表明KNGP 与COX-2之间的相互作用是熵驱动的自发过程。

表3 不同温度KNGP对COX-2的热力学参数Table 3 Thermodynamic parameters of KNGP on COX-2 at three temperatures
2.3 同步荧光光谱分析
在KNGP 存在下COX-2 的同步荧光光谱如图5所示。在Δλ=15 nm 时(图5A),KNGP 浓度的增加导致COX-2 中酪氨酸残基的荧光强度降低,证实了荧光猝灭现象,且最大发射波长从285.6 nm 蓝移到284.4 nm,表明加入KNGP 使得COX-2 的酪氨酸残基周围的疏水性增强,极性减弱。如图5B 所示,色氨酸残基的荧光强度降低,同样证实了荧光猝灭现象,其最大发射波长从280.6 nm 蓝移到279.2 nm,同样地表明色氨酸残基所处微环境的疏水性增强,极性减弱。酪氨酸残基和色氨酸残基的微环境变化一致,进一步计算2 种氨基酸残基的同步荧光猝灭率(RSFQ),比较具体结合位点与2 种残基的相对位置。
KNGP 对COX-2 的RSFQ 曲线如图6 所示,在0.09、0.19、0.28、0.38 mmol/Ⅼ4种浓度的情况下酪氨酸的RSFQ 值大于色氨酸的RSFQ,说明酪氨酸残基在KNGP 引起COX-2 的荧光猝灭中贡献较大。因此,在与COX-2的结合过程中,KNGP 结合位置可能更接近酪氨酸。
2.4 三维荧光光谱分析
KNGP-COX-2配合物的三维荧光等高线图如图7 所示。峰a 为瑞利散射峰(λem=λex),峰1 为酪氨酸和色氨酸残基的特征峰,峰2 主要为COX-2 中氨基酸π→π*跃迁引起的特征峰。如图7A、7B,对于COX-2,加入KNGP 后峰1 荧光强度从335.8 下降到52.52,峰位置发生了约10 nm 的轻微蓝移,表明KNGP 与COX-2 结合位点靠近酪氨酸残基,KNGP与酶相互作用后蛋白质周围微环境疏水性增强,极性减弱。同时,峰2 的荧光强度也有所降低,荧光强度从186.0 下降到29.41,表明KNGP-COX-2 复合物的形成可能影响蛋白质的二级结构,并导致COX-2构象的松散。
2.5 表面疏水性变化分析
KNGP对COX-2表面疏水性的影响通过COX-2中ANS 荧光强度变化来表示。如图8 所示,KNGP的加入导致COX-2的表面疏水性降低。KNGP 可能与COX-2 的活性位点的亲水基团相互作用,导致酶活性位点内的疏水性基团暴露,从而引起COX-2 表面的亲水基团暴露,使得COX-2的构象发生变化,抑制底物与COX-2的结合。
2.6 分子对接结果
1)分子对接ROC 曲线分析。基于ROC 曲线(图9)比较,可以看到-CDOCKER ENERGY(-ECD)曲线下面积最大,证实负的受体-配体间的总能量-ECD和负的受体-配体相互作用能量-CDOCKER INTERACTION ENERGY(-IECD)能够较好地区分活性和非活性分子,可以作为此次分子对接的打分函数,且-ECD更能较好地体现分子的活性。其最终计算结果,对应-ECD值越高,说明受体与配体间的总能量越低,对接体系越稳定。
2)分子对接函数打分结果。本研究采用CDOCKER 分子对接模式进行模拟,通过模拟退火得到了KNGP、阳性对照(布洛芬和对乙酰氨基酚)的多个可能的构象,从中选择其中总能量最低的模拟结果进行分析和比较。如表4所示,在模拟对接的KNGP、布洛芬和对乙酰氨基酚的-ECD 打分分别为250.44、117.25和61.53 kJ/mol,反映出的相互作用强度由大到小排列为KNGP >布洛芬>对乙酰氨基酚。可以看出,KNGP 对COX-2 的抑制作用好于阳性药物对照布洛芬和对乙酰氨基酚。表明KNGP 可能有很好的COX-2抑制活性。

表4 KNGP、阳性对照(布洛芬和对乙酰氨基酚)与COX-2的对接打分结果Table 4 Results of molecular docking between KNGP,positive controls(ibuprofen and acetaminophen)and COX-2
3)分子对接可视化分析。分子对接的可视化结果如图10A 所示,KNGP 寡肽能对接到COX-2 活性位点内,其ECD 值和IECD 值分别为-250.44和-201.59 kJ/mol,表明KNGP 与COX-2 活性位点能更好地结合。同时,2D 图(图10B)提供了KNGP与特定氨基酸残基相互作用的详细信息。KNGP 与COX-2 的氨基酸残基Arg216(2.80、2.37 和1.96 Å)、Asp239(2.07、2.50 Å)、Glu140(2.54 Å)、Tyr147(2.12 Å)、Ⅼeu238(2.87 Å)和Ser143(1.83 Å)相互作用形成了9 个氢键,其吡咯烷结构与Phe220 形成疏水作用。此外,分子与蛋白残基Glu140 还存在静电相互作用(盐桥和电荷吸引),与Ser143、Asn144、Thr237、His133形成范德华力,这些相互作用加强了其结合稳定性,也证明了KNGP-COX-2 配合物结合后的主要作用力是氢键。上述研究结果说明KNGP有望成为COX-2 分子的抑制剂。总之,KNGP 主要由NH基团、C=O结构、吡咯与酶活性中心的氨基酸残基相互作用形成氢键和疏水作用,并且能与活性中心附近的氨基酸残基结合形成静电作用增强结合的稳定性。结合荧光光谱试验的热力学参数分析,表明KNGP-COX-2 配合物形成过程的驱动力为疏水作用,而KNGP-COX-2 配合物形成后的主要作用力是氢键。
3 讨论
根据KNGP 对COX-2 荧光猝灭数据的分析,KNGP 对COX-2 的荧光猝灭机制为静态猝灭,即KNGP 可能与COX-2 的单一位点结合形成配合物,导致荧光猝灭作用。COX-2 和KNGP 在298 K(4.3×104Ⅼ/mol)、304 K(7.5×104Ⅼ/mol)和310 K(12.5×104Ⅼ/mol)下作用的Ka值大于新型芳基异丙酸类化合物(3.08×104、3.92×104和5.40×104Ⅼ/mol)[22],同时,COX-2 和KNGP 的Ka值在104~105,与保泰松(1.95×104、1.25×105、9.82×104Ⅼ/mol)和布洛芬(1.19×104、2.13×105和8.09×104Ⅼ/mol)的Ka值相似[32]。Ka值越大,配合物的紧密程度和稳定性越强[18]。由此可见,KNGP-COX-2的配合物有很强的结合力和稳定性,因此,KNGP 对COX-2 活性的抑制作用较强。不仅如此,随着温度升高,配合物Ka值变大,这反映出KNGP 和COX-2相互作用的稳定性升高[25]。进一步计算得到热力学参数特征,其结果ΔH>0(ΔH=6.85×104kJ/mol)、ΔS>0(ΔS=2.42 ×102J/(mol·K))、ΔG<0(ΔG=-3.60×103kJ/mol(298 K)、ΔG=-5.05×103kJ/mol(304 K)、ΔG=-6.50×103kJ/mol(310 K)),表明结合过程中疏水作用是主要驱动作用,且是熵驱动的自发过程[22-23]。与我们的研究结果略有不同,其他研究报道了疏水相互作用力和静电作用力是形成抗炎药-酶复合物的主要驱动力,且是自发和焓驱动的过程,如新型芳基异丙酸类化合物[22]、棉酚[15]等。这意味着相互作用的驱动力可能随抑制剂的结构变化而变化。同步荧光和三维荧光光谱分析表明在与COX-2 的结合过程中,KNGP 结合位置可能更接近酪氨酸,而在保泰松和布洛芬与酶的结合位置可能更接近色氨酸[18,33],这表明结构不同的抑制剂对活性位点氨基酸残基的影响会有差别。与侯利杰等[18]在保泰松和孙艳涛等[33]在布洛芬与酶相互作用的报道中一致,KNGP-COX-2 配合物的形成会影响酪氨酸和色氨酸残基的微环境,使二者周围的疏水性增强。ANS 荧光探针法结果表明KNGPCOX-2 配合物的形成导致COX-2 的表面疏水性降低,说明KNGP 可能引起COX-2 的结构变化从而导致活性降低。表面疏水性的变化为KNGP 引起COX-2 的结构变化从而导致活性降低的机制提供了更多的证据。综上所述,本研究揭示了KNGP 对COX-2的作用机制是与COX-2的单一位点通过氢键和疏水相互作用结合形成复合物,可为寡肽段KNGP 作为潜在的COX-2 抑制剂提供理论基础,且本研究中肽段KNGP 由于含有脯氨酸残基而具有抗酶解吸收的特性,因此,以KNGP 作为研究对象是十分有意义的。

