鱼类肌肉生长抑制素myostatin研究进展*
杨慧荣,曾泽乾,杨炎,何颖琳,王庆,赵会宏,张勇,林浩然
1. 华南农业大学海洋学院,广东 广州 510640
2. 华南农业大学中山创新中心,广东 中山 528400
3. 中山大学水生经济动物研究所/广东省水生经济动物良种繁育重点实验室,广东 广州 510275
脊椎动物肌肉组织的生长发育主要与肌源调控因子(mrfs)形成家族成员有关,包括myod、myf5、mrf4、myogenin[1]。在低等脊椎动物中,myod和myf5的初始表达一般与肌肉分化过程的前体期相关,而myogenin和mrf4的表达与成肌细胞分化的初始阶段相关[2]。同时,这些动物体的肌肉组织也受到一些因子的负向调控,共同决定肌肉组织的生长发育。如TGF-β 超家族成员gdf-8,即肌肉生长抑制素Mstn[3]。以McPherron 为代表的学者首先从小鼠骨骼肌中发现mstn,在敲除mstn后发现由于肌细胞增生和肥大,导致骨骼肌的生长得到了显著的提高[4]。此外,也有学者发现mstn丧失其抑制功能后可使得牛、猪、羊等脊椎动物的骨骼肌显著增生,产生“双肌”表型[5]。
已有研究表明,在大部分家畜动物中,mstn主要在骨骼肌大量表达,通过负向调控肌肉组织的生长,参与机体的生长发育和代谢过程。通过对不同物种Mstn 的遗传结构进行比较分析,发现其在物种之间非常相似且保守,仅存在极少数的氨基酸变异,斑马鱼(Danio rerio)Mstn与一些家畜动物如牛和羊的Mstn 相比具有88%的同源性[6]。鱼类作为人类重要的蛋白源,其Mstn 的研究也变得十分活跃。许多学者对鱼类mstn的结构、表达与功能开展了大量的研究,并取得了显著的成果。鉴于此,本文系统综述了近年来鱼类肌肉生长抑制素的研究进展,明确下一步的研究方向,为水产养殖与水产遗传育种的发展提供理论基础。
1 mstn的结构与表达特征
与哺乳动物相同的是,鱼类mstn的结构也包含3 个外显子和2 个内含子,两者边界均符合GT-AG规则[7]。在产生作用前,mstn会先合成由信号肽、N-末端区和C-末端区共3部分组成的前体蛋白,该蛋白存在一个位于两个末端区之间的蛋白酶水解位点[8]。N-末端区能编码前肽,同时存在1个由疏水性氨基酸残基组成的信号肽,该信号肽能协助Mstn 前体蛋白在核糖体和内质网之间进行转运;C-末端区能编码成熟肽,另外具有一个由9个半胱氨酸组成的节点[9]。信号肽的存在,可使Mstn 前体蛋白在细胞膜系统内进行转运,该蛋白还能通过活化、去除信号肽以及蛋白酶切割位点的切割,形成N 端-前肽和C 端-多肽两部分。后者通过二硫键进行结合,最终形成活性蛋白。该活性蛋白在分泌至胞外后经酶加工,位于成熟区的2个C-端单体在成熟蛋白与细胞膜上的受体作用下发挥功能,成熟蛋白进入血液循环,并与N-端信号肽结合,作用于靶基因调控骨骼肌的生成[10-11]。
在现有鱼类中,mstn的研究包括斑马鱼等多种鱼类(见表1),其mstn得到克隆或部分克隆。与哺乳动物不同的是,部分鱼类由于发生基因组倍增,存在2 种mstn基因(mstn-1和mstn-2)并具有较高的同源性,如美洲红点鲑(Salvelinus fontinalis)两种mstn的同源性为92%[12]。部分鲑科鱼类存在4 种mstn基因,其中第一进化分枝包括mstn-1a和mstn-1b, 第 二 进 化 分 枝 则 包 括mstn-2a和mstn-2b[13]。
哺乳动物mstn在除肌肉以外的其他组织中均弱表达甚至不表达,而鱼类mstn在这些组织中存在不同程度的表达,且表达的部位可能受种类影响[6,14-23]。如表1 所示,鲤mstn仅存在于肌肉和脑中[16]。而花鲈在肌肉、眼睛和脑组织中检测到mstn的高表达,在肾、心脏、脾、鳃的表达相对较少[17]。鱼类mstn的时空表达特征可能存在种属特异性,但目前可以确定的是mstn-1的表达相对较为广泛,这两种基因型不同的mstn存在组织特异性的可能性[24]。有学者对斑马鱼两种mstn的差异进行分析,发现mstn-1在斑马鱼的整个胚胎发生过程均有表达,mstn-2的表达仅限于体节形成的初期[25]。
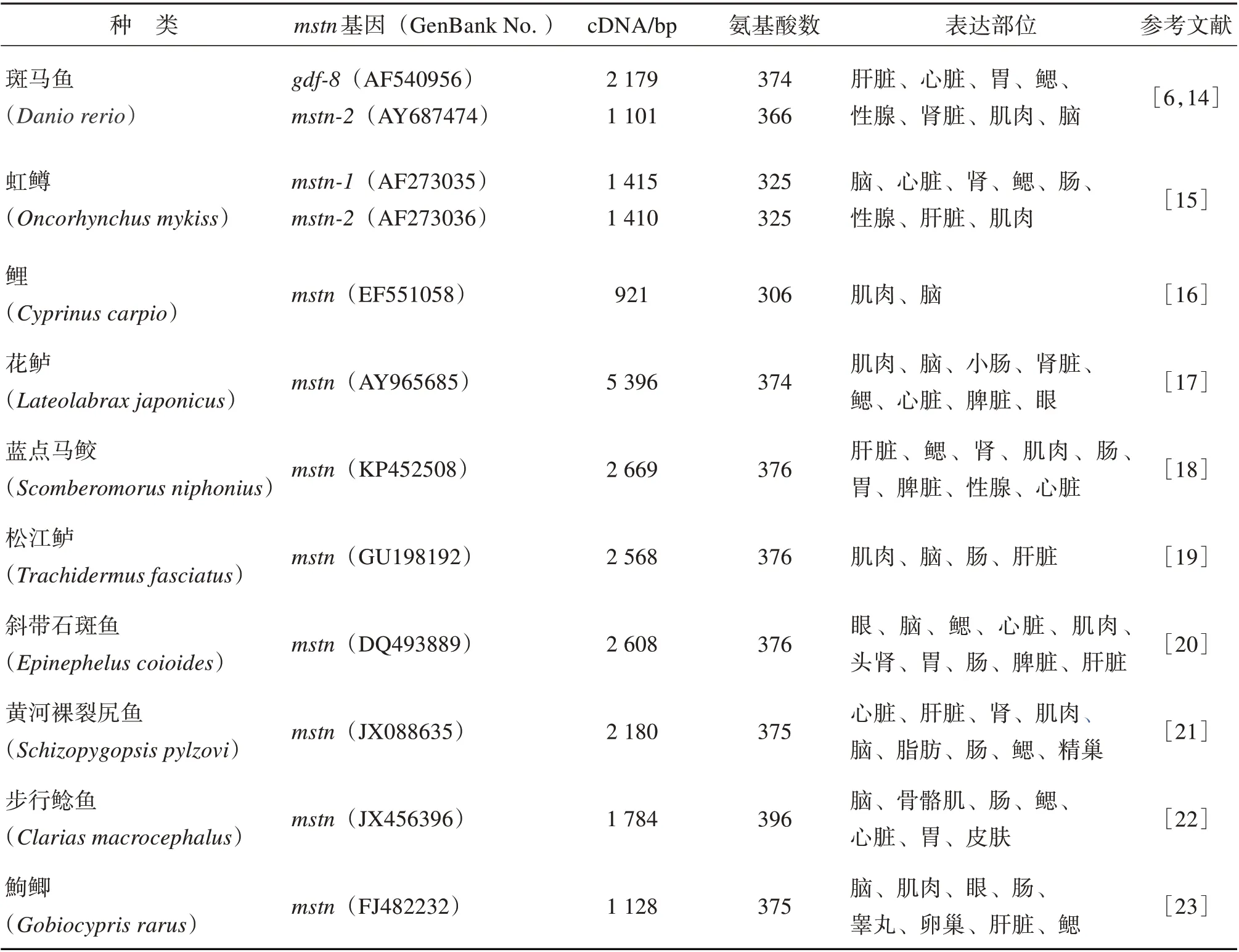
表1 部分鱼类mstn基因Table 1 The myostatin genes of some fishes
在动物体胚胎时期至老年时期中,mstn的表达量大体上呈现一种先升后降再升高的规律[26]。所以,基于同种鱼类来说,mstn的表达量可能与鱼体生长发育的时期存在联系,如淇河鲫(Carassius auratus)处于卵巢发育早期时mstn-2的表达量比mstn-1高,而在孵化后150~210 d 内后者表达量相对较高。有趣的是,在其体细胞和成鱼颗粒细胞中均发现Mstn蛋白,该蛋白通过促进cyp19a1的合成对卵巢的生长发育造成影响[27]。此外,mstn在部分鱼类中具有性别二型性,如表1鮈鲫mstn在雄鱼的肌肉、眼、大脑、肠和睾丸,雌鱼的鳃、眼、肠和卵巢中大量表达,而在雄鱼的心脏、鳃和膀胱,雌鱼的肌肉、心脏、大脑和膀胱中mstn低表达[23]。
总体来说,鱼类Mstn 与哺乳动物Mstn 存在不同的时空表达特征,骨骼肌并不是鱼类Mstn 的唯一来源。从表达特征可知鱼类Mstn 除调控肌肉组织生长外,还存在调控脑、性腺等组织器官的发育的可能性。鱼类两种Mstn 在生物学功能上具体存在哪一些差异,还有待进一步研究。
2 mstn的表达调控
在肌肉生长发育过程中,mstn参与类似E-box和mrfs等因子的转译调控。Rios 等[28]发现mstn的过度表达可降低myod和myog的表达水平,还能抑制肌肉肌酸激酶(Mck)的活性,从而对生肌过程进行调控;降低mstn的表达,则可提高这三者的表达及活性,另外这一操作中未发现Igf-1、myf5和Desmin存在显著的改变,该结果可能与种属特异性有关。在体外实验中,mstn能控制myogenin和肌球蛋白重链(MHC)的表达,而这两者是成肌细胞分化过程中起负向调节作用。
总体来说,在成肌细胞的增殖和分化过程中,MRFs家族成员先后表达,mstn可对myod等因子进行表达调控,具体情况如图1 所示。Cdk 又称细胞周期蛋白依赖性激酶,是能保证细胞周期过渡的一种限速酶,也是整个细胞周期调控机制的核心[29]。Cdk 的活性直接受周期蛋白依赖激酶抑制因子p21的影响,而mstn能特异性提高后者的表达,降低周期蛋白依赖性激酶2(Cdk2)的活性,使成肌细胞的生长停滞于G1 期,其增殖过程受到影响[30]。不过,当成肌细胞处于分化阶段时,mstn会抑制p21的表达。另外,mstn通过smad3对myod与myogenin的表达活性进行调控,保证成肌细胞在正常状态下分化成多核肌管[31]。而在抑制Mstn蛋白的活性后,动物体身上出现增生和肥大的现象可能是成肌细胞增殖和分化失调的结果。
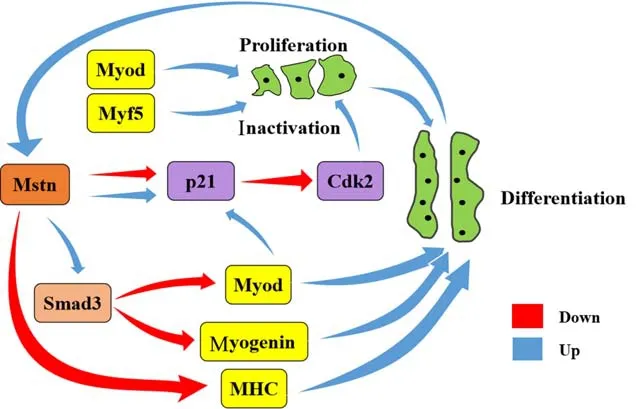
图1 mstn在成肌细胞增殖和分化过程中的表达调控Fig.1 Expression regulation of mstn in myoblast proliferation and differentiation
空间、温度、食物等多种环境因素也会影响mstn的表达。已有研究表明,生存空间过度拥挤会使得斑马鱼mstnmRNA 的表达水平降低[32]。利用布氏鲳鲹(Trachinotus blochii)设置4 个温度梯度(21、25、29 和33 ℃)进行实验,发现鱼体中脑和肌肉中的mstn-1在低温时表达量较高,随着温度升高而降低,在29 ℃时表达量最低;中脑中的mstn-2在25 和29 ℃表达量较低,在21 和33 ℃表达量较高[33]。利用大黄鱼(Larimichthys crocea)进行饥饿实验,结果显示在饥饿条件下,mstn-1在脾中表达量先下降后上升,mstn-2在肝中的表达量先上升后下降[34]。
此外,mstn的表达也受一些激素的影响。Rodgers 等[35]发现皮质醇会影响mstn在部分鱼类中的表达,如尼罗罗非鱼(Oreochromis niloticus)。环境压力会导致皮质醇升高,进而影响能量代谢[36]。Segev-Hadar 等[37]在尼罗罗非鱼mstn的鉴定和表征实验中分析了血浆中总蛋白和甘油三酯的水平。环境压力会导致应激反应,但多个处理组与对照组的总蛋白和甘油三酯水平无明显差异,而无饲料处理组血浆中的皮质醇水平有升高的趋势。皮质醇对于mstn的影响,有待进一步研究。生长激素(GH)是脊椎动物生长的关键启动子,对动物体肌肉组织的生长具有重大影响,所以GH 也能调节mstn的表达[38]。值得一提的是,虹鳟经GH 处理后会导致其mstn前体的表达量增加;也有研究发现,转GH 基因大麻哈鱼(Oncorhynchus keta)白肌组织中mstn前体得到高水平的表达[39-40]。这说明GH对mstn的作用可能发生在转录和翻译时期中。
3 Mstn的功能和作用机制
鱼类Mstn 的时空表达特征较为独特,但其基本功能仍然与两栖类、鸟类和哺乳类的Mstn 类似[41]。Mstn 在肌肉组织分化过程中的作用模型如图2所示,Mstn通过抑制成肌细胞增殖和多核肌管分化来调节肌肉质量。

图2 Mstn在肌肉发育中的作用模型Fig.2 The role model of Mstn in muscle development
McPherron 等[4]构建了mstn突变纯合体小鼠,发现小鼠在出生前后其肌纤维数量和体积均得到提升,最终使得肌肉的体积增加。而在鱼类的研究中也得出相似的结果,如利用RNA 干扰技术,注射mstnC 末端dsRNA 至斑马鱼的受精卵,可使早期胚胎增生或肥大[42]。利用基因组方法靶向诱导的局部病变制备mstn缺陷的青鳉(Oryzias latipes),发现青鳉Mstn 在孵化后对肌纤维的大小及数量具有暂时性的调控作用,在成鱼阶段的肌纤维数量比野生型增加了1.3倍,实验组的肌纤维数量、每个标准长度在各个生命阶段中均高于对照组[43]。
在肌肉生长发育的过程中,Mstn 与细胞周期密切联系,通过作用于肌细胞控制后者在细胞周期G1 期至S 期中的转变。另外,Mstn 在分泌后可作用于肌卫星细胞,使其状态保持静止。Wang等[44]研究表明,抑制小鼠mstn的表达可激活肌卫星细胞,但在mstn-/-小鼠中,成年小鼠的肌卫星细胞数量保持不变。也有学者发现基于mstn被敲除的条件下,肌肉发生的肥大现象先于肌卫星细胞的激活[45]。由此可见,肌卫星细胞的活性受Mstn 的负向调控,但肥大现象和肌卫星细胞的激活之间并无明显关联。不过,关于鱼类肌卫星细胞的研究较少,目前研究仅在斑马鱼、鲤等鱼体内发现肌卫星细胞[46]。有学者利用肌肉注射法对鲤的肌卫星细胞进行标记,为其进一步研究提供了帮助[47]。
Mstn的作用方式有自分泌、旁分泌、内分泌3种[48]。在哺乳动物中,激活素IIb型受体(Act RIIB)被认为是Mstn 和其他TGFb配体的受体。而在大西洋鲑(Salmo salar)[49]、斑马鱼[50]等鱼类的许多组织中均发现该受体的表达,这表明鱼类Mstn 可能以自分泌的方式在这些组织中发挥作用[51]。Mstn 前体蛋白经过特异性结合后,通过蛋白和非Smad 蛋白两种信号转导途径实现其生物学功能[52]。
3.1 Smad蛋白信号通路
在Mstn 实现其生物学功能的两种信号转导途径中,以Smad 蛋白介导的信号通路最为典型。如图3 所示,Mstn 前肽可直接与成熟的Mstn 结合来阻止整个信号转导过程的发生。激活的肌肉生长抑素二聚体(成熟的Mstn)与Act RIIB 结合,通过转磷酸化募集并激活Act RIB/TβRI。Smad2/Smad3随后被激活,与Smad4 形成一个复合体,该复合体会在细胞核激活靶基因的表达。靶基因被激活的同时,Smad7的表达水平也会相应地提高。在这一过程中,Smad7的高水平表达与其调控序列上的SBE有关,它能与Smad2/Smad3 和Smad4 组成的复合体结合。Smad7 对Smad2/3 的磷酸化存在抑制作用,复合体的形成由此会受到影响,使得mstn的转录水平降低,实现负反馈调节[53]。
近年来,不少学者对鱼类Smad 蛋白信号通路也进行了研究。如在牙鲆(Paralichthys olhaceus)中 发 现 了4 种smad4s(PoSMAD4a、PoSMAD4b、PoSMAD4c、PoSMAD4d),它们在蛋白结构、表达模式和亚细胞定位等方面的特性存在一定程度的差异[54]。在斑马鱼补偿性生长实验中,使用显性阴性LAPD76A 重组蛋白灭活Mstn,导致Smad 蛋白信号通路失活。与对照组相比,经过处理的斑马鱼肌肉肥大,其生长性能得到改善[55]。mstn表达量的降低对于肌肉补偿性生长具有重要的调节作用,这一结果为制定提高鱼类生长速度的策略提供了理论依据。另外,也有学者指出鱼类肌肉中Smad 的磷酸化可能会随着鱼类的种类或发育阶段的改变而改变,这个问题需要进一步研究[43]。
3.2 非Smad蛋白信号通路
除Smad 蛋白外,Mstn 还可以通过非Smad 蛋白途径进行信号转导,如MAPK 信号通路。Smad蛋白信号通路与MAPK 信号通路存在某种协同作用,不同的是,Mstn 可通过后者引起心肌细胞的定向表达,导致心肌细胞纤维化,损害老年小鼠的心脏功能,但这一结论缺乏直接证据[56]。此外,p38信号转导的激活与Mstn促进骨骼肌纤维化的活性无显著性关联[57]。MAPK 信号通路的主要过程是激活TAK1 和MKK3/6,从而刺激p38,后者促进I 型胶原蛋白的表达,该表达受p38MAPK 激酶抑制剂影响。有学者研究发现,该抑制剂可在C2C12细胞中利用TAK1-MKK6信号通路激活,从而实现Mstn对成肌细胞的抑制作用[58]。至于Mstn对鱼类心脏是否具有类似纤维化的影响,需要进一步讨论。
另外,Mstn 也激活了由Ras 介导的ERK 通路。该通路诱导细胞周期阻滞、肌管的形成以及肌源蛋白和其他肌肉特异性蛋白的表达,阻止肌细胞的分化和再生[59]。图3 中,DA-Raf 是ERK 通路的显性负向拮抗剂,也是肌源性分化的正向调控因子。研究表明,在ERK 通路中,MEK 抑制剂U0126 和曲美替尼可以解除mstn诱导的抑制作用,这些药物可能适用于治疗肌少症或肌肉萎缩[60]。

图3 mstn信号通路Fig.3 The mstn signaling pathway
4 鱼类Mstn的应用和研究前景
鱼类Mstn 具有十分广泛的应用和研究前景。以生长相关候选基因的多态性与生长性状的关联性为基础,筛选出与优良经济性状相关的位点,有利于在繁殖亲本的早期培育过程中提高选育效率,达到缩短良种培育时间的目的[61-62]。近年许多研究中,mstn被视为鱼类生长性状遗传改良的重要候选基因之一,与鱼类的生长性状进行关联性分析。如张世勇等[63]在斑点叉尾鮰(Ictalurus punctatus)中发现了其mstn第2 内含子上存在1 个SNP 位点,该位点与鱼体质量和体长显著性相关。目前的研究说明,鱼类mstn上的SNP 位点与某些特定的生长性状相互关联,但种类、环境等因素导致SNP位点和相关特性存在差异。
由于部分鱼类在时空表达特征上存在差异,在未来的研究中可利用基因敲除技术,探究Mstn在鱼类其他组织中的生物学功能。如构建泥鳅(Misgurnus anguillicaudatus)mstn敲除模型,发现该基因的缺失除了促进肌肉组织生长外,还会导致组织中的脂肪合成减少,从而降低脂肪的沉积,该结果通过影响能量代谢来实现[64]。不过,Mstn影响鱼类脂肪代谢的机制还未知,且Mstn 对脂肪可能具有双重调节作用,需要进一步的研究。斑马鱼mstn被敲除后发现其F2 代存活率降低,并对免疫系统造成损害[65]。构建大口黑鲈(Micropterus salmoide)的mstn真核表达载体,研究其在肌肉中的表达,结果意外发现Mstn 前肽的表达水平与时间相关[66]。这一研究方向可能会遇到如敲除基因后出现肌纤维肥大,但不增生、体质量或体长没有明显变化等现象,需要进一步探讨。
5 小 结
与哺乳动物相比,鱼类Mstn 存在不同的时空表达特征,具有调控其他组织生长发育的生物学功能,主要以Smad 蛋白等途径负向调控肌肉组织的生长。此外,鱼类Mstn 的研究在水产养殖和水产遗传育种方面得到了一定程度的应用。但是除了肌肉组织外,Mstn 对鱼类脑、性腺等组织的作用机制未知,需要进一步深入研究;Mstn 如何与皮质醇等因子互作、如何调控鱼类脂代谢等生理过程仍不清楚;Mstn 是否会通过MAPK 信号通路影响鱼类心肌纤维化,mstn表达的信号转导机制网络需要进一步完善。只有阐明上述机制,才能更好地了解Mstn 参与鱼类生长发育的过程,为Mstn的实际应用提供理论基础。

