探讨持续正压通气联合肺表面活性制剂对呼吸窘迫综合征新生儿肺功能的改善效果
刘 畅,陈 昌
潢川县人民医院儿科,河南 潢川 465150
新生儿呼吸窘迫综合征的发生直接原因为胎儿出生后短期内肺结构中肺泡功能不成熟、肺表面活性物质缺乏,该疾病是早产儿常见并发症,治疗不及时甚至会导致患儿死亡。呼吸窘迫综合征患儿发病时肺泡出现进行性萎缩,主要表现为呼吸困难、发绀甚至呼吸衰竭,相关数据显示,在呼吸窘迫综合征患病胎儿中,晚期早产儿占比约为23%[1]。随着医学技术的不断进步,呼吸机辅助通气在新生儿呼吸窘迫综合征中的应用逐步变得广泛,不断提高了该疾病患儿的存活率。目前呼吸窘迫综合征的治疗主要重点在于预防患儿继发感染,对患儿进行持续通气等[2-3]。但也有研究[4]指出,持续正压通气(CPAP)、氧疗等治疗方式存在增加患儿肺损伤的隐患,治疗后会对患儿的肺力学产生干扰或抑制,增加哮喘、反复呼吸道感染等并发症的发生,从而影响患儿预后,因此在CPAP的基础上联合更加有效的药物治疗成为临床关注重点。近年来肺表面活性物质治疗也成为临床研究的热点,分布于肺泡液体分子层表面的肺表面活性物质具有降低肺泡表面张力、维护肺泡容量的稳定等作用,应用于新生儿的呼吸窘迫中可阻止肺泡内积蓄液体,改善患儿呼吸状况[5]。本研究探讨CPAP联合肺表面活性制剂对呼吸窘迫综合征新生儿肺功能的改善效果,现报告如下。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年1月潢川县人民医院儿科收治的118例呼吸窘迫综合征新生儿为研究对象,随机分为观察组与对照组,每组各59例。入选患儿的生母均具备发病高危因素,入选患儿均符合相关诊断标准:患儿出生后6 h内出现进行性加重的呼吸急促症状,胸部X线片检查中两肺透光度下降。排除标准:一个月以内出现呼吸道感染者,合并严重心脑血管疾病者,其他疾病造成气流受阻者。入选患儿被随机分为观察组59例与对照组59例。观察组患儿胎龄29~38周,平均胎龄(31.92±1.57)周,体重1.4~2.6 kg,平均体重(1.88±0.40)kg。自然分娩者22例,剖宫产37例。对照组患儿中胎龄29~39周,平均胎龄(32.05±1.63)周。体重1.3~2.5 kg,平均体重(1.94±0.45)kg。自然分娩者25例,剖宫产34例。两组患儿一般资料具有可比性(P>0.05)。本研究通过医院医学伦理会审批且所有纳入患儿的家属均知情同意。
1.2 方法
两组患儿入院后均给予基础治疗,包括预防感染、保持呼吸道通畅、维持水电解质平衡等,同时注意监测生命体征。对照组患儿在基础治疗的基础上应用CPAP进行治疗:依据患儿出生天数、体质量、病情严重程度等实际情况调节呼气末正压值,吸入氧浓度21%~70%,饱和度90%~95%,通气流量8 L/min,在具体治疗中合理控制各项通气治疗的指标。
观察组患儿在对照组的基础上联合肺表面活性制剂进行治疗:清洗患儿气道内分泌物,待患儿生命体征平稳后在无菌条件下行气管插管,插管过程中患儿保持仰卧,注意操作要点,应保持轻柔、准确、迅速的手法。肺表面活性物质为意大利Chiesi Farmaceutici S.p.A.公司生产的产品(治疗前于冰箱中妥善冷藏备用,使用前提前数分钟取出,药物温度恢复至正常室温之后,取适量的无菌生理盐水将其溶解),参照说明依据患儿体重确定用药量,首次剂量200 mg/kg,此后维持剂量100 mg/kg,治疗中应严格把控注入时间与速度,时间以10~15 s为宜,每次给药后给予适当的加压给氧处理。两组患儿连续治疗5 d后评估疗效。
1.3 观察指标与疗效判断标准
(1)记录并比较两组患儿,并统计两组患儿治疗的有效率:治疗后患儿临床呼吸急促、呼气呻吟、发绀、三凹征等均改善为有效,相关临床表现不改善甚至病情恶化为无效,有效率=(有效患儿例数/总患儿例数)×100%。(2)在治疗前及治疗后于清晨测定两组患儿的空腹动脉血气情况(抽吸肝素液充分润滑1 mL的无菌注射器,弃去余液,保证注射器内无残留空气;患儿取仰卧位,掌心向上,垫高并背屈腕部,对左手的食指、中指及局部皮肤进行消毒,在患儿腕部找到约第二腕纹近桡侧1/3扪及动脉搏动最明显处,固定血管,用提前处理好的注射器由动脉近心端向远心端逆行穿刺,角度为40°~60°;见回血后固定针头,采集够所需血量后拔出针头,推出一滴血后使针头进入橡皮塞,手搓动注射器使血液与抗凝剂混匀,棉球顺血管方向按压针眼2~5 min),包括pH、PaCO2、PaO2水平。(3)比较两组患儿治疗前后的机械通气参数,包括呼气终未正压(PEEP)、吸入氧浓度百分比(FiO2)及氧合指数(OI)。
1.4 统计学方法
数据采用SPSS 18.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿疗效情况
治疗后观察组患儿平均住院时间较对照组显著缩短,且有效率显著高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患儿疗效情况
2.2 两组患儿治疗前后血气指标情况
与治疗前相比,治疗后两组患儿血清中pH、PaO2水平显著升高,PaCO2水平显著下降,且观察组上述指标的改善情况较对照组更为显著,差异有统计学意义(P<0.05),见表2。
表2 两组患儿治疗前后血气指标情况(±s)
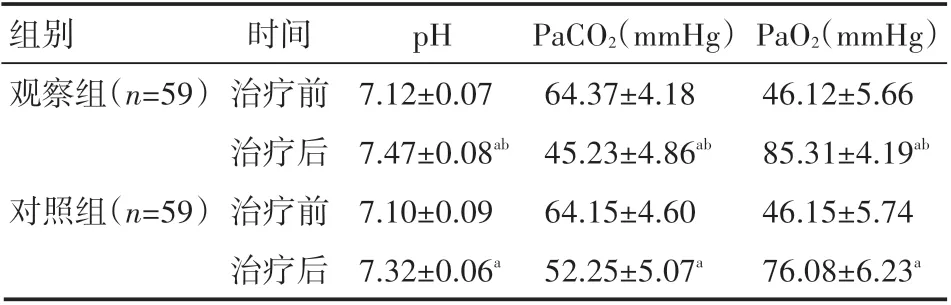
表2 两组患儿治疗前后血气指标情况(±s)
a表示与治疗前相比,P<0.05;b表示与对照组相比,P<0.05。
组别观察组(n=59)对照组(n=59)时间治疗前治疗后治疗前治疗后pH 7.12±0.07 7.47±0.08ab 7.10±0.09 7.32±0.06a PaCO2(mmHg)64.37±4.18 45.23±4.86ab 64.15±4.60 52.25±5.07a PaO2(mmHg)46.12±5.66 85.31±4.19ab 46.15±5.74 76.08±6.23a
2.3 两组患儿治疗后机械通气参数情况
与治疗前相比,治疗后两组患儿PEEP、FiO2及水平均显著下降,OI指数水平显著升高,且观察组患儿上述指标水平改善程度较对照组更为显著,差异有统计学意义(P<0.05),见表3。
表3 两组患儿治疗后机械通气参数情况(±s)
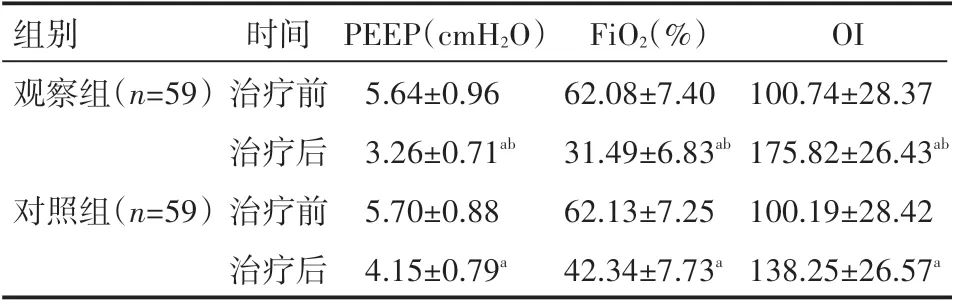
表3 两组患儿治疗后机械通气参数情况(±s)
a表示与治疗前相比,P<0.05;b表示与对照组相比,P<0.05。
组别观察组(n=59)对照组(n=59)时间治疗前治疗后治疗前治疗后PEEP(cmH2O)5.64±0.96 3.26±0.71ab 5.70±0.88 4.15±0.79a FiO2(%)62.08±7.40 31.49±6.83ab 62.13±7.25 42.34±7.73a OI 100.74±28.37 175.82±26.43ab 100.19±28.42 138.25±26.57a
3 讨论
临床上呼吸窘迫综合征新生儿主要接受的治疗方式为经鼻持续正压通气,通气后可相对减少机体的能量消耗,避免呼吸肌过度疲劳,并通过通气间接增加跨肺压,帮助患儿重新扩张已经萎陷的肺泡,增加功能残气量,进而改善氧合程度,但该方式干预无法达到良好的脱机效果,且治疗后患儿可能发生并发症[6-9]。目前临床在治疗新生儿呼吸窘迫综合征中逐渐主张为患儿补充肺表面活性物质,旨在帮助患儿降低肺泡表面张力,预防或逆转肺泡萎缩。肺表面活性物质是一种由脂质及表面蛋白构成的混合物,其结构特性导致其具有独特的张力,新生儿第一次吸气时,该物质可抵达肺泡表面并在肺泡表面迅速铺展,呼气时随着表面膜面积的缩小,肺表面活性物质能降低肺泡表面张力,防止肺泡萎陷,在肺部发挥机械性稳定作用,这一作用得以实现的原因在于:液体形式的肺表面活性物质铺展于肺泡内衬层,通过气液界面的吸附铺展,随后使萎陷的肺泡重新张开,并能在膨胀时保持肺泡的形态,因此健康的肺泡在呼气末期不会塌陷。此外,呼吸道中的肺表面活性物质可以防止液体在管腔内聚集,促进肺泡内液体的清除,维持气道稳定性,还以其特有方式参与到机体的免疫调节中,可促进呼吸综合窘迫征患儿得到更好的预后[10-13]。本研究中在CPAP与常规治疗的基础上给予患儿肺表面活性物质进行治疗,利用肺表面活性物质本身的铺展特性及CPAP的作用可将其他药物带到患儿呼吸道末梢,提高药物效果,且结果证实联合治疗方案在改善患儿呼吸功能并恢复其自主呼吸方面取得了一定效果,治疗后观察组患儿平均住院时间较对照组显著缩短,且有效率显著高于对照组。分析其原因,与肺表面活性物质有效舒张肺泡、提高肺顺应性、预防胸廓塌陷并缓解呼吸肌疲劳的功效有关,而CPAP的应用显著促进肺表面活性物质快速、均匀扩散于局部病灶[14]。
CPAP的应用诱导患儿肺泡重新舒张,提高患儿肺的顺应性,因此在改善其肺部的氧合状态与血气状态等方面具有积极意义。肺表面活性物质进入患儿气道后,首先发挥降低肺表面张力的作用,并于CPAP联合作用避免患儿肺泡进一步萎缩,治疗过程中还能维持患儿肺泡内的压力,帮助患儿肺部维持功能残气量以恢复自主呼吸[15],这一功效在患儿血气指标的改善方面得到体现。本研究结果显示,与治疗前相比,治疗后两组患儿血清中pH、PaO2、OI指数水平显著升高,PaCO2、PEEP、FiO2及水平均显著下降,且观察组患儿上述指标水平改善程度较对照组更为显著,提示CPAP联合肺表面活性制剂治疗新生儿呼吸窘迫综合征临床疗效突出,缩短患儿住院时间,改善其机械通气参数与血气指标,促进患儿预后,因此值得临床进行参考应用。

