过氧化尿素与微生物联合修复石油污染土壤
郑瑾,韩瑞瑞,,李丹丹,王馨妤,4,高春阳,杜显元,张晓飞,邹德勋
(1 石油石化污染物控制与处理国家重点实验室,北京 102206;2 中国石油集团安全环保技术研究院有限公司,北京 102206;3 北京化工大学化学工程学院,北京 100029;4 中国石油大学(北京)化学工程与环境学院,北京 102249)
在石油开采、运输及储存过程中,石油及其产品的跑、冒、滴、漏会造成不同程度的土壤和地下水污染。石油是由碳、氢及少量其他元素组成的混合物,进入水体中的石油会在水面上形成一层阻止光穿透的薄膜,影响水中植物和动物的正常生命活动。进入土壤中的石油会使土壤变得疏水、渗透性降低,破坏土壤微生态环境。它们既可以从土壤挥发至空气中,也可以迁移至地下含水层中,还能通过呼吸、皮肤接触、食用等多种方式进入人体或动植物体中,其中的多环芳烃类化合物具有致癌、致畸、致突变等毒理效应。因此,对石油污染土壤的修复刻不容缓。
目前,修复石油类污染土壤的方法主要有物理法、化学法和生物法。其中,化学法因具有普适性强、修复效果好、周期短等优势,有较好的发展前景。芬顿试剂(过氧化氢)是常用的化学氧化剂,但过氧化氢为液态,在使用过程中存在稳定性差、运输不便的问题。过氧化尿素兼具过氧化氢和尿素的性质,并且为固体粉末,因此在一定程度上克服了过氧化氢在使用中的问题。此外,过氧化尿素可使水体溶氧量提高1.25 倍,在土壤中可释放大量活性氧为微生物提供电子供体,改善土壤透气性,还能给植物的根部供给氮肥,减少土壤板结。因此过氧化尿素是一种可替代过氧化氢用于芬顿反应的绿色化工产品。
氧化剂在土壤修复中过量使用不仅提高了修复成本,而且会对土壤有机质有一定影响,破坏土壤生态环境。因此,为了克服单一修复技术的局限性,化学氧化和微生物联合修复技术已经开始应用于石油污染土壤的修复中。该技术既可以解决微生物难于降解复杂烃类和修复时间长的问题,又可以解决化学氧化剂用量大和危害性大的问题,是一种具有应用潜力的土壤修复技术。Xu等研究也表明,芬顿预氧化联合微生物对石油污染土壤的修复效果是微生物的1.8~2.6 倍,且经过芬顿预氧化后生物修复周期缩短了2~3倍。
目前利用过氧化尿素修复石油烃污染土壤的研究较少,尤其是利用过氧化尿素与微生物联合修复石油污染土壤的相关研究鲜见报道。因此,本文考察了过氧化尿素修复石油污染土壤的优化条件,并对过氧化尿素与微生物联合修复技术的应用效果进行了初探,以期为过氧化尿素及其联合微生物修复技术在石油烃污染土壤的工程应用提供理论依据和数据参考。
1 材料与方法
1.1 实验材料
供试土壤取自新疆某油田,经挑拣、自然风干、研磨后过筛(10 目),并于-20℃冰箱保存备用。土壤理化性质见表1,其中土壤中石油烃含量为44191mg/kg,饱和烃质量分数为56.12%,芳香烃质量分数为23.60%,胶质质量分数为20.28%,含水率为1.54%,pH为8.17。
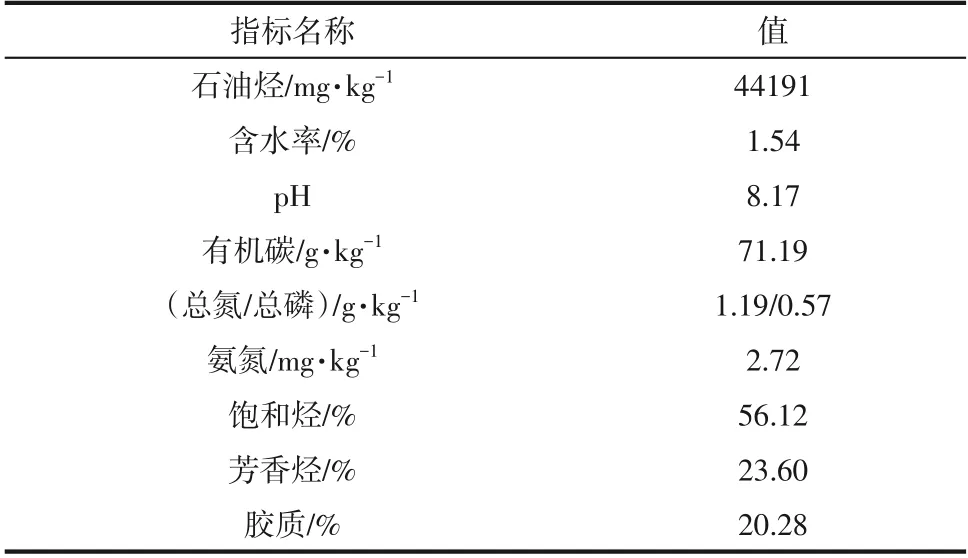
表1 土壤理化性质
实验中所用的微生物为高效降解菌复配的混菌,包括铜绿假单胞菌()、威尼斯不动杆菌()、弯曲芽孢杆菌()、阿耶波多氏芽孢杆菌()、巨大芽孢杆菌(),复配菌液体积比例为3∶6∶1∶1∶1。
微生物活化培养基为LB 肉汤培养基:胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10g/L,pH 调节到7.0。
1.2 实验设计
1.2.1 二价铁活化过氧化尿素正交实验
为了研究过氧化尿素(UHP)的添加量、二价铁(Fe)与UHP的摩尔比、水土比对UHP修复石油污染土壤的影响,进行了三因素三水平的正交实验设计(表2),该实验的设计依据参考相关文献中优化的因素及水平。

表2 试验因素与水平
取50g 石油污染土装入100mL 锥形瓶按照表3设定的量加入药剂,置于培养箱(25℃)中反应,每12h进行搅拌,并适当补充水分至反应前水土比的状态。每组实验重复3次,取石油降解率的均值进行正交分析。8天后取样并自然风干后研磨备用。
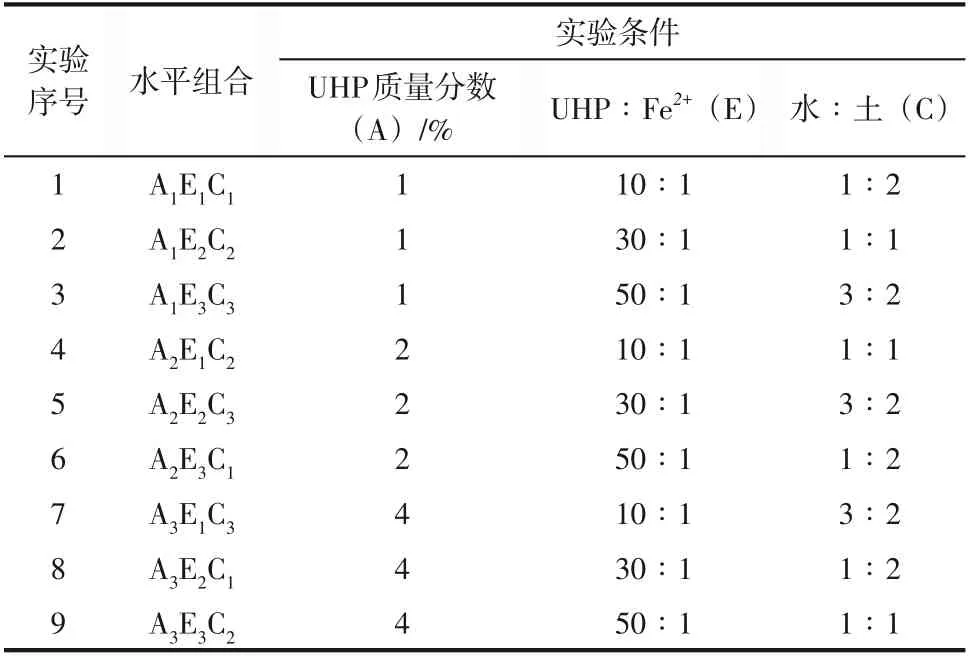
表3 正交实验设计结果表
1.2.2 菌剂活化与培养
将复配菌菌液以10%的接种量接入盛有10mL LB 肉汤培养基的三角瓶中,在30℃、150r/min 的摇床中振荡培养24h,再以10%的接种量接入100mL 的LB 肉汤培养基中,扩大培养24h 后将菌液移入灭菌离心管,于高速离心机中8000r/min 下离心30min,倒掉上清液后加入灭菌生理盐水,震荡均匀,再次在8000r/min下离心30min,倒掉上清液后加入灭菌生理盐水,振荡混匀后备用。
1.2.3 过氧化尿素联合微生物修复石油污染土壤实验
本研究共设5个处理组(表4),包括空白对照组(CK)、40天微生物修复组(B)、8天的UHP氧化组(UF)、8天的UHP氧化联合40天微生物修复组(UF+B)、40天微生物修复联合8天的UHP氧化组(B+UF)。取200g 石油污染土装于500mL 烧杯中,UHP 氧化组按照正交实验得到的最佳条件添加试剂,微生物修复组和联合修复组的菌剂添加量为10%,将污染土与药剂或菌液混合均匀后,置于25℃、湿度40%的生态培养箱中培养,分别于0天、8天、16天、24天、32天、40天、48天进行取样分析。
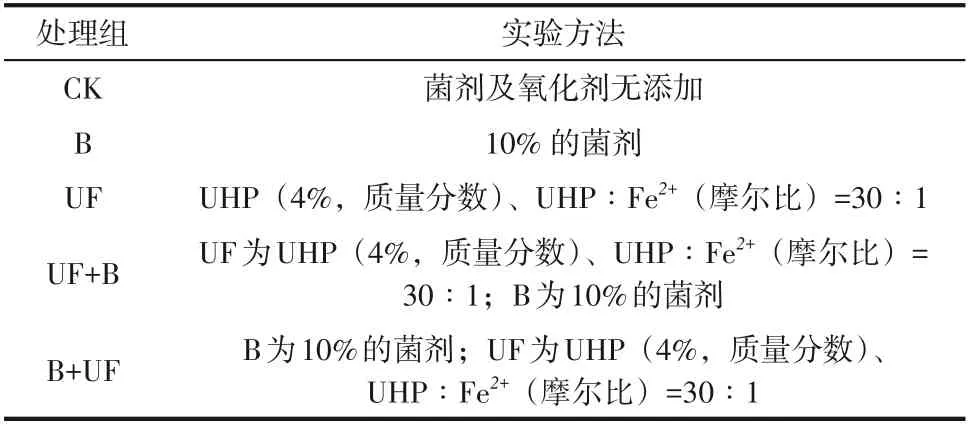
表4 过氧化尿素联合微生物修复实验条件及实验设计
1.3 检测方法
1.3.1 石油的萃取与测定
使用快速溶剂萃取仪(ASE-350,DIONEX)加压萃取土壤中石油,萃取液选择正己烷。取4g土样于研钵中,加入约2g 的硅藻土,研磨混匀后转移至萃取池中。经过ASE 萃取之后,采用重量法测定含油率。快速溶剂萃取仪检测参数如下:温度175℃、系统压力1600psi(1psi=6894.76Pa),加热时间5min,静态时间30s,吹扫气氮气、吹扫体积75%,静态循环1次。
1.3.2 石油各组分分析
石油各组分的测定参照文献[14]进行。将降解后的原油用正己烷浸泡静置12h,沉淀沥青质。使用正己烷萃取分离饱和烃;使用正己烷与二氯甲烷的混合溶液(体积比1∶2)萃取分离芳香烃;使用无水乙醇及氯仿萃取分离胶质。
1.3.3 微生物数量测定
使用平板计数法测定微生物的数量。取1g土壤于试管中,加入9mL 灭菌后的生理盐水,置于摇床中30℃、150r/min震荡2h。取1mL震荡完的上清液,用灭菌生理盐水从10依次稀释到10,之后取100µL 10~10的稀释液,均匀涂布于LB 固体平板上,并于30℃的培养箱中培养24h后计数。
1.3.4 微生物多样性分析
利用PowerSoilDNA 分离试剂盒提取5 个土壤样品进行微生物群落总DNA;1%的琼脂糖凝胶电泳检测DNA 的提取质量;NanoDrop2000 测定DNA浓度和纯度。16S rRNA 基因V3-V4 区引物(5’-ACTCCTACGGGAGGCAGCAG-3’和5’-GGACTACHV GGGTWTCTAAT-3’)进行PCR 扩增。扩增程序为:95℃预变性3min,95℃变性30s,55℃退火30s,72℃延伸30s,27 个循环,然后72℃稳定延伸10min。PCR 扩增产物使用2%琼脂糖凝胶检测,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,纯化后的PCR扩增产物使用上海美吉生物医药科技有限公司Illumina MiSeq平台测序。
2 结果与讨论
2.1 过氧化尿素降解土壤中石油烃的条件优化
采用正交实验探究了UHP添加量、UHP∶Fe及水土比三个因素及其相互作用对土壤石油降解率的影响及最佳反应条件。不同因素对石油降解率的影响程度可由极差值()表征,值越大表明对石油降解率的影响程度越大。因此从表5中可以看出石油降解率的影响因素大小顺序为UHP 添加量(=8.31)>UHP∶Fe(=4.69)>水∶土(=1.32)。在过氧化尿素降解石油污染土壤中,主要通过过氧化氢产生的羟基自由基来氧化土壤中的石油烃。UHP 添加量决定了过氧化氢的量[式(1)],UHP∶Fe影响羟基自由基单位时间内产生量[式(2)]。因此UHP∶Fe和UHP 添加量对土壤中石油烃去除率的影响较大。为各因素在同一水平下实验结果()的平均值,值越大代表相应的水平较优。本研究中,值随着UHP 质量分数、水∶土的增加而逐渐增大,反映了氧化剂增加能够增强活性位点的数量,水土比增加能够增强自由基传质,使自由基与污染物反应更加充分。此外,值随着UHP:Fe的增加呈现出先增大后下降的趋势,这主要受激活剂Fe与氧化剂UHP之间的比例影响。大量的催化剂会淬灭产生的自由基[式(3)、式(4)],且激活剂的聚集会减少可用活性位点的数量。
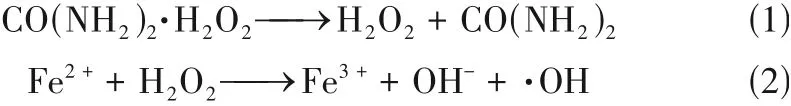
表5 石油降解率直观分析表

根据值得出各因素对过氧化尿素降解土壤中石油烃的影响大小顺序及最佳条件为UHP 添加量(4%)>UHP∶Fe摩尔比(30∶1)>水∶土(3∶2)
2.2 过氧化尿素联合微生物法修复石油污染土壤
2.2.1 污染土壤中石油降解率的变化
为了研究UHP 氧化法、微生物法及联合修复法对石油污染土壤的降解效果,模拟石油烃污染土壤异位修复过程,设计了对照组(CK)、40天微生物修复组(B)、8 天的UHP 氧化组(UF)、8 天的UHP氧化联合40天微生物修复组(UF+B)和40天微生物修复联合8 天的UHP 氧化组(B+UF)五组实验,并比较了UHP 氧化法和微生物法的修复顺序对修复效果的影响(图1)。

图1 不同修复方式石油降解效果对比
CK 组土壤中石油的降解率为7.33%,这可能是因为土壤中存在的土著微生物具有一定的石油降解能力。微生物组石油降解率为16.8%,低于UHP氧化组(32.1%),这可能是由于较高浓度的石油污染土壤(44191mg/kg)难以被微生物有效降解,导致单独微生物修复的效果并不理想。Abena 等研究也表明,当土壤中的石油浓度从15633mg/kg提高到236500mg/kg 时,微生物法的石油降解率降低了27.5%。
联合修复B+UF和UF+B组的石油降解率比B组分别提高了35.45%和47.26%,比UF 组分别提高了3.35%和15.16%,表明化学氧化与微生物法联合修复较单一修复法处理效率更高。韩旭等在研究中也发现,芬顿氧化后再添加微生物发现石油烃的降解率比单一的芬顿氧化提高了28.8%,比微生物法提高了44.4%。此外,对比不同联合修复顺序的实验结果显示,UF+B 组的石油降解率比B+UF组提高了11.81%,这表明先进行化学氧化更有利于石油污染物的降解,经过氧化尿素氧化后,土壤会变得疏松,土壤对石油的吸附能力减弱,同时还可以改变微生物与石油烃之间的结合位点和亲和性。此外,石油污染物中的羰基和芳香环减少,石油烃中的大分子组分降解更有利于被微生物利用,化学预氧化联合微生物修复机理参见图2。
图2 联合修复机理图
2.2.2 污染土壤中石油各组分含量的变化
石油是由多种组分组成的复杂混合物,包括饱和烃、芳香烃、胶质和沥青质四个组分,各组分结构不同,其生物可降解性不同。通过分析石油各组分的变化(图3),进一步探究不同修复方式的石油降解机理。本研究中沥青质未检测出。
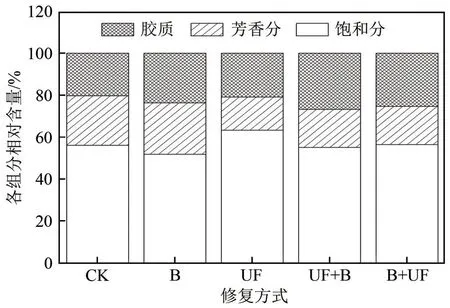
图3 不同修复方式石油各组分变化对比
化学氧化处理(UF)后,芳香烃组分相对含量从23.61%降低到15.85%,下降了7.76%;饱和烃从56.11%增加到63.26%,增加了7.15%。高春阳等也发现,活化过硫酸钠氧化土壤中的原油后,土壤中饱和烃增加了5.28%~11.93%、芳香烃下降了0.1%~2.53%,芳香烃的降低可能是因为部分芳香烃被氧化导致其含量降低。微生物处理(B)后,饱和烃相对含量下降了4.29%,胶质增加了3.41%,远大于芳香烃的增量(0.88%),表明微生物对结构最简单的饱和烃降解能力最强,对芳香烃也有一定的降解能力。苏荣国等研究也表明,石油四组分被微生物降解的相对能力为:饱和烃>芳香烃>胶质和沥青质。
在联合修复中,UF+B 组的饱和烃和芳香烃的相对含量分别降低了1.06%和5.47%,胶质提高了6.53%;而B+UF组的芳香烃减少了5.44%,饱和烃和胶质分别增多了0.31%和5.13%。联合修复结果进一步表明饱和烃组分微生物可降解能力强。改变过氧化尿素与微生物的修复顺序之后,UF+B组的饱和烃与芳香烃的相对含量比B+UF组降低了1.4%,表明微生物在UF+B组中更好地降解了饱和烃和芳香烃。这与Xu等的研究结果一致,芬顿预氧化联合微生物修复石油污染土壤26天后,O消耗率和CO产生率分别为先进行微生物修复后进行芬顿氧化组的1.2倍和1.3倍;且芬顿氧化后,难被微生物吸附降解的长链碳氢化合物分子(C~C)减少了约30%,石油类污染物的生物利用度提高了20%~30%。
2.2.3 土壤中微生物数量的变化
不同修复方式下土壤微生物数量随时间变化如图4所示。当外源微生物加入时,土壤中的微生物数量下降1个数量级,这可能是因为外源微生物对修复环境需要适应周期,且外源微生物与土著微生物对养分存在竞争关系,导致加入初期环境微生物数量减少。宋雪英等研究发现,土壤细菌总量与污染水平关系不大,而与土壤有机质呈正相关,充足的养分会提高土著菌的活性,当外源菌经过驯化,适应了土壤环境后,也会快速繁殖。因此,本研究发现第40 天后微生物的数量从10CFU/g 增长到了10CFU/g。第40 天后增加了氧化剂(B+UF),微生物的数量从4.01×10CFU/g降到4.09×10CFU/g。这与Gong 等研究结果一致,石油污染土壤微生物数量经芬顿氧化后从1.38×10CFU/g 降到1.62×10CFU/g。Lu等也指出微生物数量经芬顿氧化后下降了2~3个数量级。微生物数量降低可能是因为化学氧化过程会抑制微生物的生长,同时氧化剂产生的自由基会破坏细胞膜和基因的分子结构,对微生物具有一定的毒害作用。

图4 不同修复方式土壤微生物数量变化
本研究中还发现,微生物的数量在UF+B组化学氧化阶段从4.01×10CFU/g 降到4.09×10CFU/g,而在8~16 天变化很小,这可能是因为初期的化学氧化反应对微生物的生长有抑制作用。在16~48天微生物的数量逐渐恢复到了9.82×10CFU/g。B+UF组在48 天微生物的数量为4.09×10CFU/g,表明UF+B 组对微生物的毒性小于B+UF 组。随着时间的推移,土壤中石油烃的浓度会降低,且石油中难以被微生物降解的组分减少,此外,过氧化尿素理论活性氧质量分数17.02%,高于其他同类过氧化物,可以为微生物修复提供电子供体,尿素是一种含氮量为46.7%的有机氮源,可以补充一定量的氮元素,这些都为微生物的生长提供了良好的条件,使得微生物数量显著增加。
2.2.4 土壤中微生物多样性的变化
为了探究不同修复方式对微生物多样性及群落结构的影响,考察了Chao 指数、Ace 指数、Simpson 和Shannon 指数变化(表6)。Chao 和Ace指数用于评估群落丰富度,较高的Ace 和Chao 表明群落丰度越高。Simpson 和Shannon 指数用于评估群落多样性,Shannon 指数越大则Simpson 指数越小,微生物多样性和均匀度越高。

表6 土壤样品微生物群落多样性指数
CK组Ace和Chao指数分别为1028和1038。与CK 组比,处理组Ace 和Chao 指数降低了60~220,说明4 种修复方式(B、UF、B+UF、UF+B)均会降低微生物的群落丰度,这可能是因为氧化剂的加入改变了微生物的群落结构。此外,外源微生物会与本土微生物产生的拮抗作用也可能降低Ace 和Chao 指数。与CK 组相比,其他修复方式的Shannon 指数均降低了0.8~1.5,Simpson 指数提高了0.02~0.07,表明这4种修复方式会不同程度地降低微生物的多样性和均匀度。UF+B 组的多样性(0.84)和均匀度(0.023)下降得最少,表明UF+B组的微生物群落的修复能力强。
2.2.5 土壤中微生物群落结构的变化
微生物群落是土壤生态系统的重要组成部分,具有石油烃降解功能的微生物群落变化在石油污染土壤的修复中具有重要作用。图5为不同修复方式下门水平的群落变化,包括6 个门(变形菌门()、厚壁菌门()、放线菌门()、拟杆菌门()、绿弯菌门()、脱硫杆菌门())和一个未分类门。CK 组其优势菌门为放线菌门()占整体的50.24%,其次为变形菌门()、绿弯菌门()和厚壁菌门()分别占整体的22.99%、15.4%和6.48%。UF 和B+UF 组优势菌门为厚壁菌门(),与CK组相比群落丰度占比分别增加了62.19%和34.24%。UF+B与B组优势菌门为变形菌门(),与CK 组相比群落丰度占比分别增加了29.38% 和23.31%。单独化学氧化(UF)后厚壁菌门()变为优势菌门,其群落丰度与CK组相比增加了62.19%。变形菌门和厚壁菌门()是石油污染土壤中主要的石油降解菌。这表明厚壁菌门可能是微生物对石油污染土壤降解高效率的主要贡献者。与CK 组相比,UF 组减少了厌氧的拟杆菌门(),这可能是因为化学氧化减弱了土壤对石油的附着能力,提高了土壤的透气性,同时过氧化尿素缓慢释放活性氧,不利于厌氧菌的生存。加入外源微生物(UF+B) 后,观察到了厌氧菌拟杆菌门()和脱硫杆菌门()存在,这可能是因为随着好氧微生物的增加,在降解石油类污染物的同时,消耗土壤中的氧气,形成了局部的厌氧环境,为厌氧菌的生长创造了条件。

图5 不同修复方式门水平群落结构丰度变化
微生物修复(B、UF+B、B+UF)后,变形菌门()及厚壁菌门()的群落丰度占比分别增加23.32%、39.51%和34.66%。这是因为微生物法投加的三株复配菌属于变形菌门()及厚壁菌门(),外源菌株的加入显著增加了其群落丰度,并且在土壤修复体系中发挥着一定的作用。
3 结论
本文采用正交实验设计和联合修复实验,以过氧化尿素(UHP)为氧化剂,Fe为激活剂,研究了UHP 去除石油烃的条件及其与微生物联合修复土壤石油污染物的效果,得出如下主要结论。
(1)本文采用土壤模拟实验方法和三因素三水平正交实验优化了UHP 氧化土壤中石油烃的最佳条件。结果表明,二价铁激活过氧化尿素修复石油污染土壤中,UHP∶Fe(=4.69)和UHP 添加量(=8.31)对土壤石油烃去除率的影响高于水土比(=1.32),且过氧化尿素降解土壤中石油烃的最佳条件为UHP 添加质量分数4%、UHP∶Fe=30∶1及水∶土=3∶2(AEC)。
(2)对于较高浓度的石油污染土壤(石油烃含量44191mg/kg,饱和烃含量56%),相比于单一微生物修复或过氧化尿素氧化修复方法,两者联合修复方法对土壤石油烃的降解效果更好,比微生物组提高了35.45%~47.26%,比过氧化尿素氧化组提高了3.35%~15.16%。
(3)过氧化尿素与微生物联合修复中,先添加过氧化尿素(UF+B 组)比先添加微生物(B+UF组)可以使石油降解率提高11.81%。经过过氧化尿素预氧化,土壤中芳香烃组分下降了7.76%,石油降解的厚壁菌门()的群落丰度提高了62.19%,且UF+B组微生物数量、多样性和均匀度均高于B+UF组。这表明过氧化尿素预氧化,可以为微生物提供良好的生存及降解环境,有利于土壤中石油烃的去除。该方法可用于石油烃污染土壤异位修复中。
(4)过氧化尿素与微生物联合修复方式在石油烃含量5%左右石油污染土壤修复中具有良好的应用前景。

