奥拉帕利联合阿帕替尼对卵巢癌患者SMRP、MALAT-1水平的影响
汪笑秋,虞伟妃,赵丽萍,周珏伊,冯继红
(丽水市人民医院 温州医科大学附属第六医院肿瘤内科,浙江 丽水 323000)
卵巢癌作为一种恶性肿瘤疾病,其早期缺少症状或症状不典型,易被患者忽视,早期诊断较困难。部分患者就诊时已处于晚期,而晚期病例疗效不佳。因此,该病的死亡率居妇科肿瘤的第一位[1-2]。目前临床治疗卵巢癌以手术治疗为主,辅以化学治疗、放射治疗、免疫治疗等[3]。奥拉帕利是多腺苷二磷酸核糖聚合酶(poly ADP-ribose poly-merase,PARP)抑制剂,可通过抑制PAPR酶对肿瘤细胞中DNA损伤的修复,从而阻滞癌变。有研究显示,若其与抗血管生成剂联合使用时,有助于提高疗效[4]。血管生成是肿瘤生长和转移的重要环节,抗血管生成在卵巢癌治疗中具有一定成效,其中阿帕替尼为一种抗血管生成靶向药物,在卵巢癌治疗中具有一定疗效[5]。目前国内外暂未发现奥拉帕利联合阿帕替尼在卵巢癌患者治疗中的报道,故在本文研究中选取2016年1月-2020年1月我院收治的200例卵巢癌患者,观察奥拉帕利联合阿帕替尼在卵巢癌中治疗效果及对可溶性间皮素相关肽(soluble mesothelin related peptide,SMRP)、人肺腺癌转移相关转录本1(metastasis associated in lung adenocarcinoma transcript 1,MALAT-1)水平的影响,现将结果报道如下。
1 资料与方法
1.1 研究对象
收集2016年1月至2020年1月于我院就诊的卵巢癌患者200例作为研究对象。以随机数字表法分为奥拉帕利组(n=94)和联合治疗组(n=106)。奥拉帕利组仅采用奥拉帕利进行治疗,联合治疗组采用奥拉帕利联合阿帕替尼进行治疗。纳入标准:①符合《卵巢癌诊疗规范(2018年版)》[6]中卵巢癌诊断标准;②无炎症、感染且可正常交流者;③预计生存期>3个月。排除标准:①合并凝血、精神异常或伴有自身免疫疾病者;②治疗期间未能完成随访者;③对研究所用药物过敏者。所有患者及其家属对本次研究知情且已签署知情同意书,研究已获得我院伦理委员会批准。
奥拉帕利组年龄为43~69岁,联合治疗组年龄为45~68岁。奥拉帕利组和联合治疗组的一般资料比较差异均无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
1.2 研究方法
1.2.1 治疗方法
奥拉帕利组采用奥拉帕利进行治疗,200mg/d,2次/d;联合治疗组组采用奥拉帕利联合阿帕替尼进行治疗,奥拉帕利服用方法同奥拉帕利组,阿帕替尼起始剂量为500mg/次,1次/d。两组服药时间均为餐后30min口服,以28d为1个观察周期。对耐受患者持续给药至疾病进展,以4周为1个疗程。分别于两组治疗开始前和1个观察周期后采集研究对象的血液样本,以进行相关指标检测。
1.2.2 指标检测
T淋巴细胞水平:采用江苏博美达生命科学有限公司的Life Attune声波聚焦流式细胞仪检测T淋巴细胞水平。
肿瘤标志物及血清SMRP水平:采用酶联免疫吸附试验法检测肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)及血清SMRP水平。实验步骤:设置10个标准孔并准备相应水平标准品,设置1个空白孔及若干待测样品,在10μL待测样品中加入40μL样本稀释液,封板膜封板,置于37℃水浴箱温育30min,清洗反应板5次,每次间隔30s;拍干,在除空白孔以外的各孔中加入酶标液50μL,封膜温育30min,清洗反应板5次,每次间隔30s;拍干,在各孔中加入显色A液、B液各50μL,轻轻震荡混匀,37℃避光环境下显色15min,在反应孔内加入终止液5μL/孔以终止反应,450nm波长测量每孔吸光度,查出上述指标水平。
血清MALAT-1水平:采用实时荧光定量法检测血清MALAT-1水平。实验步骤:将1mL TRNzol加入血清样本取总DNA并检测其纯度和浓度,提取2μg总DNA并加入内参GAPDH及目的小分子RNA MALAT-1逆转录引物,42℃ 15min,85℃ 5s,逆转录合成cDNA;荧光定量PCR的循环参数设定为95℃每10min,然后95℃每15min,60℃每1min,一共40个循环。使用Primer 5.0软件对引物序列进行设计,MALAT-1引物序列上游:5′-TCACTAAAGGCACCGAAGG-3′,下游:5′-CCAGAAAGAGGGAGTTGAGG-3′;内参GA PDH引物序列上游:5′-GGTGAAGGTCGGAGTCAACG-3′,下游:5′-CAAAGTTGTCATGGATGHACC-3′,Ct值(2-△△Ct)法表示MALAT-1。
1.2.3治疗效果评估
治疗效果评估:参照世界卫生组织(World Health Organization,WHO)实体瘤疗效评估标准及国际妇科肿瘤学会(International Gynecologic Cancer Society,IGCS)卵巢癌疗效判断标准,其中完全缓解为可测量病灶消失和/或CA125值降至正常范围维持4周以上;部分缓解为可测量病灶消失和/或CA125值下降≥50%;疾病稳定为可测量病灶消失和/或CA125值下降<50%或无变化;疾病进展为病灶大小和/或CA125值持续增长,疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
远期疗效评估:对所有入组卵巢癌患者进行为期3年的电话随访,对比两组1年、3年生存率。
1.3 统计学方法
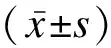
2 结果
2.1 两组T淋巴细胞水平比较
两组治疗前T淋巴细胞水平对比,差异无统计学意义(P>0.05)。两组治疗后CD3+T细胞、CD4+T细胞、CD4+/CD8+水平均高于治疗前,CD8+T细胞水平均低于治疗前,差异具有统计学意义(P<0.05)。治疗后,与奥拉帕利组相比,联合治疗组的CD3+T细胞、CD4+T细胞、CD4+/CD8+水平均显著增高,而CD8+T细胞水平显著降低,差异具有统计学意义(P<0.05),见表2。

表2 两组T淋巴细胞水平比较
2.2 两组肿瘤标志物水平比较
两组治疗前肿瘤标志物水平对比,差异无统计学意义(P>0.05)。治疗后,两组肿瘤标志物CEA、CA125、CA153的水平低于治疗前(P<0.05)。与奥拉帕利组相比,联合治疗组肿瘤标志物CEA、CA125、CA153的水平均显著降低,差异具有统计学意义(P<0.05),见表3。

表3 两组肿瘤标志物水平比较
2.3 两组血清SMRP、MALAT-1水平比较
两组治疗前血清SMRP、MALAT-1水平对比,差异无统计学意义(P>0.05)。两组治疗后血清SMRP、MALAT-1水平低于治疗前(P<0.05)。与奥拉帕利组相比,联合治疗组血清SMRP、MALAT-1水平显著降低,差异具有统计学意义(P<0.05),见表4。

表4 两组血清SMRP、MALAT-1水平比较
2.4 两组治疗效果比较
联合治疗组的疾病控制率为93.40%,高于奥拉帕利组的疾病控制率84.04%,差异具有统计学意义(P<0.05),见表5。
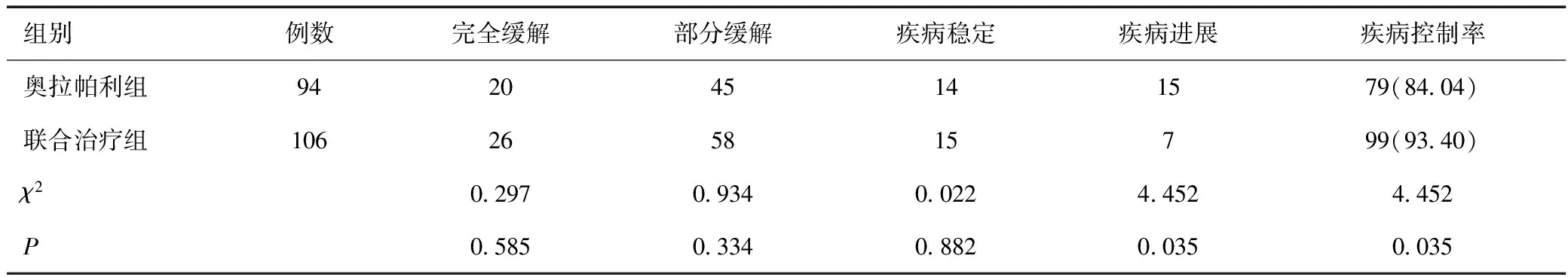
表5 两组治疗效果比较[n(%)]
2.5 两组远期疗效比较
如表6、图1所示,联合治疗组1年生存率、3年生存率均明显高于奥拉帕利组,差异具有统计学意义(P<0.05)。
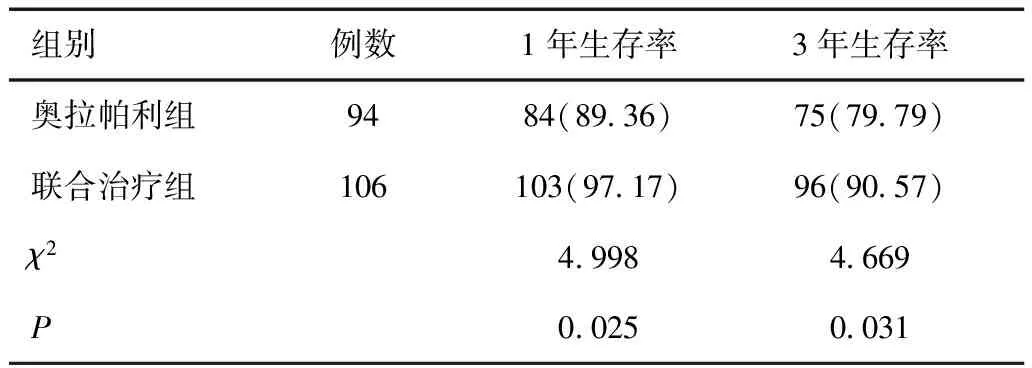
表6 两组远期疗效比较[n(%)]

图1 1年、3年生存曲线图
3 讨论
3.1 卵巢癌的临床治疗
卵巢癌是一种恶性肿瘤,其整体发病率略低于其他妇科肿瘤,但部分患者在确诊时已处于晚期阶段,病死率较高。目前,卵巢癌的临床治疗以手术治疗为主,辅以药物化疗,加之维持治疗,形成综合治疗模式。作为PARP抑制剂的代表药物,奥拉帕利可通过抑制基因同源重组缺陷,杀死突变肿瘤细胞,治疗有特异性DNA修复缺陷的肿瘤;此外,可修复化疗后DNA损伤,降低血清CA125水平[7-9]。近年来,随着分子靶向药物研究的不断进展,抗血管生成药物被用于卵巢癌的维持治疗。阿帕替尼是一种小分子酪氨酸激酶抑制剂,由我国自主研制,可高度地选择性结合并抑制血管内皮生长因子受体活性。其作为新型的口服小分子抗血管生成抑制剂,临床常将其作为晚期胃癌三线及以上治疗药物。有研究显示,阿帕替尼可能通过阻断血管内皮生长因子与血管内皮生长因子受体2结合及血管内皮生长因子受体2自磷酸化,抑制血管内皮生长因子在刺激内皮细胞增殖、迁移和降低微血管密度方面的功能,进而发挥其抗肿瘤的作用[10-12]。
3.2 奥拉帕利联合阿帕替尼对卵巢癌免疫细胞及肿瘤标志物的影响
既往研究显示,免疫功能是生物体进化、个体发育过程中相对重要的防卫能力,亦是肿瘤微环境的重要组成部分,其中肿瘤细胞通过自分泌与旁分泌促进肿瘤的生长与增殖[13]。T淋巴细胞不仅在免疫耐受中发挥着重要作用,亦在肿瘤免疫逃逸中发挥作用,多表现为CD3+T细胞、CD4+T细胞、CD4+/CD8+水平下降,CD8+T细胞水平升高,表明在卵巢癌发生发展中伴随免疫水平下降[14]。在本文研究中,经联合治疗组治疗后,T淋巴细胞水平改善程度显著优于奥拉帕利组,说明两者联合可提高卵巢癌患者机体免疫功能,防止肿瘤微环境向促进卵巢癌方向发展。
血清肿瘤标志物是临床用于筛查恶性肿瘤的常用手段,其中CEA、CA125、CA153为常见的卵巢癌特异性指标,CEA是一种广谱肿瘤标志物,CA125、CA153是糖类抗原肿瘤标志物,上述三种指标在卵巢癌诊断中具有一定价值,联合检测可提高肿瘤检出率[15-16]。在本文研究中,通过对卵巢癌患者血清CEA、CA125、CA153肿瘤标志物水平进行检测,间接反映肿瘤恶性程度,结果显示,奥拉帕利联合阿帕替尼在卵巢癌治疗中可显著降低肿瘤标志物水平,其原因可能为两药联合可发挥互补作用,可能通过某种特定机制调节肿瘤标志物水平,但具体机制有待后续研究进一步证实。
3.3 奥拉帕利联合阿帕替尼对卵巢癌血清指标的影响
有研究显示,SMRP是锚定于细胞表面的MSLN经过酶修饰后的异构体,可作为筛查恶性肿瘤的血清指标之一,其在卵巢癌患者中表达水平显著高于良性卵巢肿瘤患者[17-18]。MALAT-1长度超过8000 nt,属于长链非编码RNA,定位于染色体11q13.1,全长8.7 kb,在乳腺癌、胰腺癌、前列腺癌等多种恶性肿瘤中表达异常,且在肿瘤发生、发展和转移过程中发挥着重要功能,其表达升高对肿瘤的发生具有促进作用[19-20]。改善肿瘤患者生存情况是抗肿瘤治疗的最终目的[21]。在本文研究中,奥拉帕利联合阿帕替尼可有效降低卵巢癌患者血清SMRP、MALAT-1水平,提升随访期内生存率,延长生存时间,说明两者联合可通过下调SMRP、MALAT-1水平表达,阻滞卵巢癌进展和优化远期结局。
综上所述,本文研究结果显示,奥拉帕利联合阿帕替尼在卵巢癌治疗中可降低患者血清肿瘤标志物及SMRP、MALAT-1水平,提高机体免疫功能,改善治疗效果,延长生存时间,在一定程度上改善总体治疗效果,值得在临床上推广。

