结核病免疫治疗的研究进展
王丽 杨恩卓 沙巍 沈洪波
耐药结核病的治疗,除了开发新型抗结核药物外,提高宿主免疫应答水平和减轻宿主免疫炎性损伤的免疫治疗逐渐受到重视。结核分枝杆菌(MTB)通过气溶胶感染人体后,被肺部巨噬细胞吞噬清除,MTB特异性抗原被递呈给免疫细胞后启动获得性免疫,各类免疫细胞活化增殖后分泌细胞因子,对MTB进行杀伤并形成免疫记忆以应对再次感染[1]。同时,MTB在进化过程中形成了自己的防御机制来逃避宿主免疫应答,包括但不限于阻止吞噬体-溶酶体融合、抑制细胞自噬、干扰细胞骨架形成、诱导感染细胞坏死、影响线粒体功能、阻止细胞膜修复等[2]。失能的巨噬细胞不再第一时间迁移至肺部淋巴结完成抗原递呈启动获得性免疫,而是持续在肺部徘徊,从而为MTB的增殖感染提供了时间窗。此外,MTB也会对免疫细胞的杀伤产生拮抗作用,通过钝化细胞因子的杀伤作用逃避免疫清除,造成持续性感染[2]。
本文对细胞因子、免疫细胞、治疗性疫苗和免疫调节剂等在结核病免疫治疗中的研究进展作一综述,旨在为结核病的临床研究和机制探索提供思路。
细胞因子治疗
细胞因子治疗是通过注射或者雾化吸入的方式提高宿主体内特定细胞因子的含量,对宿主进行免疫干预来激发宿主的抗结核免疫应答。细胞因子治疗的优点在于给药方式可控,由于细胞因子在人体内的半衰期较短,对人体的长期影响较小,但也存在需要长期持续用药的弊端。关于细胞因子的作用机制和效果见表1。
一、γ-干扰素(interferon-gamma,IFN-γ)
IFN-γ是驱动细胞免疫的关键,能够协调多种保护功能,以增强感染和癌症中的免疫反应,可以通过增强抗原加工和呈递、增加白细胞运输、增强抗微生物功能以及影响细胞增殖和凋亡来发挥其免疫调节作用[3]。IFN-γ在抗结核免疫中发挥着至关重要的作用,IFN-γ激活的巨噬细胞可以有效清除胞内的病原菌感染[4]。一项IFN-γ辅助治疗肺结核或MDR-TB的系统性评价,包括5项雾化给药研究,其结果提示雾化用药有利于改善呼吸系统症状,提高痰菌阴转率,不良反应较少,但缺少高级别循证证据[5]。

表1 细胞因子治疗
二、 粒细胞-巨噬细胞集落刺激因子(cranulocyte-macrophage colony stimulating factor,GM-CSF)
GM-CSF是一种具有免疫激活和调节作用的细胞因子,是由巨噬细胞、T细胞、肥大细胞、自然杀伤细胞、内皮细胞和成纤维细胞分泌的单体糖蛋白。在MTB感染早期,GM-CSF 主要由恒定自然杀伤T细胞(invariant nature killer T cells, iNKT)和γδT细胞分泌,随后特异性的效应T细胞开始分泌GM-CSF并作用于靶细胞,刺激免疫应答[6-7]。动物实验表明,小鼠气管内滴入表达GM-CSF的重组腺病毒1次,24 h后感染MTB,发现重组腺病毒可降低小鼠肺部病菌载量,提高树突状细胞激活水平,增加IFN-γ、肿瘤坏死因子(TNF-α)和诱导型一氧化氮合酶(iNOS)的分泌[8]。提示GM-CSF作为免疫治疗分子有良好的应用前景。GM-CSF可以减少人单核巨噬细胞胞内MTB的生长,且具有良好的安全性和耐受性。此外,采用白细胞介素2(IL-2)和GM-CSF 对MDR-TB小鼠模型进行免疫治疗(IL-2和GM-CSF 均为5000 IU/剂,肌肉注射,感染后第15天开始,每天1次,每周5次,连续4周),可提高小鼠的存活率,降低肺和脾病变中的细菌数,从而提高药物治疗效果[9]。
三、白细胞介素1(interleukin-1,IL-1)
IL-1是一种主要由巨噬细胞分泌,在感染、损伤或抗原攻击后产生的多肽。IL-1家族和Toll样受体(TLR)家族具有相似的功能,与其他细胞因子家族相比,IL-1家族主要与固有免疫相关,包括IL-1α和IL-1β亚型。研究表明,IL-1α/IL-1β的缺失或者分泌不足会导致胞内MTB大量增殖,说明IL-1在感染控制中发挥重要作用[10-11]。β-葡聚糖是一种固有免疫细胞表观遗传和重编程的诱导剂,小鼠腹腔注射β-葡聚糖后,可有效抵御肺部MTB感染,其作用机制是依赖IL-1调节骨髓中造血干细胞重编程,产生针对MTB的保护性受训免疫(trained immunity)[12]。因此,IL-1具有一定的免疫辅助治疗潜能。
四、IL-2
IL-2是一种属于1型辅助性T细胞(helper T cell 1,Th1)免疫应答的细胞因子,具有免疫激活和免疫调节作用,能促进T细胞增殖。有研究表明,持续性的抗原刺激会导致结核特异性T细胞失能,而IL-2治疗可以逆转T细胞失能,重新产生有效的免疫反应[13]。同时,有临床试验表明,IL-2可以加快痰涂片阴转,改善肺部病变[14]。Meta分析结果显示,IL-2免疫辅助治疗MDR-TB患者是安全的,并可以促进CD4+T细胞和NK细胞的增殖和转化,提高患者痰菌阴转率[15]。但也有研究提示,IL-2治疗对结核感染并没有明显改善效果[14]。因此,IL-2用于临床治疗结核感染需要对每一例患者的免疫状态进行系统评价并制定个性化治疗策略。一项评估IL-2是否增强MTB患者的临床疗效的多中心前瞻性队列研究(NCT03069534,Ⅱ/Ⅲ期临床试验)中,重组人源IL-2(rhIL-2)组患者给予低剂量rhIL-2(500 000 U/m) 皮下注射,隔日1次,连续30 d[16],共4个疗程(分别在第1、3、5、7个月),该研究未有前期数据报道;另一项尚未完成的Ⅳ期临床试验(NCT04766307),旨在比较2H-R-Z-E/4H-R+IL-2 (每日500 000 U,第一个月皮下注射)与2H-R-Z-E/4H-R标准方案对初治涂阳肺结核的疗效和安全性。这两项研究的结果值得期待。
免疫细胞治疗
免疫细胞治疗指通过体内激活自体免疫效应细胞,或体外扩增自体或异体免疫效应细胞,然后回输给患者纠正免疫失衡和改善免疫功能,提高宿主抗感染应答水平[17]。细胞治疗为MDR-TB、XDR-TB和结核病的个体化治疗提供了新的可能[16]。免疫细胞治疗效果持续时间长,更具有特异性,目前具有良好应用前景的免疫细胞见表2。
一、Vγ2Vδ2T细胞
Vγ2Vδ2T细胞是人类和灵长类动物特有的免疫细胞,是外周血γδT细胞的亚群,主要通过裂解细胞、产生细胞因子、调节免疫细胞参与免疫应答[18]。因其具有非主要组织相容性复合体(MHC)限制的优点,且易于体外扩增,因此,可被用于进行细胞免疫治疗。此类细胞可以识别磷酸抗原,包括微生物来源的4-羟基-3-甲基-2-丁烯基焦磷酸盐(4-hydroxy-3-methyl-2-butenyl pyrophosphate,HMBPP)和真核细胞(宿主)来源的异戊二烯类代谢物异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)[19]。由于MTB会利用非甲羟戊酸途径产生HMBPP,从而刺激Vγ2Vδ2T细胞产生免疫应答,因此,Vγ2Vδ2T细胞在抗结核感染中起重要作用[20],但MTB感染会损伤Vγ2Vδ2T细胞功能[21]。灵长类动物实验表明,体外扩增回输或者体内刺激增殖Vγ2Vδ2T细胞,可以有效控制结核感染[22]。目前,正在进行一项Ⅰ期临床试验:将来自健康供体的异源性γδT细胞静脉注射给MDR-TB患者,评估γδT细胞的安全性和有效性(NCT03575299)。该研究将MDR-TB患者分为研究组和对照组,两组患者均接受常规药物治疗,研究组每两周注射1次异源性γδT细胞,连续6个月,共12次。因此,针对Vγ2Vδ2T细胞功能改善的免疫治疗策略,是未来研究的重要方向。
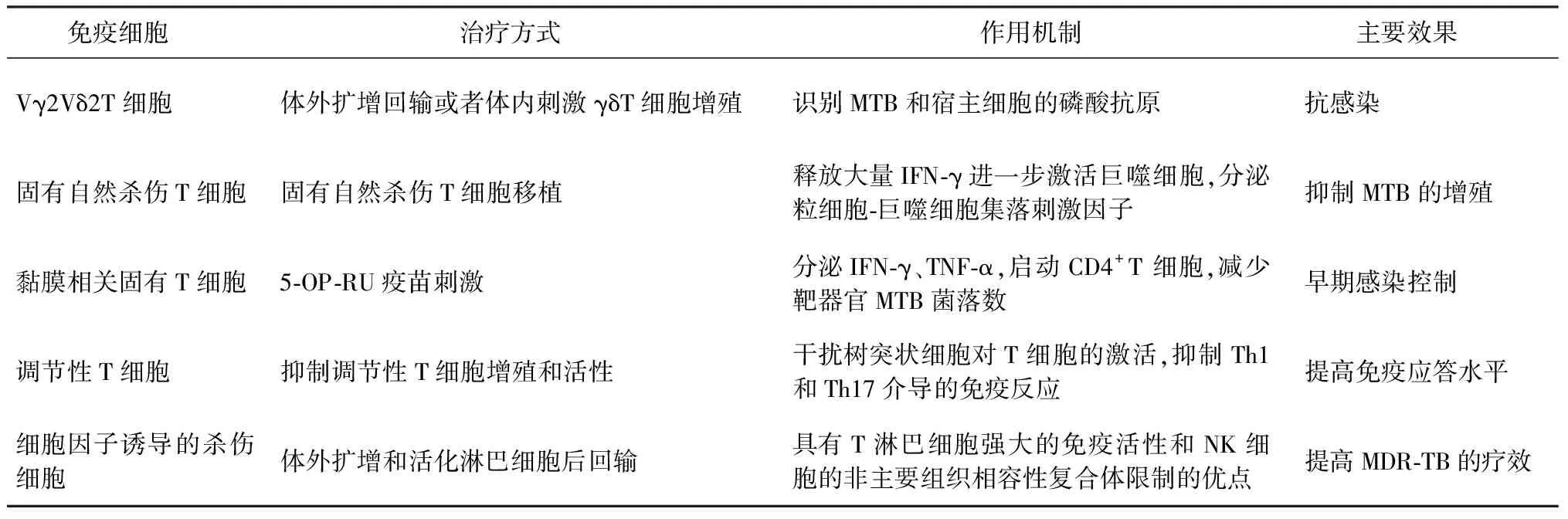
表2 免疫细胞治疗
二、 固有自然杀伤T细胞(invariant natural killer T cells,iNKT)细胞
iNKT细胞是T细胞的一个保守亚群,受分化抗原1 d (CD1d)的限制,并受CD4-CD8-NKT细胞支配。iNKT识别的是糖脂类抗原,包括鞘糖脂、α-半乳糖神经酰胺、α-葡萄糖神经酰胺等[23]。MTB感染巨噬细胞后可激活iNKT细胞,使其释放大量IFN-γ,IFN-γ进一步激活巨噬细胞分泌TNF-α和一氧化氮(NO)并增强吞噬小体和溶酶体对MTB的杀伤作用。同时,MTB感染以CD1d依赖的方式促进iNKT细胞分泌GM-CSF,从而抑制MTB的增殖。小鼠模型表明,结核感染7 d iNKT细胞数量和分泌IFN-γ水平即可达到峰值[24]。同时,接受健康小鼠的脾脏来源iNKT细胞移植的小鼠可以有效控制肺部的结核感染[25]。可见,iNKT细胞属于抗结核感染早期应答细胞,提高iNKT细胞数量可能有助于感染控制,可能具有免疫细胞治疗的应用价值。
三、黏膜相关固有T细胞(mucosal-associated invariant T cell, MAIT)
MAIT细胞占外周血CD3+T细胞的1%~10%, MAIT细胞识别MHC-Ⅰ样蛋白(MR-1)递呈的微生物代谢的核黄素衍生物[26]。与高度多态性的MHC基因不同,人类MR-1几乎是单态的。因此,MAIT细胞可以识别所有抗原提呈细胞呈递的抗原,被称为不受供体限制的T细胞[27]。Kauffman等[28]通过恒河猴MTB模型发现,结核感染会导致MAIT细胞失能,分泌IFN-γ、TNF-α等效应分子能力下降。Sakai等[29]通过小鼠模型发现,在感染早期MAIT细胞可以直接导致 CD4+T 细胞的启动应答延迟,而在慢性感染中,5-OP-RU疫苗驱动的 MAIT细胞扩增可以有效降低慢性MTB感染小鼠脏器的MTB菌落数。因此,在感染后期,MAIT细胞刺激扩增是宿主免疫导向治疗的可选策略之一。
四、 调节性T细胞(regulatory T cells,Treg)
Treg细胞是一类具有显著免疫抑制作用的细胞亚群。参与Treg细胞免疫抑制功能的关键细胞因子有IL-10、TGF-β和IL-35。Treg细胞通过依赖细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)的机制下调共刺激分子CD80或CD86,来干扰树突状细胞对T细胞的激活,另外,抑制Th17和Th1介导的炎性反应[30]。Geffner等[31]评估了MDR-TB患者、药物敏感性结核病(drug-sensitive tuberculosis,DS-TB)患者和健康对照者的外周血单个核细胞对MTB的免疫应答,发现结核感染会导致Treg细胞比例增加,MDR-TB患者外周血中Treg显著高于药物敏感性结核病患者。Davids等[32]通过对XDR-TB 患者(31例)、DS-TB患者(20例)和结核分枝杆菌潜伏感染者(20例)的血液和肺组织进行分析,发现XDR-TB 患者的CD4+CD25+FoxP3+Treg细胞比例较DS-TB 患者和结核分枝杆菌潜伏感染者显著升高,且XDR-TB 患者的Treg细胞能显著抑制T细胞增殖(抑制率高达90%)。这些研究数据表明,Treg细胞可能导致MDR-TB和XDR-TB患者的免疫功能障碍和MTB持续存在,Treg细胞可以作为免疫治疗干预的潜在靶点。
五、细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)
CIK细胞输注是自体细胞免疫疗法的一种,通过将人外周血单个核细胞与IFN-γ、抗CD3单克隆抗体和IL-2等多种细胞因子连续孵育,获得的体外扩增和活化的T淋巴细胞。这些细胞保留了效应记忆T细胞亚群的少数特征,同时也兼具T淋巴细胞强大的免疫活性和NK细胞的非MHC限制性优点。CIK免疫疗法已被广泛用于肿瘤患者的治疗,其中包含血液肿瘤和实体肿瘤[33],但目前CIK免疫治疗肿瘤仍处于适应证研究阶段。CIK免疫治疗结核病患者也还仅有个案报道,缺乏高级别循证证据支持。有案例报道,1例32岁常规治疗无效的MDR-TB患者进行3个疗程的CIK免疫治疗(隔天注射1次, 每个疗程3次),患者病情明显改善,且随访3年无复发[34]。可见,CIK免疫治疗是结核病治疗和预防复发的有效方法。Xu等[35]也报道了相似案例,对1例常规治疗无效的MDR-TB患者进行8个疗程的CIK免疫治疗联合二线抗结核药物治疗(隔天注射1次,每个疗程3次),随访2年,病情稳定。由此可见,CIK治疗对结核病的治疗效果有一定的有效性,但还需要高质量临床研究系统探索CIK辅助治疗MDR-TB患者的有效性和安全性。
治疗性疫苗
随着新型结核分枝杆菌疫苗研制快速发展,目前有10多种候选疫苗进入临床前研究阶段。新型结核分枝杆菌疫苗按照免疫策略分为:初次疫苗,即在首次暴露于MTB之前施用的预防疫苗,主要适用人群是新生儿;预防性暴露后疫苗,即增强疫苗,主要适用人群是结核分枝杆菌潜伏感染,及接种过卡介苗的青少年和成年人;治疗性疫苗,适用人群是再发结核病的高风险人群及活动性结核病患者,可用于结核病的辅助治疗[36]。
一、灭活疫苗
M. vaccae(MV)疫苗由热灭活的母牛分枝杆菌(Mycobacteriumvaccae)制成,是一种用于活动性结核病辅助治疗的免疫调节剂。Gong等[37]在小鼠模型中证明,MV疫苗对肺部MTB感染具有保护作用。Meta分析结果也显示,MV辅助治疗可有效提高痰菌阴转率。既往文献报道342例初治肺结核患者经随机分组治疗1年后,MV疫苗组的细菌学复发率(3.0%)显著低于对照组(5.6%),MV疫苗主要用于初治肺结核的免疫治疗和短期抗结核药物治疗的辅助治疗[38]。目前,MV已经被批准用于结核病治疗[38]。
M. indicus pranii (MIP)疫苗,又称Mw疫苗,可诱导Toll样受体信号通路激活固有免疫,并刺激T细胞免疫应答。在一项前瞻性随机双盲安慰剂对照多中心临床试验中,890例肺结核患者随机接受6次MIP疫苗(5×108bacilli)或安慰剂皮下注射,每2周1次,连续2个月。结果显示,虽然两组痰涂片阴转率差异无统计学意义,但在第四周MIP疫苗组痰培养阴转率显著高于安慰剂组(67.1%和57%,P=0.0002)[39]。
DAR-901疫苗,也称Mk疫苗,是由热灭活的Mycobacteriumkyogaensesp.Nov制成。Ⅰ期和Ⅱ期临床试验表明,皮内注射3~12次DAR-901联合抗结核药物治疗可提高痰菌阴转率,促进病变吸收,增强Th1细胞反应[16]。
二、 亚单位疫苗
亚单位疫苗由MTB的部分细胞成分制备,可用于结核病患者的辅助治疗和LTBI者的预防性治疗。卡介苗多糖核酸注射液(BCG-PSN,商品名SIQIKANG)是目前唯一获得许可的结核病免疫治疗疫苗(批准号:S20020019)。BCG-PSN 的主要成分是从卡介菌中经热酚法提取出的具有免疫调节功能的多糖和核酸。BCG-PSN除了对结核病的免疫治疗作用,实践还发现对预防和治疗慢性支气管炎、哮喘亦有良好效果[40-41]。同时,有研究表明BCG-PSN也对慢性荨麻疹、扁平苔藓、特应性皮炎、过敏性疾病和疱疹有效[42-44]。
其他4种重组蛋白疫苗:M72/AS01E、H56/IC31、ID93/GLA-SE和AEC/BC02也已进入Ⅰ期或Ⅱ期临床试验。M72/AS01E是由Mtb39和Mtb32的重组嵌合蛋白M72制备而来,能与AS01E佐剂一同增强免疫应答[45]。Ⅰ/Ⅱa期临床试验显示,M72/AS01E临床耐受性良好,能引起较强的M72特异性体液免疫反应和CD4+T细胞反应,但引起的CD8+T细胞反应较弱。Ⅱb期临床试验表明,M72/AS01E(肌肉注射0.5 ml/次,共2次,间隔1个月)可以降低约54%HIV阴性的LTBI的成人转变为活动性结核病的风险[45]。
H56/IC31是由3种抗原(MTB Ag85B、ESAT-6和Rv2660c)的重组融合蛋白与免疫佐剂IC31 制备而来。2015年,一项开放的Ⅰ期临床试验评估了H56/IC31对MTB感染者和健康成人的安全性和免疫原性。该研究分别给予MTB感染者低剂量(15 μg H56蛋白+500 nmol IC31)和高剂量H56/IC3(50 μg H56蛋白+500 nmol IC31)疫苗,肌肉注射3次,每次间隔56 d。研究发现H56/IC311有较好的安全性,且能诱导抗原特异性IgG和表达Th1型细胞因子的 CD4+T细胞[46]。然而,H56:IC31的治疗效果还缺少系统性临床评价。
三、核酸疫苗
核酸疫苗是将编码MTB抗原的基因与真核表达载体结合构建出的疫苗。核酸疫苗不仅能有效诱导体液免疫应答和Th1型细胞免疫应答,还能激发特异性细胞毒性T淋巴细胞应答。GX-70是由4个MTB抗原质粒和1个重组Flt3配体组成,是唯一获批临床试验的结核病DNA疫苗。GX-70的Ⅰ期临床试验原计划评价GX-70对治疗失败的或复发高风险的肺结核患者的辅助治疗效果。由于研究费用问题,该研究已停止[16]。
免疫调节剂
维生素D是固有免疫系统的激活剂,对维持NK细胞、NKT细胞和γδT细胞活性起重要作用,维生素D及其活性代谢物1,25-二羟基维生素D3在宿主对MTB的免疫防御中发挥重要作用,目前多项维生素D辅助治疗MTB临床试验正在进行中。动物模型研究发现,乳酸菌株(CNCM I-5314)经鼻吸入,可增加肺Th17细胞和RORγt+Treg细胞聚集,减轻MTB感染小鼠肺部炎性病变程度[47],有一定的免疫辅助治疗潜力。
总结和展望
目前免疫治疗已经进入多种肿瘤一线治疗,已成为多种肿瘤新型、广泛应用的突破疗法。结核病是一种慢性感染性疾病,宿主免疫与疾病发生发展和转归密切相关。结核病免疫疗法已取得许多进展,部分免疫治疗制剂已上市或进入临床试验阶段[48]。但是宿主导向的免疫治疗,还有很多问题亟待解决。例如由于结核病患者大多数处于免疫抑制状态,通过免疫治疗增强免疫力的同时,还需要严密监控患者的免疫水平,避免发生过度免疫造成炎症性损伤。例如临床发现有应用程序性死亡受体1(programmed cell death protein 1,PD-1)抑制剂的肿瘤患者,引发病灶周围广泛病理性损伤[49-50]。因此,需要在治疗全程对患者的免疫水平进行实时监控,根据患者的免疫状态制定个性化的精准治疗方案。另外,患者在免疫治疗结束后,如何调节免疫水平恢复正常以避免持续的高免疫状态诱发自身免疫性疾病也需警惕。宿主导向的免疫治疗是一项复杂的系统工程,深入探索免疫调节机制,结合高质量临床研究,将为结核病治疗提供新的机遇。
利益冲突所有作者均声明不存在利益冲突
作者贡献王丽:初稿修改,文献查阅及校对;杨恩卓:起草文章初稿;沙巍和沈洪波:稿件审阅修改

