增溶剂作用下二氧化碳在稠油中的溶解机理*
于田田,郝婷婷,翟 勇,3,林吉生,3,杨红霞,王创业
(1.中国石油大学(华东)石油工程学院,山东青岛 266580;2.中国石化胜利油田石油工程技术研究院,山东 东营 257000;3.山东省稠油开采技术重点实验室,山东东营 257000;4.中国石油大学(华东)化学化工学院,山东青岛 266580)
0 前言
随着CO2驱技术的发展,CO2驱已成为提高稠油采收率的重要技术手段,得到了较广泛的应用[1]。CO2微观驱替效率理论上可以达到100%,但在实际生产过程中,驱油效率很大程度上取决于CO2在原油中的溶解及溶解后原油性质的变化[2-3]。CO2溶解于稠油中,可以降低稠油的黏度、降低界面张力[4],有利于提高稠油采收率。增溶剂可进一步提高CO2在稠油中的溶解度、降低体系的黏度,从而提高CO2混相驱油能力,有效提高驱油效率[5]。增溶剂与稠油和CO2应该具有良好的相容性,能够明显提高CO2的溶解度,降低平衡压力。近年来,国内在增溶剂的开发研究方面取得了一定成果,但仍然缺乏系统性的研究。
乙二醇二甲醚分子含有两个醚基,是潜在的CO2增溶剂[6]。本文采用实验测定与分子动力学模拟相结合的研究方法,首先以乙二醇二甲醚为增溶剂,测定了其对CO2在稠油中的增溶效果;然后利用分子动力学模拟方法计算不同增溶剂含量下CO2的溶解度参数,解释乙二醇二甲醚对CO2在稠油中的增溶作用;再通过分析乙二醇二甲醚与CO2的氧原子的径向分布函数,在微观上解释分子间的相互作用,从分子水平上解析了增溶剂作用下CO2在稠油中的溶解作用机理。
1 实验部分
1.1 材料与仪器
胜利油田稠油,密度为0.9315 g/mL(20 ℃),黏度为467 mPa·s(50 ℃),含饱和分47.1%、芳香分29.9%、胶质21.8%;二氧化碳(99.9%)、氮气(99.9%),青岛正元气体有限公司;无水乙醇、正庚烷,分析纯,西陇化工股份有限公司;甲苯,分析纯,国药集团化学试剂有限公司;石油醚,分析纯,上海沃凯生物技术有限公司;乙二醇二甲醚,工业级,国药集团化学试剂有限公司。
CQF-05型高压反应釜,大连精艺反应釜有限公司;DM-4500 型精密密度计、MCR-302 型流变仪,Anton Paar 公司;Tower 7810 型计算工作站,Dell公司。
1.2 实验方法
(1)稠油基本性质的测定
采用精密密度测定仪测定稠油的密度,在U 型管内注入稠油,设定温度,待显示的密度数值稳定后记录。采用流变仪在50 ℃下测定稠油的黏度。按照NB/SH/T 0509—2010 的标准方法,利用正庚烷、甲苯抽提胜利稠油,将油样分成饱和分、芳香分、胶质、沥青质四个组分,分别称重,得到稠油的四组分含量。
(2)二氧化碳溶解度测定
将一定质量的体积为V0的胜利稠油注入高温高压釜内,向釜内通入CO2气体至压力为2 MPa,开启放空阀,将装置内空气放空,重复3次。继续通入CO2,当釜内压力到达设定压力时,关闭CO2入口,设定实验温度,开启加热和搅拌,记录釜内压力。每隔20 min 记录1 次,当3 次记录的压力数值相同时,气体在稠油中的溶解达到平衡,记为平衡压力p1。
分别往稠油中按稠油质量加入5%、10%的乙二醇二甲醚增溶剂,混合均匀后,按照上述实验步骤进行CO2溶解实验,考察增溶剂对CO2的增溶作用。
CO2在稠油中的溶解量通过充入CO2的物质的量减去溶解平衡时未溶解的CO2的物质的量进行计算。充入CO2的物质的量n0按式(1)计算:
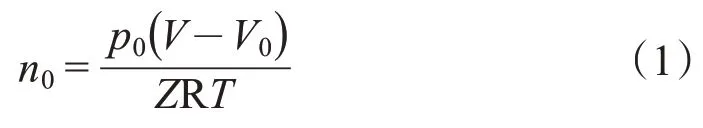
其中,p0—高压反应釜内的起始压力,Pa;V—高压反应釜的有效体积,m3;V0—注入釜中的稠油体积,m3;Z—对应压力下二氧化碳的压缩因子;R—摩尔气体常数,J/(mol·kg)。
溶解平衡时,未溶解的CO2的量n1按式(2)计算:
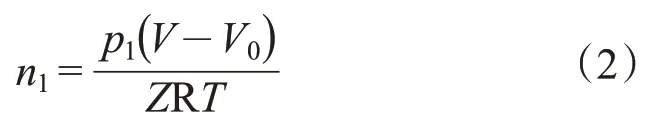
CO2的溶解量按式(3)计算:

亨利系数k可以反映气体在液体中溶解的难易程度,直观地显示气体的溶解性质。根据亨利定律可以按式(4)计算亨利系数k:

其中,p—溶解平衡时CO2的压力,Pa;b—CO2在稠油中的浓度,mol/kg稠油。
(3)溶解度参数与径向分布函数的计算
采用分子动力学模拟方法计算不同增溶剂含量下CO2的溶解度参数。首先在Material Studio 7.0软件包中的Amorphous cell模块构建包含CO2-乙二醇二甲醚的模拟体系,采用Discover 模块进行模拟计算。模拟体系中,乙二醇二甲醚的摩尔含量分别设定为5%、10%、15%和20%,平衡温度分别设定为60 ℃和80 ℃。计算开始前,对体系进行优化,快速将体系的总能量降到较低水平。采用的力场为出自量子力学从头算方法的Compass 力场,系统为NPT 系综,以Anderssen 法对体系的温度和压力进行控制。模拟时间为2000 ps,步长为1 fs,每5000步输出1 帧。采用基于Group 统计方法,计算粒子间的非化学键范德华力与库仑力,截断半径设为15.5 Å。当体系的温度和密度趋于平稳时,认为体系达到平衡。分析平衡体系的内聚能密度得到溶解度参数,并利用Forcite模块分析径向分布函数。
2 结果与讨论
2.1 增溶剂对二氧化碳的增溶作用
利用溶解实验中测定的压力数据,根据公式(1)—(3)计算不同条件下CO2在稠油中的溶解量,再根据公式(4)计算CO2在稠油中的亨利系数,结果如表1所示。从表1可以看出,在温度一定时,随起始压力的增大,CO2在稠油中的溶解度增大;在起始压力一定时,随温度的升高,CO2在稠油中的溶解度减小。乙二醇二甲醚可有效提高CO2在稠油中的溶解度。在温度为50 ℃、起始压力为5 MPa 的条件下,向稠油中加入5%的乙二醇二甲醚可将CO2在稠油中的溶解度从0.178 mol/kg 提升到0.470 mol/kg;当乙二醇二甲醚含量增至10%时,1 kg 的稠油中可溶解0.510 mol 的CO2。加入乙二醇二甲醚后,CO2在稠油中的亨利系数显著降低。亨利系数是分子间作用力的反映,随增溶剂含量增加而降低,说明CO2与稠油体系分子间的斥力作用减弱,增溶剂提高了分子间的相容性。分子间的相互作用将通过分子动力学模拟进行计算,以给出具体解释。
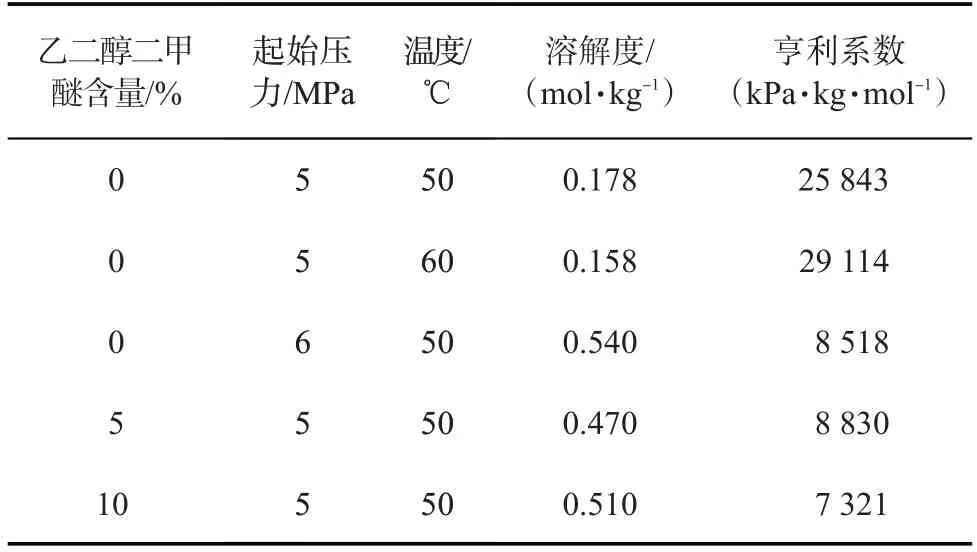
表1 CO2在稠油中的溶解度与亨利系数
2.2 增溶剂作用下二氧化碳的溶解度参数
溶解度参数为液体内聚能密度的平方根[7],可以利用量热法[8]与基团贡献法[9]进行测定或计算。分子动力学模拟方法可以计算一定温度、压力条件下相关体系的热力学性质[10-12],并实现对常见化合物与混合体系中组分溶解度参数的计算[13]。
CO2在不同温度、压力下密度的计算值与实验值如表2 所示。结果显示,密度的模拟计算值与实验值吻合较好,相对误差均在5%以内,验证了模拟策略的可行性与此研究方法的可靠性。
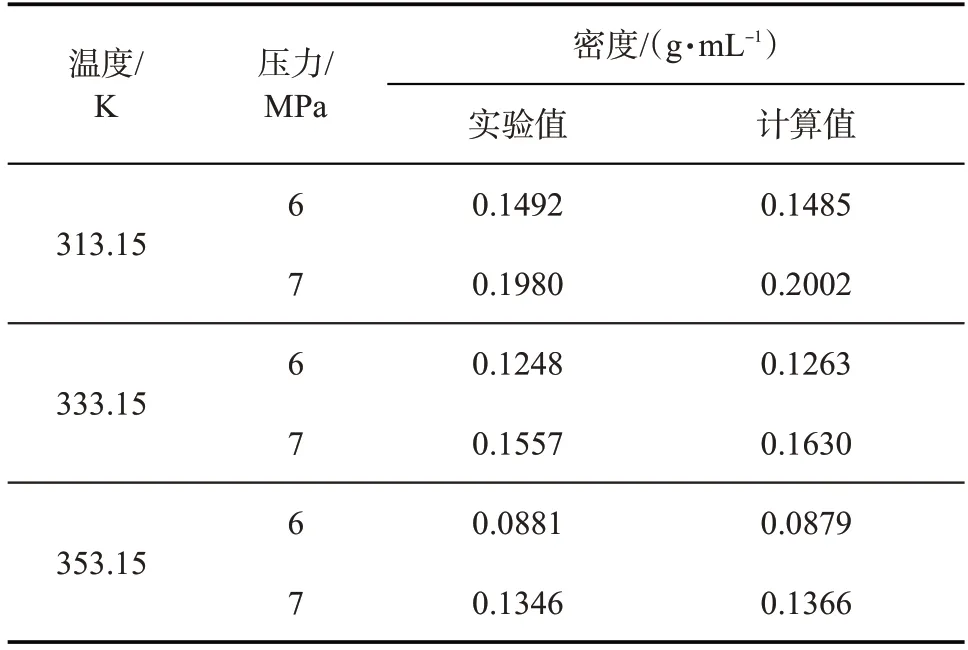
表2 CO2在不同温度、压力下密度的实验值与计算值
溶解度参数的分子动力学模拟结果如图1 所示。从图1可以看出,温度、压力与乙二醇二甲醚含量对CO2的溶解度参数均有明显的影响。其他条件相同时,温度高则溶解度参数小。提高压力,溶解度参数升高,但是,压力为10 MPa与12 MPa下的溶解度参数相差不大,这是由于此压力下的二氧化碳处于超临界状态,单纯增加其压力并不能明显增加其溶解度。此两项结果符合普遍化的溶解规律,即:低温、高压有利于挥发性溶质的溶解。随着乙二醇二甲醚含量的增大,溶解度参数相应提高。在温度为60 ℃、压力大于8 MPa时,当乙二醇二甲醚的摩尔分数超过10%时,溶解度参数可达12 MPa1/2。乙二醇二甲醚有效提高了CO2的溶解度参数,对二氧化碳具有提高溶解度的作用。计算结果与实验结果相一致。
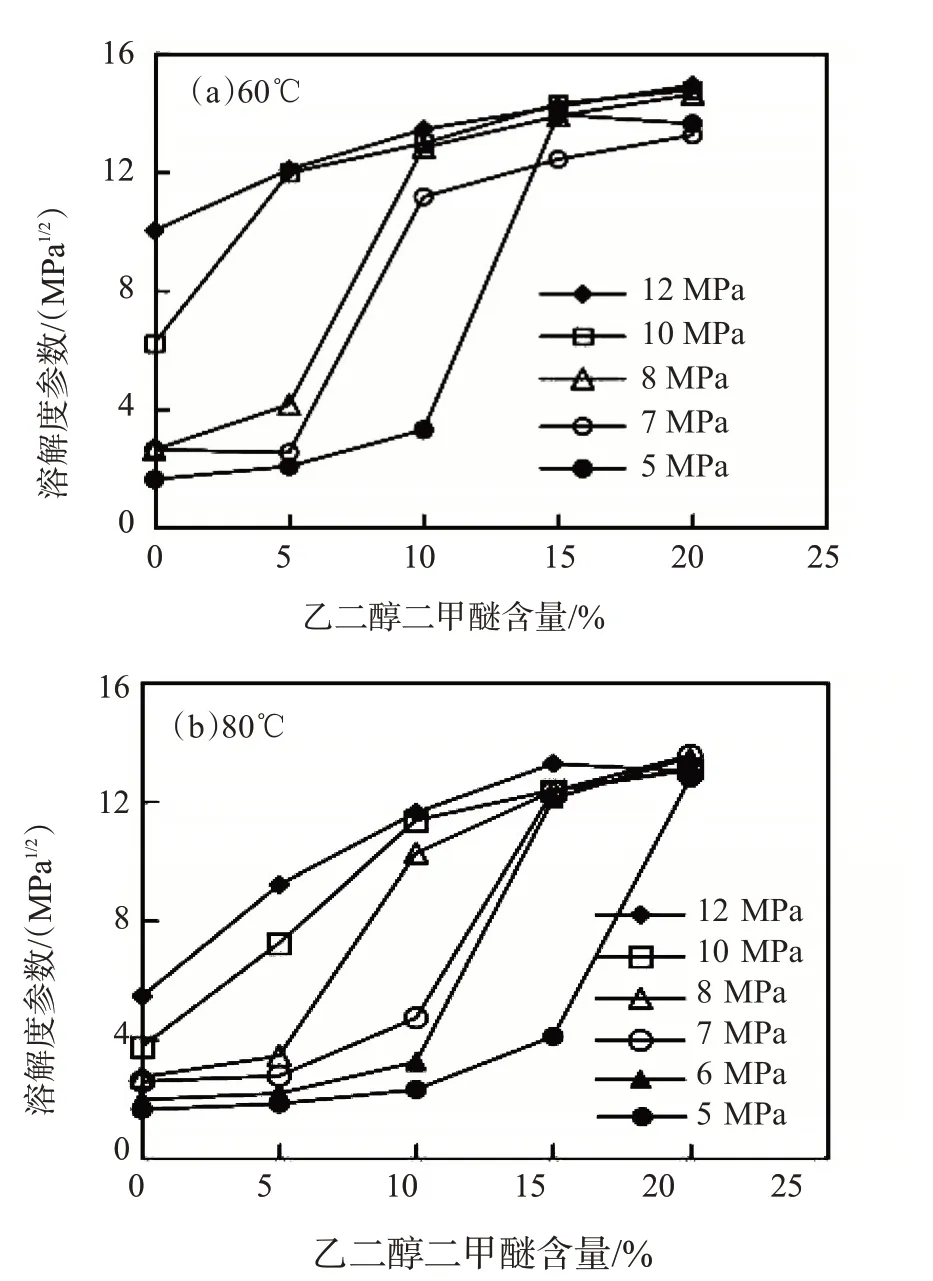
图1 不同温度、压力下CO2的溶解度参数
2.3 增溶剂提高二氧化碳溶解度的微观机理
CO2的溶解度参数随增溶剂乙二醇二甲醚含量的增加而增大,这说明增溶剂与CO2间的斥力作用随着乙二醇二甲醚含量增加而减弱。乙二醇二甲醚分子与CO2间的相互作用可用乙二醇二甲醚的氧原子对CO2氧原子的径向分布函数进行表征。不同温度(60、80 ℃)、压力(5、6、8、10、12 MPa)下,不同乙二醇二甲醚含量(5%、10%、15%、20%)下CO2氧原子与乙二醇二甲醚氧原子的径向分布函数见图2。
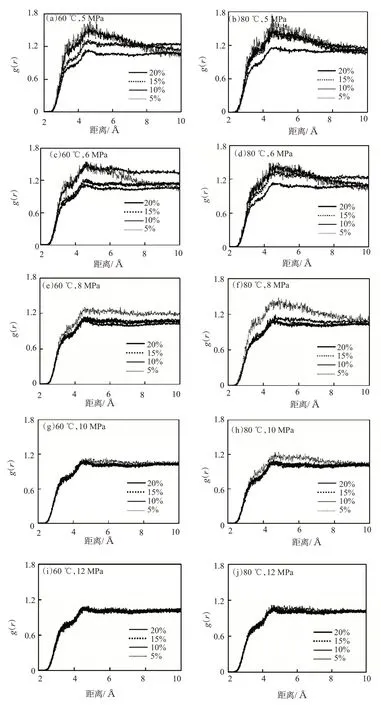
图2 不同温度、压力下CO2氧原子与乙二醇二甲醚氧原子的径向分布函数
由图2 可知,压力较低时,距CO2氧原子0.5 nm左右,有一个乙二醇二甲醚氧原子的浓度峰,说明CO2分子周围的乙二醇二甲醚浓度相较于其体相浓度有着明显的提高,证明此时乙二醇二甲醚和CO2分子间的作用力以吸引力为主。随着压力的增加,CO2分子周围的乙二醇二甲醚分子减少。压力提高至12 MPa 时,几乎没有浓度峰出现,说明高压下分子间的吸引力作用明显减弱。由径向分布函数随压力变化的规律可解释压力对溶解度参数的影响,即:压力较低时,增溶剂分子与CO2分子间的相互作用以吸引力为主,增溶剂可以提高CO2的溶解度参数;而压力较高时,分子间作用不再以吸引力为主,增溶剂含量的提高不能有效提高其溶解度参数。在相同压力下,温度较高时,CO2周围的乙二醇二甲醚分子相对较少,说明较高的温度下分子间的距离增加,导致分子间吸引力减弱,CO2与乙二醇二甲醚间的溶解度参数降低,不利于CO2的溶解。
3 结论
CO2在稠油中的溶解度随压力增加而增大,随温度升高而减小。乙二醇二甲醚可以明显提高CO2在稠油中的溶解度,可以作为增溶剂使用。
分子动力学模拟结果证明,CO2与乙二醇二甲醚之间的溶解度参数随着压力的增高与乙二醇二甲醚含量的增加而升高,但在高压、高增溶剂含量区域,CO2的溶解度参数升高不明显。计算结果与实验结果相符合。分析CO2-乙二醇二甲醚的径向分布函数发现,在低温、低压、低增溶剂含量条件下,乙二醇二甲醚与CO2分子间存在明显的吸引作用,可以揭示乙二醇二甲醚作为增溶剂提高二氧化碳在稠油中溶解度的微观机理。乙二醇二甲醚分子含有两个醚基,其与CO2氧原子间存在强烈吸引力作用,说明醚基是有效的亲CO2基团。这为增溶剂的研发提供了理论指导:富含醚基的有机小分子可能是潜在的CO2增溶剂。

