模拟冷链流通中温度波动对养殖金鲳鱼鱼肉品质及微生物多样性的影响
司徒慧媛, 李玉梅, 高加龙,2,*, 章超桦,2, 秦小明,2,曹文红,2, 林海生,2, 郑惠娜,2
(1.广东海洋大学 食品科技学院/广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/水产品深加工广东普通高等学校重点实验室, 广东 湛江 524088;2.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心, 辽宁 大连 116034)
金鲳鱼学名为卵形鲳鲹(Trachinotusovatus),硬骨鱼纲鲈形目鲹科鲳鲹属[1],产地主要为广东、广西和浙江等省,是我国三大海水养殖经济鱼类之一。《中国渔业统计年鉴》数据显示,2020年我国金鲳鱼养殖产量约10.2万t,占全国海水养殖鱼类总产量的5.8%[2]。金鲳鱼肉质细腻,滋味鲜美,具有较好的食用价值和营养价值。保持流通过程中金鲳鱼渔获后的鲜度和品质对其内陆城市消费市场的开发十分关键[3];因此,需要在运输过程中使用冷链运输体系,并维持整个冷链流通过程中温度的稳定[4]。水产品表面附着大量微生物并含有较多内源酶,容易导致鲜度品质劣化甚至腐败变质。因此研究运输和销售过程的温度控制以及冷链物流过程中鱼体的品质变化和微生物群落演替规律对水产品的保鲜加工具有重要的意义。
流通中温度频繁波动易导致鱼品质劣变速度加快。黄文博等[5]研究发现,冷藏物流中的温度频繁波动导致美国红鱼(Sciaenopsocellatus)的菌落总数、pH值、挥发性盐基氮(TVB- N)值、K值等指标的显著变化;蓝蔚青等[6]证明流通期间剧烈的温度波动对大目金枪鱼(Thunnusobesus)品质造成明显影响;于淑池等[7]研究了0 ℃下贮藏金鲳鱼的菌落总数、TVB- N值和特定腐败菌。但流通过程中温度波动对金鲳鱼品质和微生物的影响鲜有报道。目前在食品微生物多样性及变化规律分析中广泛应用高通量测序技术,具有测序通量大,能全面且精确测量样品中的微生物类型及其真实比例等优点[8]。已有学者将该技术运用在大西洋鳕鱼(Gadusmorhua)[9]、南美白对虾(Litopenaeusvannamei)[10]等水产品的微生物群落组成分析中。
本研究模拟了金鲳鱼渔获至消费环节的整个流通过程,分析了温度波动下鲜度指标的变化,并通过传统培养、Illumina Miseq测序平台与PICRUSt功能预测工具研究微生物群落结构组成和代谢功能的差异,探究金鲳鱼冷链流通过程中温度波动对鱼肉品质和微生物多样性的影响,以期为金鲳鱼保鲜技术和冷链物流的建设提供参考依据。

图1 模拟金鲳鱼的冷链流通过程Fig.1 Process of simulated cold chain circulation of Trachinotus oratus
1 材料与方法
1.1 材料与试剂
鲜活养殖金鲳鱼,湛江市霞山区水产品批发市场,质量为(720.00±37.42) g,体长为(33.00±1.22) cm,样品捕捞后加冰1 h内运至实验室;2-硫代巴比妥酸,分析纯,国药集团化学试剂有限公司;ATP关联物标准品,美国Sigma公司;平板计数琼脂培养基,北京陆桥技术股份有限公司;Qubit3.0 DNA检测试剂盒,美国Life公司;细菌基因组DNA提取试剂盒(E.Z.N.A.Soil DNA Kit),美国Omega公司。
1.2 仪器与设备
FE28型pH计,梅特勒- 托利多仪器(上海)有限公司;Thermo Varioskan Flash型全波长多功能酶标仪,美国赛默飞世尔科技公司;Vapodest- 450型全自动凯氏定氮仪,德国格哈特分析仪器有限公司;Waters e2695型高效液相色谱仪,美国Waters公司;Miseq型高通量测序仪,美国Illumina公司。
1.3 实验方法
1.3.1冷链流通模拟实验设计
GB/T 28577—2021《冷链物流分类与基本要求》[11]和《水产食品学》[12]中规定:水产品渔获后需放入加冰的泡沫箱中保温,送往原料处理场的过程中所处温度为0~2 ℃,到达原料处理场后经冷藏车运输[(2.0±0.5) ℃],超市冷藏陈列柜销售[(2.0±0.5) ℃],最后到达家庭冰箱(4 ℃)。依此设计了金鲳鱼冷链物流过程。金鲳鱼渔获后经过处理待运,稳定处于2 ℃(0~24 h)后分别经过理想冷链过程与断链过程。CL组为理想冷链过程:运输及销售温度稳定处于2 ℃,家庭暂存稳定处于4 ℃;BC组为断链过程:运输、销售和家庭运输过程中设置多个温度变化,分别为2、4、10、25 ℃,以模拟流通过程中存在的温度变化[11]。
具体流通过程如图1,将鱼肉分别置于对应温度装置下贮藏0、24、48、96、120 h后进行高通量测序分析以及相关指标的测定。模拟冷链流通过程总共8个取样点,即贮藏待运组(SS- 0、SS- 24),冷链组(CL- 48、CL- 96、CL- 120),断链组(BC- 48、BC- 96、BC- 120)。
1.3.2样品处理
将新鲜的金鲳鱼宰杀后取背部肌肉,经蒸馏水淋洗,使用无菌纱布擦拭样品表面水分后分装入封口袋(约100 g/袋),分别放在不同的模拟流通环境中贮藏。不同时间取样进行高通量分析和菌落总数、嗜冷菌数、pH值、TVB- N值、硫代巴比妥酸(TBA)值、K值等指标的测定,每组至少3个重复。
1.3.3鲜度品质指标测定
1.3.3.1 微生物指标测定
菌落总数、嗜冷菌数测定参考GB 4789.2—2016《食品微生物学检验 菌落总数测定》[13]。选择合适稀释度,平行测定3次,并设定空白对照。菌落总数需在(30±1) ℃下培养(72±3) h,嗜冷菌需在(7±1) ℃下培养(240±3) h。
1.3.3.2 pH值测定
称取绞碎、混合均匀的2.00 g鱼肉于离心管中,再加入20 mL蒸馏水混合均匀后静置30 min,以8 000 r/min离心10 min后,取上清液测定pH值[14]。
1.3.3.3 TVB- N值测定
参考GB 5009.228—2016《食品中挥发性盐基氮的测定》[15]中的半微量凯氏定氮法,采用全自动凯氏定氮仪进行检测,结果以mg/100g表示。
1.3.3.4 TBA值测定
参考GB 5009.181—2016《食品中丙二醛的测定》[16]进行测定。
1.3.3.5 K值测定
参考SC/T 3048—2014《鱼类鲜度指标K值的测定高效液相色谱法》[17]提取样品中的ATP关联物后使用高相液相色谱仪进行检测。HPLC条件:5C18- MS- II型色谱柱(4.60 mm×250 mm,5 μm),检测波长为 254 nm,柱温为35 ℃,进样量20 μL;流动相为0.02 mol/L磷酸二氢钾与0.02 mol/L磷酸氢二钾溶液体积比1∶1,使用磷酸调节pH值至6.0,流速为1.0 mL/min。等度洗脱程序:0~35 min,外标法定量。按式(1)计算K值。

(1)
1.3.4高通量测序
1.3.4.1 总DNA提取与PCR的扩增
使用液氮将鱼肉磨成粉末状,采用DNA提取试剂盒提取样品DNA,使用Qubit3.0 DNA检测试剂盒对提取的基因组DNA精确定量。PCR扩增所需引物采用V3- V4区通用引物,为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)。PCR扩增完成后通过质量分数2%琼脂糖凝胶电泳检测扩增效果。
1.3.4.2 PCR产物纯化回收与测序
通过AMPure XP磁珠纯化扩增产物,对每个PCR扩增产物的DNA含量进行荧光检测,通过生物芯片分析测定系统进行文库测序片段范围和浓度的分析检测,然后由生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。
1.3.4.3 高通量测序数据处理及分析
将测序后得到的原始序列按照overlap关系进行拼接,然后再按照原始序列质量进行质控和过滤,舍弃一些较低质量的DNA序列,再聚类成操作分类单元(operational taxonomic units,OTU)。根据聚类分析实验结果,针对OTU进行多样性指数综合分析以及对不同组别测序深度的测定,并采用单样品的多样性指数分析方法(Alpha多样性)研究样品中微生物的多样性。基于分类学信息,统计分析不同分类水平的生物种群结构,在此基础上进行功能预测[18]。
1.4 数据处理
运用Microsoft Excel、Prism 9.3、SPSS Statistics 20.0进行整理分析与绘图,运用Tukey- HSD进行显著性分析与多重比较(P<0.05为差异显著),同时针对鲜度指标与微生物指标进行Pearson相关性分析,结果采用平均值±标准偏差表示。
2 结果与分析
2.1 冷链流通期间金鲳鱼鱼肉品质变化分析
2.1.1菌落总数与嗜冷菌的变化
微生物的活动是导致水产品腐败的主要因素之一,菌落总数被广泛应用于判断水产品鲜度。一般认为菌落总数小于104CFU/g为一级鲜度,104~106CFU/g为二级鲜度,菌落总数大于106CFU/g表明鱼体已发生腐败[18],而流通过程中的低温环境则为嗜冷菌提供了有利的生长条件。
模拟流通过程中金鲳鱼样品菌落总数与嗜冷菌的变化如图2。在贮藏前期样品初始菌落总数与初始嗜冷菌数量均差异不明显(P>0.05),初始的样品菌落总数为(2.81±0.03) lg CFU/g。在贮藏后期,CL组由于环境温度稳定,在流通期间菌落总数与嗜冷菌数增长缓慢。而BC组经历温度变化后,贮藏96 h后BC组样品的菌落总数与嗜冷菌数均显著高于CL组(P<0.05);120 h后BC组的菌落总数达(6.63±0.03) lg CFU/g,已超出限量指标。在整个流通过程中嗜冷菌数与菌落总数的变化趋势基本一致,其增长速率始终高于菌落总数,这说明温度波动营造了更适合嗜冷菌的生长环境,加速了微生物的生长繁殖最终导致鱼肉腐败。

不同小写字母表示组间差异显著(P<0.05)。图2 模拟冷链流通过程中金鲳鱼菌落总数与嗜冷菌数 的变化Fig.2 Changes of total colony count and psychrophilic bacteria in Trachinotus ovatus during simulated cold chain circulation
2.1.2pH值的变化
模拟冷链流通过程中金鲳鱼鱼肉pH值的变化见图3。新鲜金鲳鱼鱼肉的初始pH值为6.61±0.01,贮藏前期pH值下降,而后在理想冷链过程与断链过程中呈上升的趋势。在贮藏初期(0~24 h),肌肉组织中由糖酵解反应而产生大量乳酸使pH值呈下降趋势。随后自溶阶段,样品pH值逐渐上升,归因于鱼肉中的蛋白质与部分含氮物质被分解,生成氨基酸、氨、三甲胺等碱性物质[5]。BC组pH值上升趋势大于CL组,且在48 h时的pH值显著高于CL组(P<0.05),说明温度波动促进了蛋白质和部分含氮物质的分解。

不同小写字母表示组间差异显著(P<0.05)。图3 模拟冷链流通过程中金鲳鱼pH值的变化Fig.3 Changes of pH value of Trachinotus ovatus during simulated cold chain circulation
2.1.3TVB-N值的变化
内源酶和微生物的作用,可使水产品中的蛋白质和非蛋白质含氮化合物降解并形成挥发性的盐基氮,因此TVB- N值常作为判断水产品腐败程度的重要化学指标之一[19]。SC/T 3103—2010《鲜冻鲳鱼》中规定鱼肉的TVB- N值小于18 mg/100g为一级品,大于30 mg/100g为不合格品[20]。模拟冷链流通过程中金鲳鱼鱼肉TVB- N值的变化见图4。样品TVB- N值随着流通时间延长呈上升趋势,在贮藏初期(0~24 h),SS组的TVB- N值上升缓慢(P>0.05);在贮藏后期(96~120 h),BC组样品的TVB- N值显著升高,均高于同一流通时间节点的CL组样品(P<0.05)。在流通120 h后BC组样品TVB- N值已由鲜鱼初始的(7.95±0.49) mg/100g上升至(20.57±0.98) mg/100g,超过了一级品的标准范围,而CL组仍属于一级鲜度。可见,温度波动与TVB- N值的持续上升密切相关,这与徐晓蓉等[21]的马鲛鱼冷链流通过程中品质变化研究结果相似。此外,样品TVB- N值上升趋势与菌落总数变化趋势一致,说明微生物生长繁殖可能加快了鱼肉中蛋白质氧化分解和胺类化合物的产生,造成鱼肉品质下降。

不同小写字母表示组间差异显著(P<0.05)。图4 模拟冷链流通过程中金鲳鱼TVB- N值的变化Fig.4 Changes of TVB- N value of Trachinotus ovatus during simulated cold chain circulation
2.1.4K值的变化
K值能反映鱼体死后ATP降解反应进行的程度,是衡量鱼类新鲜度的重要指标。一般认为即杀的鱼K值在10%以下,在20%以下为一级品,20%~40%为二级鲜度,60%~80%为初期腐败鱼[21]。模拟冷链流通过程中金鲳鱼鱼肉K值的变化见图5。本研究中新鲜金鲳鱼肉的K值为(10.85±0.19)%,随着时间的延长流通期间K值呈上升趋势;且每个流通时间节点BC组的K值均显著高于CL组(P<0.05),流通120 h后BC组样品的K值已达到(61.05±1.32)%,成为初期腐败鱼。结果表明:温度的频繁波动提高了ATP的降解速度并造成K值的增长速率加快[19],对金鲳鱼的鲜度造成了显著影响。

不同小写字母表示组间差异显著(P<0.05)。图5 模拟冷链流通过程中金鲳鱼K值的变化Fig.5 Changes of K value of Trachinotus ovatus during simulated cold chain circulation
2.1.5TBA值的变化
TBA值一般用来反映水产品中脂肪氧化的程度,TBA值越高代表样品脂肪氧化程度越大,标志着鱼肉品质劣变速度越快[22]。模拟冷链流通过程中金鲳鱼鱼肉TBA值的变化见图6。在流通过程中各组样品TBA值总体均呈上升趋势,CL组的上升速率较BC组缓慢,流通120 h后BC- 120组样品的TBA值已由流通前(0.02±0.01) mg/kg上升至(0.38±0.02) mg/kg,且显著高于CL- 120组(P<0.05),其原因可能是温度波动导致鱼肉中肌细胞结构受损和肌纤维完整性降低,加快鱼肉中脂肪的氧化速率。
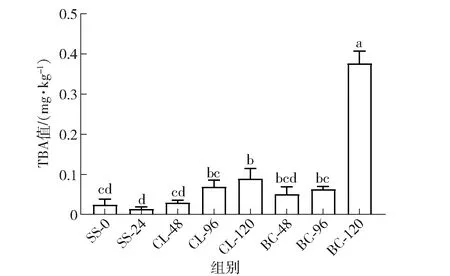
不同小写字母表示组间差异显著(P<0.05)。图6 模拟冷链流通过程中金鲳鱼TBA值的变化Fig.6 Changes of TBA value of Trachinotus ovatus during simulated cold chain circulation
2.2 金鲳鱼各品质指标相关性分析
CL组和BC组的金鲳鱼各品质指标的Pearson相关系数分析见表1。BC组中TBA值与K值呈不显著正相关(P>0.05)。其余微生物指标和鲜度指标均呈显著正相关(P<0.05),说明微生物代谢产物的积累会引起金鲳鱼的品质变化,而贮藏时间和温度波动会影响微生物的增长速率,从而影响劣变速度。因此这些指标均可作为金鲳鱼流通期间的鲜度综合评定指标。

表1 模拟冷链流通期间金鲳鱼品质指标相关性分析
2.3 模拟冷链流通过程中金鲳鱼微生物演替变化
2.3.1微生物群落多样性与结构差异分析
经高通量测序平台获得原始序列后,对各样本数据进行质控过滤得到有效数据,然后进行统计分析优化,结果见表2。各时期样品原始序列数范围为68 004~87 483条,样品优化有效序列范围为63 174~80 204条,平均长度范围为408.4~416.9 bp,本次测序每个样品的有效序列百分比均达50%以上,已满足了微生物多样性分析的要求[9]。由表2可知,样品测序覆盖率均大于0.99,可用于细菌多样性分析,相对于SS组而言,CL组和BC组中ACE、Chao、Shannon指数普遍降低,而Simpson指数普遍升高,表明低温对部分微生物的生长产生抑制作用,更适于耐冷优势菌生长。与其他样品相比,BC- 48组的微生物多样性和丰富度下降明显,各菌种分布均匀度增加,可能是因为断链流通48 h后金鲳鱼已开始腐败变质,营养环境发生了改变,导致优势腐败菌占据优势,从而抑制了其他细菌的繁殖生长,并形成了新的群落结构[23]。而样品BC- 120组的微生物多样性和丰富度上升,可能是由于代谢产物的累积导致微生物群落结构发生了转变[24]。另外CL组中各个时间点的ACE、Chao、Shannon指数均高于BC组(除CL- 120组的ACE指数外),而Simpson指数正好相反,表明CL组样品中的微生物多样性比BC组更加丰富。结果表明:温度波动导致细菌群落的丰富性和多样性减少,使CL组与BC组样品间细菌菌群结构差异明显。这与肖蕾[25]对大目金枪鱼的研究结果相似,证明水产品中的微生物多样性变化受温度波动的影响明显。

表2 模拟冷链流通过程中金鲳鱼样品序列信息和Alpha多样性指数
2.3.2微生物群落结构组成分析
经RDP classifier软件对样品序列物种注释,本研究在门、属分类学水平具体分析了冷链流通期间鱼肉的微生物群落结构组成。模拟冷链流通期间鱼肉的微生物菌相主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)组成,除这些主要菌门外,还存在一些丰度较低的放线菌门(Actinobacteria)、浮杆菌门(Planctomycetes)、酸杆菌门(Acidobacteria)等,选取丰度前10的菌种绘制成门水平的菌落结构分布图[图8(a)]。在门水平上,SS组(SS- 0、SS- 24)中拟杆菌门由31.01%快速下降至10.36%,后续波动较小并保持在一定范围内,说明拟杆菌门不是样品腐败的主要原因。而SS- 24组与CL组(CL- 48、CL- 96)比较发现,它们的菌相组成相似,表明在冷链过程中温度维持在2 ℃左右时细菌的种类与相对丰度变化较小;而与BC组(BC- 48、BC- 96)相比,BC- 48组的变形菌门迅速增至74.52%,BC- 96组的优势菌除了变形菌门(57.01%)还有厚壁菌门(30.43%)。当后期流通温度变为4 ℃(到达家庭冰箱)时,菌相再次发生变化,变形菌门和绿弯菌门成为主要优势菌,但CL组与BC组存在数量差异。结果表明:环境温度与菌相组成相关,变形菌门在金鲳鱼腐败过程中发挥着重要作用。

图8 模拟冷链流通过程中金鲳鱼的微生物群落结构差异Fig.8 Differences of microbial community structure of Trachinotus ovatus during simulated cold chain circulation
模拟冷链流通期间鱼肉的微生物菌相在属水平主要包括苯基杆菌属(Phenylobacterium)、八叠球菌属(Sporosarcina)、乳杆菌属(Lactobacillus)、长绳菌属(Longilinea)、普雷沃菌属(Prevotella),除这些主要菌属外,还存在鞘氨醇单胞菌属(Sphingomonas)、大豆根瘤菌属(Bradyrhizobium)、伯克霍尔德菌属(Burkholderia)等,选取丰度前10的菌种绘制成属水平的菌落结构分类图[图8(b)]。在属水平上,各样品在冷链流通期间微生物多样性与丰度存在区别。新鲜金鲳鱼样品以苯基杆菌属、普雷沃菌属、鞘氨醇单胞菌属和乳杆菌属为主;随着贮藏时间的延长部分微生物的繁殖呈现不同变化趋势,在冷藏中后期CL组主要以苯基杆菌属、鞘氨醇单胞菌属、长绳菌属、unclassified_Anaerolineaceae为主;而由于温度波动导致BC组与CL组存在一定区别,BC组主要以苯基杆菌属、八叠球菌属、长绳菌属和unclassified_Anaerolineaceae为主。属水平分析结果与门水平一致,特别是属水平的结果证明温度波动使细菌种类与菌数发生变化。
在整个冷链流通过程中苯基杆菌属(Phenylobacterium)始终占据优势,相对丰度为16.07%~83.51%。在冷藏中期BC- 48组中相对丰度达到最大值83.51%,CL- 48组中占74.54%,冷藏后期虽有一定程度下降,但BC组的占比仍高于CL组,说明冷链流通过程中的温度波动提高了该菌属的增长速率。苯基杆菌属是被Lingens等[26]在1985年首次鉴定出,近年来该菌属的相关新菌种于湖水[27]、农药制造厂的污泥[28]等生境中不断被分离出,支持了苯基杆菌属在自然界分布广泛、生命力顽强的观点,但鲜见有报道其在水产品腐败中的作用,具体腐败作用有待进一步研究。
在新鲜鱼肉样品(SS- 0)中普雷沃菌属(Prevotella)、乳杆菌属(Lactobacillus)和鞘氨醇单胞菌属(Sphingomonas)占比最高,相对丰度比例分别为45.20%、13.30%和12.27%。普雷沃菌属、乳杆菌属在冷藏120 h后相对丰度均小于1%,说明普雷沃菌属、乳杆菌属并非金鲳鱼冷链流通过程中的优势菌。而鞘氨醇单胞菌属广泛存在于各种水体中,是海洋中的优势菌群,具有极强生命力并可以适应不断变化的环境[29]。刚捕捞的金鲳鱼鱼体表面会带有这类菌群,低温在一定程度上可抑制其生长,但经过没有温度波动的理想冷链过程(0~96 h)后,CL- 96组鞘氨醇单胞菌属相对丰度可达到34.46%,成为CL组流通中期的次要优势菌。相反在BC- 96组中八叠球菌属(Sporosarcina)占比较高(30.75%),成为BC组流通中期的次要优势菌。已有相关研究证明:八叠球菌属是与食源性病原体蜡状芽孢杆菌有密切关系的菌株,Tsuda等[30]从阿拉斯加鳕鱼、梭子鱼和白花鱼的鱼糜中分离出了八叠球菌属,并发现其在10 ℃下的生长能力比28 ℃下更强。
随着流通时间的延长,长绳菌属在CL- 120、BC- 120组相对丰度分别升至20.20%和26.86%,unclassified_Anaerolineaceae相对丰度占比大于10%,已知其为厌氧绳菌纲(Anaerolineae),在流通末期的相对丰度分别升至37.66%和45.43%,与长绳菌属变化规律一致,但未能鉴定到具体菌属,因此有待进一步研究。长绳菌属和unclassified_Anaerolineaceae两者均为绿弯菌门(Chloroflexi),可从河口、海水、海底沉积物、污染河流和活性淤泥中鉴定出[31],因此可认为长绳菌属和unclassified_Anaerolineaceae为流通末期的次要优势菌。
本研究检测到冷链流通前期SS组的优势菌群是苯基杆菌属,由于温度波动的存在导致贮藏后期流通过程主要优势属种有所不同,CL组的优势菌群是苯基杆菌属、鞘氨醇单胞菌属和长绳菌属,BC组的优势菌群是苯基杆菌属、八叠球菌属和长绳菌属。同时结果表明:部分优势微生物对冷鲜金鲳鱼品质变化有着至关重要的影响。但这与于淑池等[24]通过传统选择性培养结合16S rDNA序列分析腐败希瓦氏菌(Shewanellaputrefaciens)是冷藏卵形鲳鲹的优势腐败菌的研究结果不一致,其原因一方面可能是物种栖息地不同导致初始菌相不同,另一方面可能是由于高通量测序技术较传统分离检验技术更为快捷全面,能够直接对待测样本中全部基因组序列进行检测,从而能够检查出以前无法培养的比较新型的腐败菌。
2.4 细菌群落功能预测分析
在不同贮藏时间菌群的多样性和分布特征分析的基础上,利用细菌群落功能预测工具PICRUSt对金鲳鱼细菌群落分布进行了功能特征预测。依据KEGG(kyoto encyclopedia of genes and genomes)数据库进行分析对比,新陈代谢通路是各类微生物获得营养后进行个体生长发育繁殖的主要代谢作用途径,同时也是直接影响各类食品品质和风味的主要代谢途径[32]。与新陈代谢相关的通路主要是各种碳水化合物代谢、氨基酸代谢、能量代谢、脂质代谢、核苷酸代谢、辅酶因子及各种维生素代谢等,其中碳水化合物代谢、氨基酸代谢、脂质代谢这三大新陈代谢与腐败氧化有着较为紧密的联系,图9是与三大新陈代谢作用相关的基因的相对丰度分布特征分析。
在代谢功能基因聚类上,根据不同的贮藏时间和环境温度波动这2个因素,金鲳鱼样品细菌代谢相关基因可聚成4类。随着鱼肉贮藏时间的延长,由于细菌的形成而产生大量代谢产物,代谢基因相对丰度总体呈先上升后下降趋势。鱼肉经过24 h冷藏后,温度波动导致冷藏中期的代谢相关基因存在差别,但整体上在BC- 48、BC- 96组中代谢相关基因相对丰度持续上升,而CL- 48、CL- 96组中的代谢相关基因相对丰度则随之降低;而在冷藏后期代谢相关通路发生转变,但代谢相关基因丰度随之降低,而BC- 120组代谢相关基因丰度高于CL- 120组,这可能是由于在冷藏后期细菌多样性下降,群落结构趋于简单,导致代谢相关菌减少而引起相关基因相对丰度的降低,这与张梦思等[33]发现日本鲭与黄鱼在冷藏中后期代谢相关基因相对丰度降低的研究结果相似。

图9 模拟冷链流通过程中金鲳鱼碳水化合物、脂类、氨基酸代谢分类功能预测Fig.9 Prediction of carbohydrate, lipid, and amino acid metabolism classification function during simulated cold chain circulation of Trachinotus ovatus
在整个贮藏过程中,氨基酸代谢在基因通路丰度上占据明显优势,以色氨酸、苯丙氨酸代谢以及赖氨酸、亮氨酸和异亮氨酸降解为主;在碳水化合物代谢基因通路中,主要以丙酸代谢和丁酸代谢为主;而脂质代谢通路中主要以脂肪酸降解为主。BC组的各个代谢相关基因丰度都超过了CL组,因此BC组较CL组的腐败速度快,说明由于温度波动而使得BC组中能够进行蛋白质、碳水化合物、脂类等物质新陈代谢的微生物数量比CL组更为丰富,在相关微生物的作用下产生的醛、酮和酸等物质使鱼体产生强烈腥臭味并引起品质降低。
3 结 论
本研究分析了金鲳鱼在冷链与断链流通中品质变化的相关性及其微生物群落演替规律。随着流通时间的延长,BC组样品的品质显著下降(P<0.05),证明温度波动的存在与各指标的变化密切相关,Pearson相关系数分析表明,菌落总数、嗜冷菌数、TVB- N值、pH值、K值均呈极显著(P<0.01)相关性,可作为评判金鲳鱼品质变化情况的有效指标。同时基于高通量分析金鲳鱼微生物群落变化规律,发现了细菌群落的丰富性和多样性会随贮藏时间的延长而降低,菌相分析判断苯基杆菌属是金鲳鱼整个冷链流通期间的主要优势菌,其中CL组的次要优势菌是鞘氨醇单胞菌属、长绳菌属和unclassified_Anaerolineaceae;BC组的次要腐败菌是八叠球菌属、长绳菌属和unclassified_Anaerolineaceae。通过细菌群落功能预测,从代谢水平上进一步解释了温度波动导致BC组中微生物新陈代谢的增强,引起更快速地腐败现象。本研究表明:冷鲜水产品的腐败速率不但与优势微生物相关,还和运输方式有着十分重要的关系,为了达到抑制微生物生长繁殖的目的,需全面调控冷链流通期间的各影响因素以保证商品质量,研究旨在为水产品运输消费过程中的储藏保鲜提供理论依据。

