4种自粘接树脂水门汀对牙周膜成纤维细胞增殖的影响
罗岚, 卢巧乔, 陈成新, 郑馨回, 刘世震, 赵伟,3
自粘接树脂水门汀(self-adhesive cement)由于其良好的粘接性能、简便的操作及较低的牙本质术后敏感,在临床上多用于各种修复体的粘接。若粘接剂残留,游离单体等成分在粘接剂固化后可能会有不同程度析出,从而对牙周组织产生影响。此外,冠粘接后的树脂水门汀残留可能是导致冠边缘或种植体周缘牙槽骨吸收、牙龈退缩等的原因[1]。人牙周膜成纤维细胞(human periodontal ligament fibroblasts, HPDLFs)具有多向分化能力,在外界刺激状态下,参与牙周膜、牙骨质和牙槽骨重塑,是牙周组织愈合和再生的重要基础[2]。粘接剂的残留及析出物与牙周组织密切接触,HPDLFs的状态与牙周健康息息相关。为比较不同自粘接树脂水门汀对牙周组织的影响,本研究比较临床上常用的4种自粘接树脂水门汀(RelyX Unicem、SAC、Duo-Link和PermaCem)的浸提液对HPDLFs增殖的影响,以期为临床上选择理想的粘接材料以及使用方法提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 牙齿 选取2017—2018年因正畸需要拔除的无龋病、无牙周病的前磨牙15颗,男性8颗,女性7颗,患者年龄10~20岁。本研究经医院伦理委员会同意,受试者均知情同意。
1.1.2 主要试剂和仪器 RelyX Unicem自粘接树脂水门汀(ESPE,美国3M公司);SAC可乐丽菲露复合树脂粘接剂(日本可乐丽医疗器材株式会社);Duo-Link树脂水门汀(美国BISCO公司);PermaCem 2.0自粘接树脂水门汀(德国DMG公司);DMEM低糖培养液(美国Hyclone公司);优级南美胎牛血清(加拿大Wisent公司);胰酶(美国Gibco公司);Ⅰ型胶原酶(美国Sigma公司);磷酸盐缓冲液(phosphate buffer saline, PBS)粉剂(北京兰杰柯科技有限公司);青霉素-链霉素混合液(上海碧云天生物技术研究所)。CCK-8细胞计数试剂盒(CK04,日本同仁化学研究所);CO2细胞恒温培养箱(3111,美国Thermo公司);荧光相差显微镜及照相系统(DMIL/DFC295,德国莱卡公司);生物安全超净台(上海力申科学仪器有限公司);酶联免疫检测仪(ELX808,美国Bio-Tek公司);自动细胞计数仪(美国Countstar公司);LED 光固化灯(EliparTMS10,美国3M公司)。其他普通试剂和常用仪器由福建省高校口腔医学重点实验室提供。
1.2 方法
1.2.1 试件制备 利用聚甲基丙烯酸甲酯模具制作硅橡胶方块(20 mm×8 mm×10 mm),共16个,每个方块里有3个高8.0 mm、内径4.0 mm的圆柱体凹槽,将Unicem、SAC、Duo-Link和PermaCem等4种粘接剂按说明书混合调拌,缓慢注入硅橡胶凹槽内,将硅橡胶置于固定框架内,盖上聚甲基丙烯酸甲酯盖板,用光固化灯(400~490 nm)沿各个方向分别照射粘接剂40 s,待粘接剂固化后,用无菌镊子取出试件,经紫外线照射消毒90 min后备用。
1.2.2 浸提液制备 按照DMEM完全培养液体积与试件表面积之比为1.885 mL/cm2的标准[3]。将每个品牌的试件分成4组,每组含3个试件。将试件放入15 mL的离心管中,加入2 mL的DMEM完全培养液,置于37 ℃恒温箱中。分别于浸泡1、3、5 和7 d时取浸提液,用0.22 μm滤菌器过滤,得到无菌的树脂浸出液。
1.2.3 HPDLFs的原代培养与鉴定 采用酶消化组织块法[4],将牙齿移入装有无菌PBS的培养皿中,保持牙面湿润,用PBS冲洗牙齿3~4次,除去血污。用无菌刀片刮取根中1/3部位的牙周膜,直接移入1 mL含0.05% Ⅰ型胶原酶的PBS中,置于37 ℃、体积分数为0.05的CO2饱和湿度培养箱中孵育。每10 min振荡1次,共消化20 min,1 000 r/min 离心5 min,去除上清液。加入DMEM完全培养液1 mL,吹匀,接种于6孔板,继续添加DMEM至3 mL。待细胞长出后,每3天换液1次,待组织块中游出的细胞铺满孔底的80%时,胰酶消化传代。在显微镜下观察细胞,大部分细胞回缩变圆后,终止消化,换液后完成传代。为尽可能保持原始异质性并尽量减少克隆细胞,HPDLFs不应在后期传代(不超过7代)使用[5]。取3~5代的细胞用于实验。
取生长状态良好的第3代HPDLFs,0.25%胰酶消化后,制备细胞爬片。待细胞长至孔板的70%时,丙酮固定,常规免疫组织化学法进行波形丝蛋白、角蛋白单抗染色,光镜下观察。
1.2.4 CCK-8实验 取生长良好的第5代对数生长期的HPDLFs,用0.25%胰酶消化,调整细胞密度至1×105mL-1[6],接种于96孔培养板,每孔100 μL,常规培养24 h,吸去培养液和未贴壁细胞,每个板分别加入相同浸提时间的4种树脂浸提液100 μL,每种品牌重复5个孔,同时设置阴性对照组。标准环境下孵育48 h后,吸去树脂浸提液,用无血清DMEM培养液冲洗2次后,每孔内加入10 μL CCK-8溶液,继续培养4 h,酶联检测仪下测定光密度(optical density, OD)值,用倒置相差显微镜观察细胞的形态并拍照。计算各实验组细胞的相对增殖率(relative growth rate, RGR)。根据RGR[7]将细胞毒性分为0~5级,共6级。
RGR=[(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)]×100%
1.3 统计学处理 采用SPSS 22.0软件分析4种自粘接树脂水门汀浸提液培养HPDLFs的OD值,采用重复测量资料的方差分析,多重比较采用LSD法对数据进行分析。P<0.05为差别有统计学意义。
2 结 果
2.1 形态学观察 HPDLFs呈长梭形或星形,胞突细长,胞体较大,胞质均匀,核呈圆形或卵圆形,分布均匀(图1),约20 d长满。
图1 牙周膜成纤维细胞的形态学观察Fig.1 Morphological observation of periodontal ligament fibroblasts
2.2 免疫组织化学鉴定 波形丝蛋白经染色胞质呈现出棕黄色,呈阳性(图2A);角蛋白胞质无染色,呈阴性(图2B)。结果表明,实验所获得的细胞来源于中胚层,属于纤维细胞,且未出现上皮源性细胞污染情况。
2.3 各实验组OD值、细胞RGR和细胞毒性分级 各实验组OD值、细胞RGR见表1。4种自粘接树脂水门汀均是3 d浸提液的细胞RGR达到最低,随浸提时间延长,RGR增加(图3)。细胞毒性分级结果显示,4种自粘接树脂水门汀1 d浸提液的毒性分级均为0级;浸提3 d时,Unicem组毒性分级为3级,SAC组和Duo-Link组为2级,PermaCem组为1级;浸提5 d时,除了SAC组毒性分级为2级,其余3组对细胞均无毒性;浸提7 d时,4种树脂水门汀均无细毒性。结合细胞形态进行综合分析(图4),浸提3 d的Unicem组、SAC组和Duo-Link组以及浸提5 d的SAC组,各组细胞密度均匀,贴壁伸展,形态正常呈梭形或星形,浸提3 d的Unicem组和SAC组细胞密度略低于对照组。可见浸提3 d的Unicem组、SAC组和Duo-Link组以及浸提5 d的SAC组对HPDLFs的细胞毒性较小,对细胞增殖影响较小。
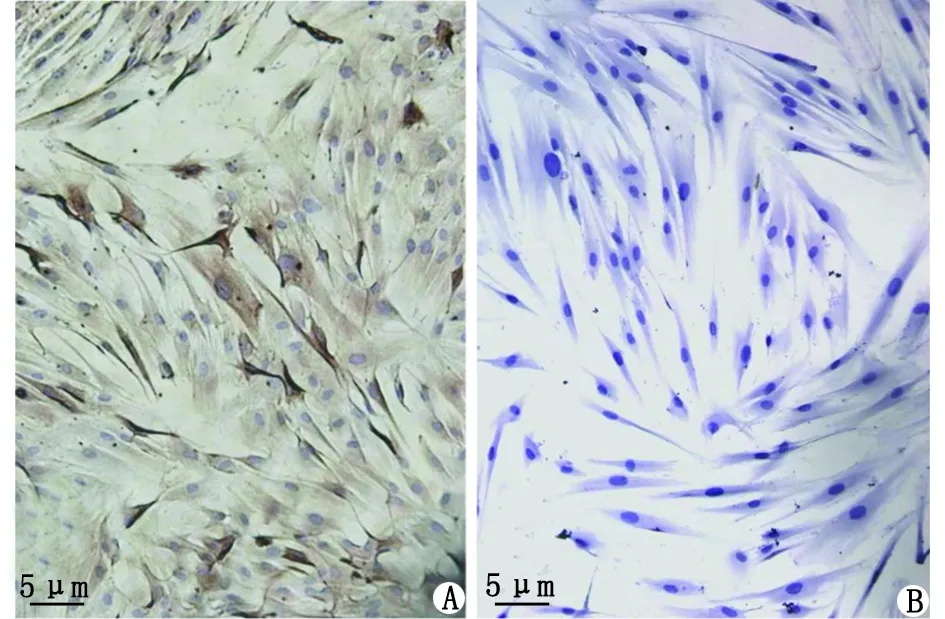
A:波形丝蛋白染色呈阳性;B:角蛋白染色呈阴性。图2 牙周膜成纤维细胞免疫组织化学结果Fig.2 Immunohistochemical results of HPDLFs
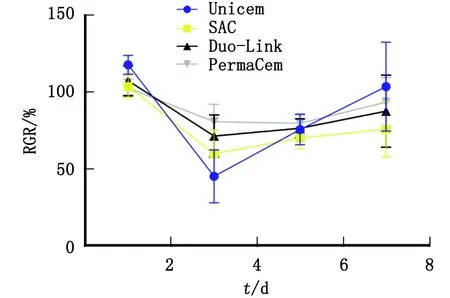
RGR:相对增殖率。图3 各实验组细胞RGR折线图Fig.3 Line chart of relative growth rate of cells in each experimental group
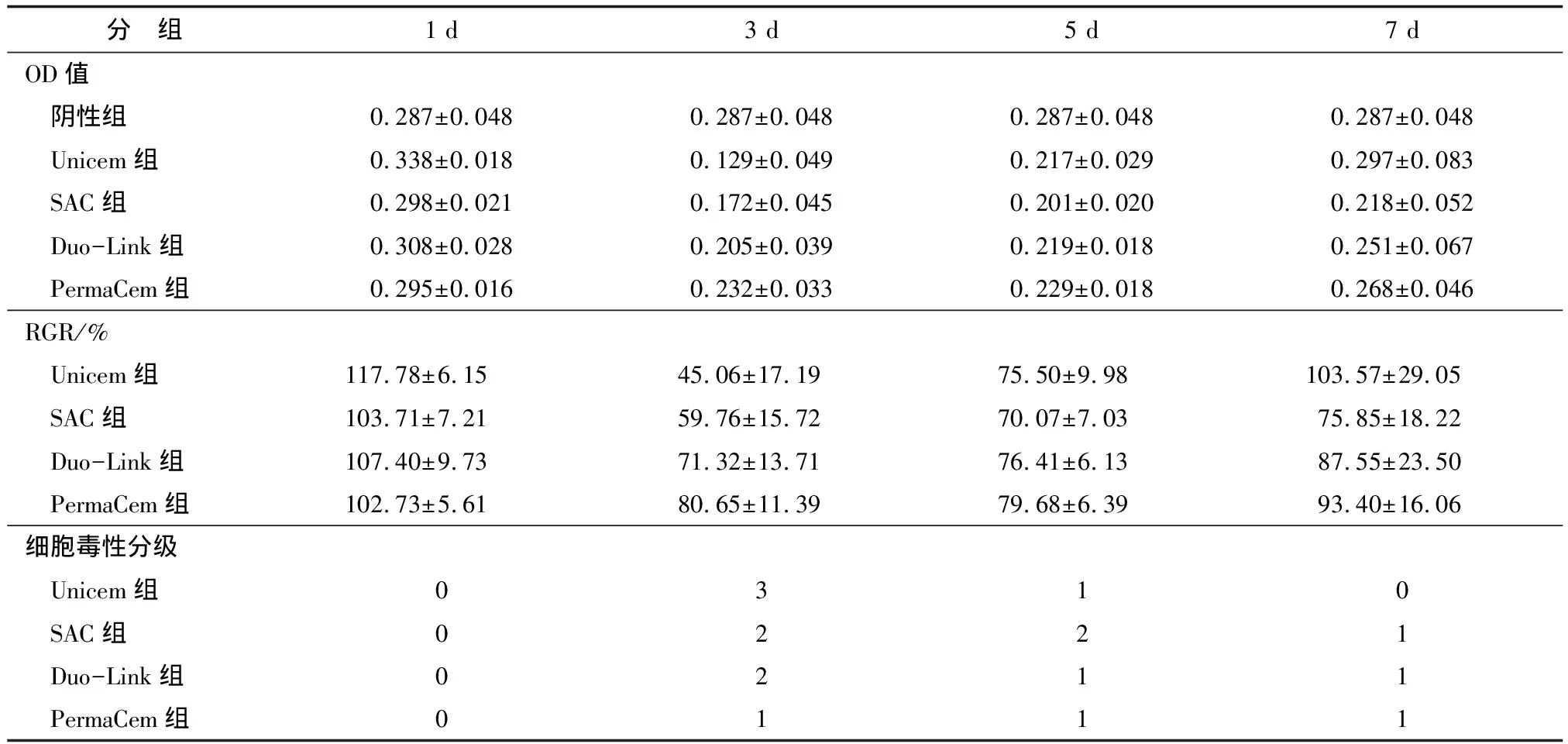
表1 各实验组及阴性组OD值、RGR和细胞毒性分级
2.4 同一时间不同浸提液对细胞增殖的影响 浸提1 d,Unicem组的细胞RGR最高,显著高于SAC组、PermaCem组和阴性对照组(P<0.05),其余各组组间比较差别均无统计学意义(图5A)。浸提3 d,Unicem组、SAC组和Duo-Link组的细胞RGR显著低于阴性对照组(P<0.05),其中Unicem组最低(图5B)。浸提5 d,所有实验组的细胞RGR均显著低于阴性对照组(P<0.05,图5C)。浸提7 d,各组间差别均无统计学意义(图5D)。
2.5 同一浸提液在不同时间下对细胞作用的影响 Unicem组3 d浸提液的RGR最低,显著低于1和7 d(P<0.05);5 d的RGR较低,显著低于1 d(P<0.05,图6A)。SAC组1 d浸提液的RGR最高,3、5、7 d均显著低于1 d(P<0.05),而3、5、7 d之间两两比较,差别均无统计学意义(P>0.05,图6B)。Duo-Link组浸提3和5 d的RGR均显著低于1 d(P<0.05,图6C)。PermaCem组浸提3和5 d的RGR均显著低于1 d (P<0.05,图6D)。
3 讨 论
临床上,即使再精密的修复体,如果粘接材料发生了体积收缩或溶解,冠边缘就会发生微渗漏,使得粘接剂暴露于口腔环境。AUGSTI等[8]发现,在体外对氧化锆进行清洁,无论使用何种类型粘接剂,在所有氧化锆的冠边缘,特别是在邻接区附近,仍然发现了粘接剂残留。而不同的树脂水门汀在固化以及口腔唾液的作用下,会有不同的成分(如游离单体及金属离子等)析出[9],从而对牙周组织产生影响。
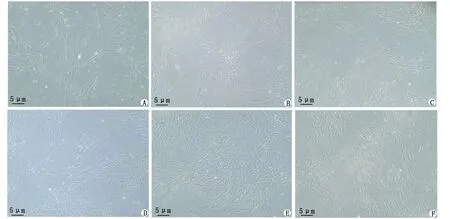
A:浸提3 d的Unicem组;B:浸提3 d的SAC组;C:浸提3 d的Duo-Link组;D:浸提5 d的SAC组;E:浸提7 d的Unicem组;F:浸提7 d的SAC组。图4 浸提3、5和7 d的实验组细胞形态学观察Fig.4 Morphological observation of cells in the experimental group after 3, 5 and 7 days of leaching
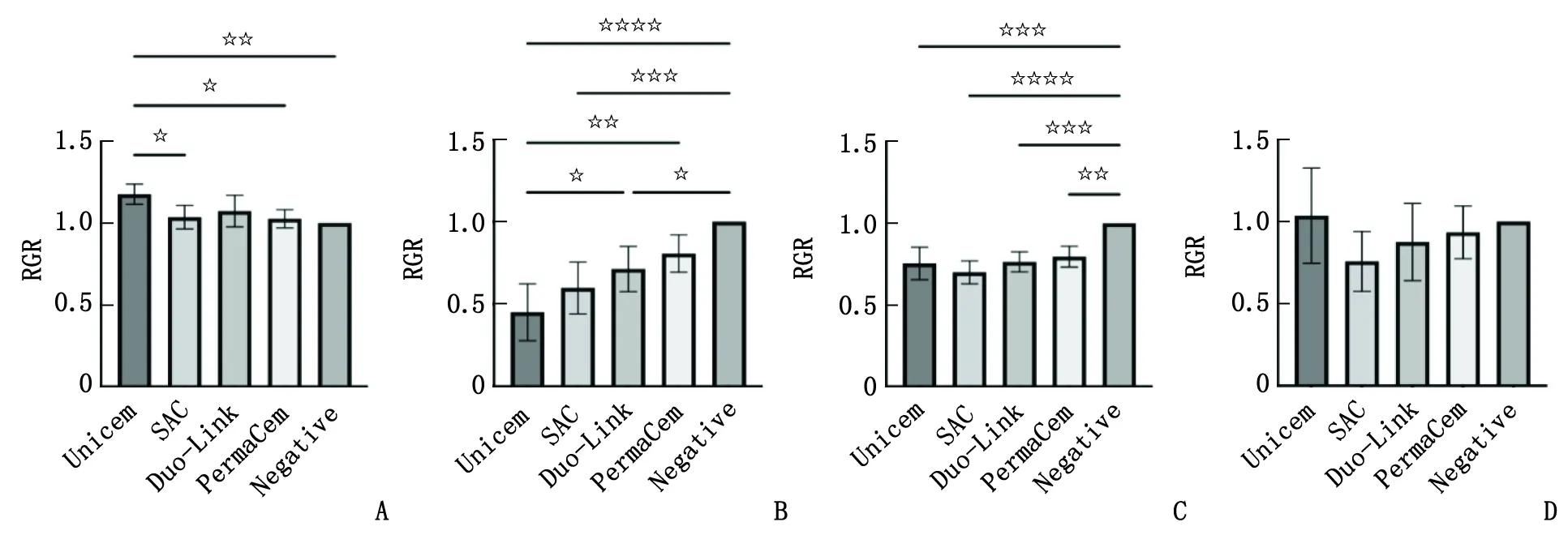
RGR:相对增殖率。A:1 d;B:3 d;C:5 d;D:7 d。图5 不同时间浸提液处理后各实验组和对照组的细胞RGR比较Fig.5 Comparison of RGR between the experimental groups and the control group after treatment with the extract at different times
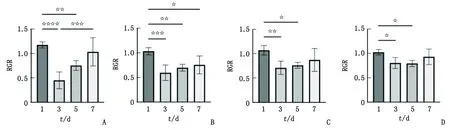
RGR:相对增殖率。A:Unicem;B:SAC;C:Duo-Link;D:PermaCem。图6 4种自粘接树脂水门汀浸提不同时间的细胞RGR比较Fig.6 Comparison of RGR of cells extracted with four kinds of self-adhesive resin cements at different times
细胞毒性试验为评估材料生物相容性的初步筛选试验,其中CCK-8法具有方便、灵敏、重复性高及细胞毒性小等优点。以往大多数细胞毒性的体外研究主要集中在对小鼠或人类牙髓细胞或牙龈成纤维细胞等的影响。然而,牙周组织相关细胞与粘接剂的接触更密切。因此,本研究选用的是HPDLFs,其在牙周膜中胶原的更新与重建及牙周组织的修复和再生中起重要作用[10],参与邻近牙槽骨和牙骨质的改建及修复再生[11]。尽管细胞系可能有助于在不同研究中建立更统一的结果,但使用原代培养物进行研究更接近临床实际情况。在早期传代中使用的原代HPDLFs细胞具有保持原始组织特征的表型和功能异质性的优势,能更好地模拟HPDLFs的情况[5]。
自粘接树脂水门汀因其将酸性成分和偶联剂混合一起,无需对牙面做任何特殊处理,也无需使用粘接剂,即可在牙体和修复体之间形成良好的化学粘接,临床操作简便,粘接强度稳定、美观,得到广大口腔临床医生的喜爱,临床应用广泛。自粘接树脂水门汀结合了光固化粘接剂和化学固化粘接剂的部分特点,双固化的优点是允许粘接剂在光照不能到达的深层区域进一步进行化学固化[12]。因此,本研究选用了4种临床上常见的自粘接树脂水门汀,并比较了它们对HPDLFs增殖的影响,以期为临床医生选择合适的粘接材料提供一定的思路。
树脂水门汀在细胞培养中表现出毒性反应,主要是由材料释放的单体引发。本实验结果表明,第1天 4种材料均无毒性,第3天出现细胞抑制,第7天无细胞毒性。KAWAHARA等[13]使用高效液相色谱法检测固化树脂的残留单体释放时间,发现超过50%的单体在3 h内从固化树脂中洗脱出来,残留单体逐渐浸出长达3 d,随后保持不变,邻苯二甲酸酯的释放在7 d后保持不变。自粘接树脂水门汀比传统树脂具有更高的吸水性和溶解性[14]。为了实现与空间的黏合,自粘接树脂水门汀含有高浓度的酸性单体,过高的酸度增加了这些单体的亲水性,增强了它们的浸出能力[15]。因此第1天4种自粘接树脂水门汀未出现对细胞的抑制,可能与在无隔离屏障下进行较为充分的光固化以及浸提液中释放的单体量较少有关。而第3天出现明显的细胞抑制,可能与单体释放3 d的毒性累积效应有关。
FRASHERI等[16]对自粘接树脂水门汀和常规树脂与牙周膜细胞直接共培养的细胞毒性比较发现,培养至第21天仍有较强的细胞毒性(Panavia >Smart Cem >RelyX Unicem> Variolink,P<0.000 1)。牙周膜细胞通常不会与修复体边缘直接接触,主要受龈沟液的间接影响。因此,本研究采用自粘接树脂水门汀的浸提液进行检测。NOCCA等[17]发现,在无隔离屏障的情况下,从固化的自粘接树脂水门汀中释放的单体量明显低于在有陶瓷或复合屏障的情况下释放的单体量。文献[13]的结果显示,Unicem、Multilink Speed自粘接树脂水门汀在第2天表现出最大的细胞毒性,常规树脂则表现为刺激后即刻的细胞毒性,且在第7天达到最低水平。OGUZ等[18]的研究得到了相似的结果,他们检测了两种传统的双聚合(RelyX ARC和VariolinkN)和两种自粘接(RelyX Unicem和Multilink Speed)样品水门汀的细胞毒性,在第7天达到最低水平,残留单体释放在7 d内完成[2]。本研究发现,浸泡7 d的4种自粘接树脂水门汀均无细胞毒性,且细胞贴壁生长,形态未见明显异常,结果与上述文献一致。
最近,一项有关牙龈成纤维细胞毒性的研究发现,固化类型不是细胞毒性的决定因素,更重要的是材料的组成[19]。笔者对4种水门汀的主要成分进行分析,发现Unicem组、SAC组和PermaCem组单体的主要成分中均含有双酚a-甲基丙烯酸缩水甘油酯(BisGMA),Duo-link组的主要单体为三甘醇二甲基丙烯酸酯(TEGDMA)。在主要单体中,尤其是BisGMA和二甲基丙烯酸氨基乙酯(UDMA)比TEGDMA和甲基丙烯酸2-羟乙基酯(HEMA)具有更强的细胞毒性[18]。本实验结果表明,浸提3 d时,Unicem组、SAC组和Duo-Link组表现为轻中度细胞毒性,镜下观察,Unicem组和SAC组的细胞数量相对较少,细胞形态贴壁生长,未见明显变化。本实验第7天时,受试的树脂水门汀均无细胞毒性。因此认为4种自粘接树脂水门汀都是良好的可供选择的粘接剂,相比较下,PermaCem的生物相容性更好些。
本实验作为目前临床常用自粘接树脂水门汀材料毒性的初探,应考虑体外研究的局限性。第一,光聚合在降低细胞毒性作用中起重要作用,在存在陶瓷屏障的情况下,双固化树脂水门汀会释放出更多的单体,当使用厚度不超过2 mm的陶瓷或树脂纳米陶瓷修复体时,被测材料的细胞毒性水平并不显著[20]。而本实验自粘接树脂水门汀采用无屏障作用下体外光固化,并不能很好地模拟临床上存在屏障的情况下的固化。因此,临床实际双固化的转化率情况还与屏障物的材料厚度和医师的操作有关。第二,口内的环境复杂,细胞种类繁多,而本实验研究的是HPDLFs单一的细胞群,存在一定的局限性。有研究者将12种不同的树脂粘接剂制成的盘状标本,通过Transwell细胞培养系统直接刺激5种不同的人类细胞系,所有测试的粘接剂均导致细胞活力下降,但在一定程度上取决于细胞类型,其中在成骨细胞系中检测到最高的细胞毒性作用[21]。第三,粘接剂残留在口腔内是个长期的过程,本实验设定的观察时间为7 d,长期的生物效应尚未确定。
目前,临床上可供选择的粘接剂较多,如何选择更可靠、更便捷的产品是临床医生普遍关心的问题。口腔材料日新月异,自粘接树脂水门汀也在不断改进升级中,使得牙科粘接树脂的自我修复成为可能。胡格等[22]在自粘接树脂水门汀中加入纳米抗菌无机填料,以提高材料的抗菌及自我修复功能。临床医师也应该按照双固化操作流程提高树脂水门汀固化转化率,减少游离单体溢出,去除粘接剂,减少粘接剂残留,有利于修复体、种植体及牙周组织健康。

