HPLC法测定诺氟沙星胶囊的有关物质
★李丽云 黎艳刚 朱海(云南省药物研究所/云南省中药和民族药新药创制企业重点实验室 昆明 650111)
诺氟沙星又称氟哌酸,是人工合成的第三代喹诺酮类抗菌药,1979年日本杏林制药公司发现了该化合物并申请了专利。1983年该药由默沙东作为申请人在意大利最初上市生产,当时采用片剂形式,商品名为Noroxin。1984年由杏林制药作为申请人在日本上市生产,所用商品名为Baccidal,同样采用片剂形式,该药目前仍然在日本上市。诺氟沙星胶囊于1987年在国内上市,目前有批文690余条[1],已有两家制药企业通过仿制药质量和疗效一致性评价。诺氟沙星在抗菌方面具备广谱性,特别在抵抗需氧GNB(革兰阴性杆菌)方面具备高效性,于体外可有效抑制肠杆菌科细菌中的多数菌属,同时体外可抵御多种耐药菌,对因敏感菌引发的尿路感染、伤寒、淋病、肠道感染、前列腺炎、其它沙门菌感染等具有治疗作用[2]。
本文通过对中国药典[3]所收载的诺氟沙星胶囊有关物质检测方法及欧洲药典所收载、参考文献[4]所记载的诺氟沙星有关物质检测方法进行了考察和对比,发现上述方法存在杂质控制不严、溶剂峰对主峰及杂质峰的测定产生干扰、梯度洗脱过程中容易出现基线波动等不足。因此,此项研究经色谱条件的筛选,完成诺氟沙星胶囊相关物质测定方法的建立,同时对其开展方法学验证。
1 仪器与试剂
Agilent 1260高效液相色谱仪,奥豪斯EX125ZH电子天平,梅特勒 DELTA 320型pH计。
诺氟沙星对照品及杂质A对照品、环丙沙星(Ciprofloxacin)对照品、依诺沙星(Enoxacin)对照品,均购于中国食品药品检定研究院;诺氟沙星杂质D对照品及杂质2对照品均购于TLC公司;诺氟沙星杂质H对照品、杂质B对照品、杂质K对照品及杂质E对照品均购于CATO公司;诺氟沙星胶囊(自研)。甲醇为色谱纯,水为纯化水;其它试剂均为分析纯。
2 方法与结果
2.1 色谱条件
采用安捷伦 ZORBAX SB-C18色谱柱(5 μm× 4.6 mm×250 mm);流动相A为0.015 mol/L磷酸溶液(由三乙胺将pH调节为3.0±0.1)-甲醇(85∶15),流动相B为甲醇,根据表1实施线性梯度洗脱处理;柱温、流速分别设定为30 ℃、1.0 mL/min;测定波长为262 nm与278 nm。
2.2 溶液的配制
稀释剂:即“2.1”项下的流动相A。
供试品溶液:取适量诺氟沙星胶囊内容物(与15 mg诺氟沙星相当),精密称定,移至100 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,再通过流动相A定容至100 mL,摇匀后滤过,即得供试品溶液。
各杂质对照品贮备液:分别取诺氟沙星杂质D、K、B、E 、2、A、H对照品约15 mg,精密称定,移至100 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,再通过流动相A定容至100 mL,摇匀,即得对照品贮备液。
峰定位溶液:取诺氟沙星对照品约15 mg,精密称定,移至100 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,分别量取上述杂质对照品贮备液各4 mL,再通过流动相A定容至100 mL,摇匀,作为峰定位溶液。
系统适用性溶液:分别取环丙沙星对照品和依诺沙星对照品约15 mg,精密称定,移至50 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,加流动相A定容至50 mL,摇匀;再取诺氟沙星对照品约15 mg,精密称定,并移至100 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,再加入1 mL上述混合液,之后通过流动相A定容至100 mL,摇匀,即得系统适用性溶液。
空白辅料溶液:取适量诺氟沙星空白辅料(与15 mg的诺氟沙星相当),精密称定,再移至100 mL量瓶内,通过2 mL盐酸溶液(0.1 mol/L)溶解,再通过流动相A定容至100 mL,摇匀后滤过,即得空白辅料溶液。
2.3 系统适用性试验
取“2.2”项下制备的峰定位溶液、系统适用性溶液分别进样,对色谱图进行记录。所得结果见图1,系统适用性溶液和峰定位溶液中各杂质与主峰、杂质与杂质之间分离完全,分离度均大于2.0,理论塔板数均大于4 000,符合系统适用性要求。
2.4 专属性试验
2.4.1 辅料干扰试验 取“2.2”项下制备的峰定位溶液、供试品溶液、空白辅料溶液与稀释剂分别进样,对色谱图进行记录。所得结果见图1,各杂质峰处均未见空白辅料与稀释剂出峰,表明辅料与溶剂皆不会影响对诺氟沙星胶囊的杂质测定。
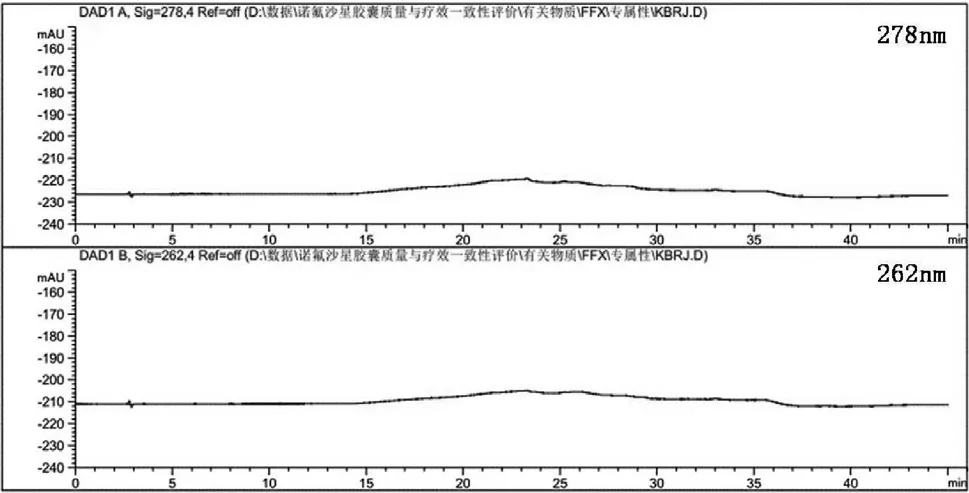

图1 典型色谱图
2.4.2 强制降解试验 取“2.2”项下供试品溶液和空白辅料溶液,分别置于2 mol/L盐酸溶液中、105 ℃条件下酸破坏4 h;2 mol/L氢氧化钠(NaOH)溶液内,105 ℃温度时碱破坏4 h;30%双氧水溶液0.1 mL中,105 ℃条件下氧化破坏3 h;105 ℃高温下破坏24 h;光照(5 000±500)lx条件下1个月,处理完成后分别进样,记录色谱图。结果表明诺氟沙星胶囊在酸、碱、氧化、高温、光照条件下均相对稳定,产生的降解产物较少,各降解产物峰与诺氟沙星主峰能完全分离,峰纯度合格,满足专属性强制破坏要求。
2.5 线性和范围
取诺氟沙星对照品约15 mg,精密称定,移至100 mL量瓶内,用2 mL盐酸溶液(0.1 mol/L)溶解,再通过流动相A定容至100 mL,摇匀,即得诺氟沙星对照品贮备液;分别精密量取“2.2”项下各杂质对照品贮备液1 mL以及上述诺氟沙星对照品贮备液1 mL,移至25 mL量瓶内,通过流动相A定容至25 mL,摇匀,即得对照品混合溶液;对此混合液分别进行不同量的准确量取:0.01、0.015、0.02、0.03、0.04、0.06、0.1 mL,逐一移至液相色谱仪,对色谱图进行记录。横坐标(X)、纵坐标(Y)分别为“对照品的进样量(单位:ng)”“峰面积”,开展线性回归,得到回归方程与相关系数r。见表2。
2.6 定量限和检测限
分别量取“2.2”项下各杂质对照品贮备液及“2.5”项下诺氟沙星对照品贮备液适量,用流动相A稀释至信噪比为10∶1和3∶1的浓度,精密量取上述对照品溶液各0.02 mL,注入液相色谱仪,记录色谱图。见表2。

表2 诺氟沙星及已知杂质的线性关系及灵敏度测定结果
2.7 精密度试验
2.7.1 仪器精密度 精密量取1 mL“2.5”项下诺氟沙星对照品贮备液,移至25 mL量瓶内,用流动相A定容至25 mL,摇匀,即得对照品溶液。精密量取上述对照品溶液0.02 mL,注入液相色谱仪,共进行6次不间断进样,记录色谱图,通过主峰峰面积与保留时间的RSD波动,考察仪器于此色谱条件下的精密状况。结果显示,关于对照品溶液,其主峰峰面积、保留时间RSD值依次是1.88%、0.69%,可见仪器于此色谱条件下具备良好精密度表现。
2.7.2 重复性 依照“2.2”项下制备供试品溶液的方法,完成6份供试品溶液的制备,之后分别准确吸量0.5 mL,移至100 mL量瓶内,通过流动相A定容至100 mL,摇匀,即得对照溶液;分别准确吸量此对照溶液与供试品溶液0.02 mL,移入液相色谱仪,对色谱图进行记录,根据外标法,通过峰面积对已知杂质含量展开求解,得到杂质K的RSD值是1.97%,可见此法具备良好重复性。
2.7.3 中间精密度 依照“2.2”项下制备供试品溶液的方法,由不同操作者,借助不同仪器于不同时间,取12份批次相同的样品进行重复检测,考察方法的中间精密度,其中第1天的数据引用重复性项下的结果,结果显示杂质K的RSD值等于3.93%,可见此法具备良好中间精密度。
2.8 准确度试验
分别量取“2.2”项下各杂质对照品贮备液及“2.5”项下诺氟沙星对照品贮备液2 mL,移至50 mL量瓶内,通过流动相A定容至50 mL,摇匀,即得对照品混合贮备液;之后量取2.5 mL,移至50 mL量瓶内,通过流动相A定容至50 mL,摇匀,即得对照品混合溶液。取空白辅料适量,精密称定,置50 mL量瓶中,分别加入对照品混合贮备液2.0、2.5和3.0 mL,通过流动相A定容至50 mL,摇匀后滤过,取续滤液制备不同浓度供试品溶液,低、中、高浓度依次为80%、100%、120%,各浓度皆重复配样3份,分别移入液相色谱仪,对色谱图进行记录,借助外标法,经由峰面积对已知杂质含量展开计算。结果显示,诺氟沙星杂质D、K、B、E、2、A、H及诺氟沙星的平均回收率为99.19%、107.95%、98.85%、103.43%、106.16%、106.05%、102.35%、99.04%,RSD值为0.60%、2.40%、1.28%、1.51%、1.28%、1.29%、0.98%、2.64%,表明本法检查有关物质的准确度良好。
2.9 溶液稳定性试验
依照“2.2”项下制备供试品溶液的方法进行供试品溶液的制备,静置于室温中,分别于0、4、8、12、16、20、24 h精密吸量上述样品溶液0.02 mL,分别注入液相色谱仪,记录色谱图。结果显示,供试品溶液内总杂质、最大单杂、已知杂质皆未见明显改变,同时无新杂质形成,可见供试品溶液于室温静置24 h依然具备稳定性。
2.10 耐用性试验
经由调整流速、流动相比例、磷酸盐酸碱度、柱温、厂家不同、批号不同的色谱柱来考察拟定色谱条件的耐用性。准确吸量0.02 mL供试品溶液,移至液相色谱仪,对色谱图进行记录。结果表明当流速变动±10%、柱温变动±5 ℃、磷酸盐pH值变动±0.2、流动相的比例变动±2%、改变色谱柱时,对测定结果不造成影响,说明本法对流速、柱温、磷酸盐pH值、流动相的比例、色谱柱的耐用性良好。
2.11 样品测定
按照经方法学验证的有关物质检查方法,对自研诺氟沙星胶囊的有关物质进行检查。见表3。
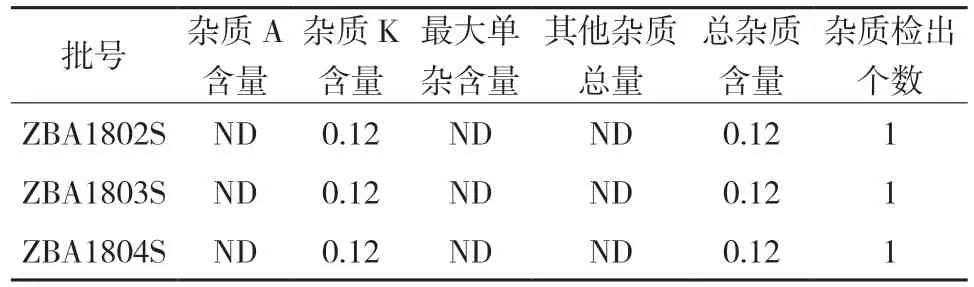
表3 关物质检查结果………… %
3 讨论
据文献报道,河南省药检所于2018年对43批次诺氟沙星胶囊进行了有关物质专项监督抽验,按现行标准检测,部分批次的诺氟沙星胶囊主峰前有一杂质峰与主峰未完全分离,该杂质峰应为杂质E[5];与此同时,浙江省台州市药检所于2017年对57批次诺氟沙星胶囊进行了抽验,有关物质研究结果发现,3个厂家的5批次样品中检出杂质E超标,1批检出杂质K在限度边缘[1]。因此,为有效控制产品质量,诺氟沙星胶囊的有关物质检测方法需要修订提高。
本研究是在《中国药典》收载的诺氟沙星胶囊有关物质检测方法的基础上,对色谱条件进行了调整,经专属性、线性、定量限和检测限、精密度、准确度、耐用性等试验的验证后,确认该检测方法不仅准确可靠,而且可以检测出诺氟沙星的7个杂质,尤其是诺氟沙星原料于合成期间生成的杂质E和杂质K。如表3所示,自研的诺氟沙星胶囊中含0.12%的杂质K,说明该有关物质检测方法更有利于控制原料药及产品的质量。

