基于生物信息学方法分析HMMR在结直肠癌中的表达及临床意义
周洪晨,刘洪涛,张成,汪颖厚
(锦州医科大学北部战区总医院研究生培养基地,辽宁 沈阳 110015)
结直肠癌(CRC)是一种发生于结肠或直肠血脑屏障的异质性疾病[1]。尽管几年前CRC 的发病率相对较低,但最近的发病率和死亡率不断上升[2]。到目前为止,尽管有众多结直肠癌早期筛查的方法,其中又以结肠镜的敏感性和特异性最佳,但结肠镜是一种侵入性质的检查,使其难以广泛应用于早期检查[3]。因此CRC 的早期诊断依旧是一个全球性的问题[4]。我们迫切需要一种低成本、无创的方法,包括对早期诊断有价值的新型生物标志物。研究表明,结直肠癌发生率受到营养状态的强烈影响,不健康的高脂肪/高碳水化合物的饮食显著促进了CRC 病例[5]的增加。结直肠癌的发生通常是一个漫长和复杂的过程,包括从正常上皮细胞恶性转化成为癌细胞的几个步骤,涉及到大量的基因变化,导致各种表型改变[6]。其中大量因子参与了这个过程[7]。而有研究表明,透明质酸介导的运动受体(hyaluronan mediated motility rcecptor,HMMR)基因在许多癌症的病理中起着重要作用。其中HMMR 蛋白在乳腺肿瘤细胞破坏周围基质中发挥着一定作用[8]。此外,有报道称HMMR 已被证实与肺癌患者总生存率降低有关[9]。
肿瘤的发生发展是由细胞和细胞外基质及其他细胞的相互作用完成的。而透明质酸是细胞外基质(ECM)的主要组成成分,其在细胞基本行为中发挥了重要的作用。HMMR 也称为CD168,在最初的时候被认为是一种新型透明质酸受体[10]。HMMR 与透明质酸、钙调蛋白、肌动蛋白以及细胞外调节激酶信号通路成分之间相互作用,在细胞迁移及粘附等过程中起到了重要的作用。并在透明质酸、TGF-β 或PDGF 的作用下,HMMR 可激活多种信号级联[11]。此外,HMMR 可以调控MEK1 和ERK1/2,从而保持有丝分裂纺锤体的完整性、调节细胞周期的进展以及控制细胞外基质(ECM)重组和降解的基因的表达。在许多肿瘤中,HMMR 的过表达均被证实与疾病进展有关。但关于HMMR 与CRC 的关系,及其分子机制的研究尚报道较少。因此,本文旨在通过生物信息分析以及免疫组化验证等方式进一步研究HMMR 与CRC 发生发展及预后的关系。
在本研究中,我们从以Oncomine 数据库为主的多个数据库中提取了HMMR 在结直肠癌组织及癌旁组织的表达情况。并通过Oncomine 数据库提供的临床信息,分析了HMMR 表达与CRC 临床病理特征及生存预后之间的关系。此外还利用了GO富集分析、String 蛋白互作网络、KEGG 通路分析等研究与HMMR 调控机制可能有关的通路。以期证明HMMR 是一个与CRC 诊断及预后有关的标志物。
1 资料与方法
1.1 差异基因筛选及数据处理
先通过TCGA 数据库下载基因数集,再采用“edgeR 包”对上述基因表达矩阵进行转换与分析[以P<0.05、logFC(fold change)>4 或logFC<-4]为筛选条件,从而得到结直肠癌中差异基因集(见图1),并制作火山图。并从中筛选出差异基因HMMR。

图1 结直肠癌中差异基因表达图
1.2 生物信息学资料
1.2.1 HMMR 在结直肠癌与正常结直肠组织中的差异 使用 Oncomine 数据库(https://www.oncomine.org/)检索条件:①Cancer Type:Colorectal cancer;②Gene: HMMR;③Analysis Type: Cancer vs.Normal Analysis;④临界值设定条件(P value<1E-4,fold change>2),分析结直肠癌组织与正常组织的基因差异表达并筛选出目的基因HMMR;证明HMMR 在结直肠癌中显著高表达。利用BioGPS 数据库(http://biogps.org/#goto=welcome)检索条件,检索条件:Gene:HMMR,分析目的基因HMMR 在正常人体各种组织及细胞中的表达情况。使用HPA 数据库(The Human Protein Atlas)检索条件,检索条件:Gene:HMMR,下载HMMR 在结直肠癌及正常结直肠组织中的免疫组化染色图片。
1.2.2 临床病理资料分析 使用Ualcan 数据库(http://ualcan.path.uab.edu/index.html)检索条件:Gene: HMMR,Cancer Type: Colorectal cancer,分析HMMR 的表达与临床病理资料的相关性。
1.2.3 患者生存预后分析 使用GEPIA 数据库(http://gepia.cancer-pku.cn/)检索条件:Gene:HMMR,Log2 FC≥1,P<0.01,Cancer Type: Colorectal cancer 以及COX 分析目的基因HMMR 在结直肠癌及正常组织中的表达情况以及HMMR 的表达对结直肠癌患者生存预后的影响。
1.2.4 蛋白互作网络图、GO 富集分析及KEGG通路分析 使用String 数据库(https://string-db.org/)检索条件:Protein Name: HMMR,制作PPI蛋白互作网络图。使用Linkedomics 数据库(http://www.linkedomics.org/)检索条件,检索条件:Gene: HMMR。以及使用DAVID 数据库(https://david.ncifcrf.gov/)检索条件,检索条件:Gene:HMMR。进行GO 功能注释和KEGG 通路富集分析。
1.2.5 免疫浸润及亚型分析 使用TISIDB 数据库(http://cis.hku.hk/TISIDB)检索条件,检索条件:①"Cancer: Colorectal cancer";②"Gene: HMMR",用于分析HMMR 在CD4+T 细胞、CD8+T 细胞、巨噬细胞等免疫浸润细胞中的表达以及HMMR 在结直肠癌的不同分子亚型和免疫亚型表达的差异。
2 结果
2.1 HMMR mRNA 在不同肿瘤类型中的表达情况
HMMR 表达差异具有统计学意义的共有72项,其中HMMR 高表达的研究64 项,HMMR 在结直肠癌中高表达的研究有9 项(见图2),研究中低表达的有8 项。在肺癌、乳腺癌等大部分肿瘤中HMMR 呈现为高表达;而在血液系统肿瘤中呈现为低表达(见图3)。

图2 HMMR 在结直肠癌中表达情况

图3 HMMR mRNA 在不同肿瘤中的表达情况
Oncomine 数据库检索显示,在涉及的9 个关于HMMR 与结直肠癌关系的研究中(见图4),此类研究分别发表于Mol Cancer Res,PLoS One,TCGA Colorectal。与正常组对比,HMMR mRNA 在所有差异基因中其中位数值排名为325.0,差异有统计学意义,差异有统计学意义(P<0.01),提示HMMR 在结直肠癌中显著高表达。

图4 HMMR 在结直肠癌各个研究中的结果分析
2.2 HMMR mRNA 在结直肠癌和正常结直肠组织中的不同表达情况
通过GEPIA 数据库分析后显示,与正常组织相比,HMMR 在结直肠癌组织中表达水平明显升高,差异有统计学意义(P<0.05),见图5。

图5 HMMR 在结直肠癌和正常结直肠组织中的不同表达情况
2.3 HMMR mRNA 在结直肠癌、正常结直肠组织、T 细胞以及B 细胞中的表达分布
BioGPS 数据库分析后显示,HMMR 在结直肠癌中高表达,在正常结直肠组织、T 细胞和B 细胞中均是低表达,见图6。

图6 HMMR 在正常人体组织和细胞中的表达图
2.4 HPA 数据库免疫组化结果
先通过从HPA 数据库下载HMMR 在结直肠癌及正常组织的免疫组化染色图片。得出结果,结直肠癌组织中HMMR 染色成阳性(见图7A),配对癌旁组织中HMMR 表达呈阴性(见图7B)。

图7 HMMR 在结直肠癌及正常组织的免疫组化染色图
2.5 HMMR 与结直肠癌临床病理特征相关性分析
通过Ualcan 数据库进行HMMR 基因表达与临床病理资料相关性分析,纳入286 例肿瘤样本、41 例正常组织样本。分析结果显示在stage分期、性别、淋巴结转移等亚组中,HMMR 在结直肠癌中的表达均显著高于正常组织,差异有统计学意义(P<0.01),见图8A-F。其中在结肠癌中不同stage 分期、淋巴结转移中组间差异有统计学意义(P<0.01)见图8A、8E。而在直肠癌中不同性别中存在组间差异有统计学意义(P<0.01),见图8D。
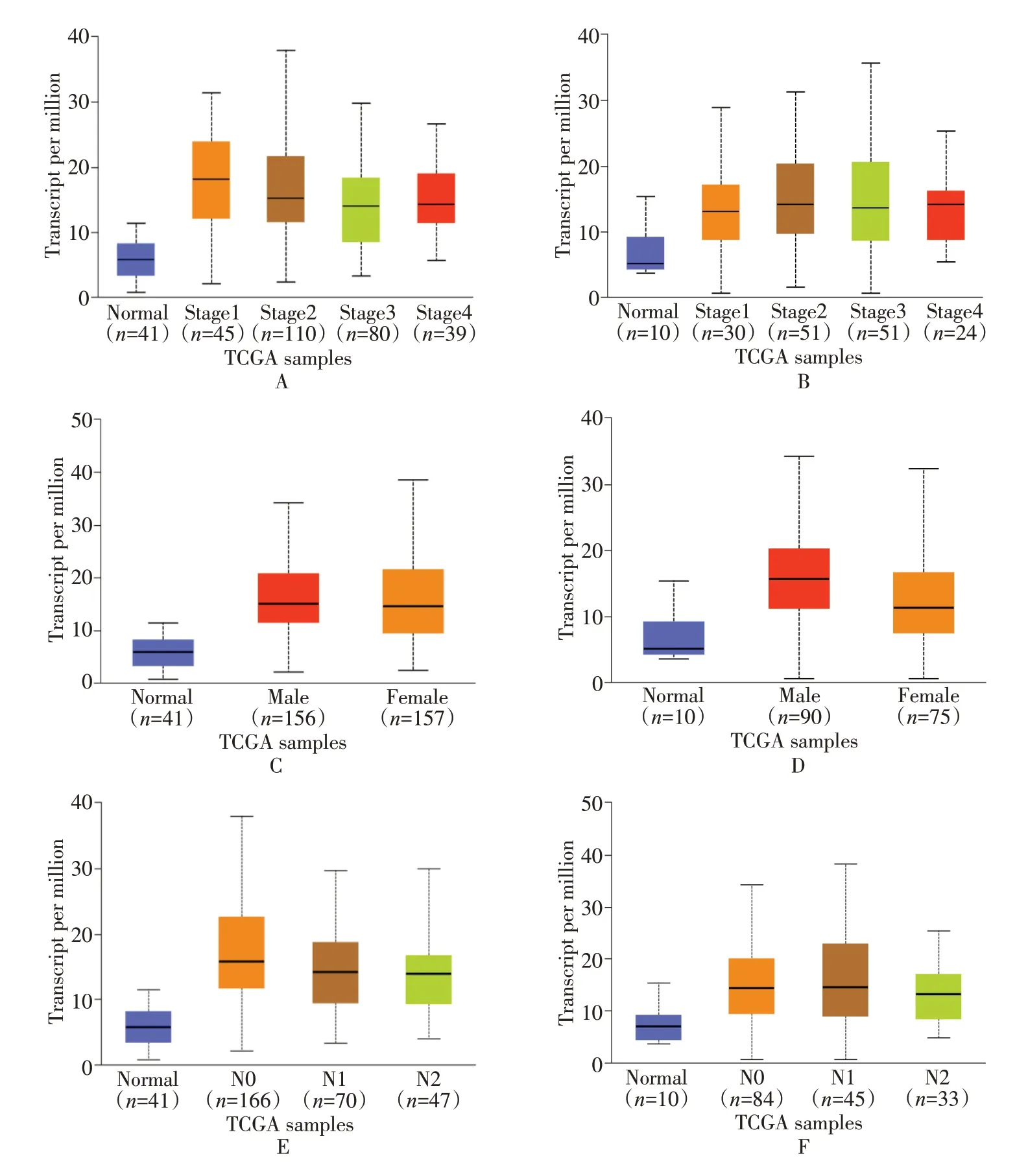
图8 HMMR 基因表达与临床病理资料相关性分析图
2.6 高表达HMMR mRNA 的结直肠癌患者的OS、RFS 评估
通过GEPIA 数据库OS/RFS 结果显示,HMMR mRNA 高表达组结直肠癌患者的OS 较低表达组显著延长(=0.55,P<0.01);HMMR mRNA 高表达组结直肠癌患者的RFS 较低表达组,差异无统计学意义(=0.84,P>0.05)(见图9、图10)。
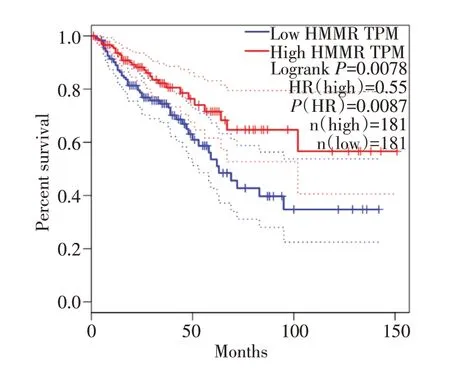
图9 HMMR 的表达和结直肠癌患者总生存期的关系
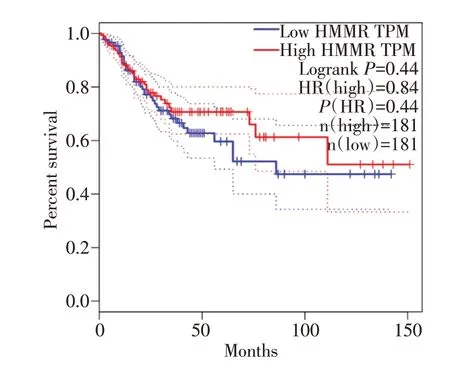
图10 HMMR 的表达和结直肠癌患者无进展生存期的关系
图10 HMMR 的表达和结直肠癌患者无进展生存期的关系
2.7 HMMR 基因是结直肠癌患者OS 的良好预后因子
Cox 分析显示HMMR 基因是结直肠癌患者OS的良好预后因子,其中为0.436,95%CI为0.254~0.746,P=0.002,差异具有统计学意义。此外,远处转移、淋巴结转移、浸润深度是结直肠癌患者OS 的危险因素。见表1。

表1 影响结直肠癌患者OS 的单因素分析
2.8 String 数据库分析HMMR 相互关联的基因并行蛋白互作网络
利用String 数据库寻找HMMR 相互关联基因18 组,并构建HMMR 相关蛋白互作网络图(见图11)。其中HMMR 与经典癌症指标CD44 具有关联性。

图11 HMMR 相互关联蛋白互作网络图
2.9 Linkedomics 数据库及DAVID 数据库进行GO 功能注释和KEGG 通路富集分析
先通过Linkedomics 数据库中筛出与HMMR共表达基因有PTTG1/CDC25C/NCAPG/CENPE 等538 种,再根据正相关、负相关分组并绘制火山图(见图12)。再通过DAVID 数据库分别进行GO 及KEGG 分析。主要涉及的KEGG 信号通路包括细胞周期信号通路、P53 相关信号通路、卵母细胞减数分裂信号通路;细胞组分主要集中在细胞中心体、微管细胞骨架、纺锤体、细胞溶质、细胞核等10 类;分子功能有蛋白激酶结合、微管结合、组蛋白激酶活性、蛋白绑定等5 类;生物学过程有有丝分裂核分裂、细胞分裂、有丝分裂纺锤体组装以及有丝分裂G2/M 转变等11 类过程,见表2。

图12 HMMR 共表达基因

表2 HMMR 和相关基因的GO 功能注释和KEGG 通路富集
2.10 HMMR mRNA 在结直肠癌组织中与多种免疫细胞的关系
通过TISIDB 数据库研究发现,HMMR mRNA与NK 细胞、B 细胞、巨噬细胞、CD4+T 细胞和肥大细胞等细胞在结直肠癌组织的免疫微环境中的表达明显相关,差异有统计学意义(P<0.01);而与中性粒细胞、CD8+T 细胞在结直肠癌组织免疫微环境中的表达无确切关系,差异无统计学意义(P>0.05)(见图13)。其中HMMR mRNA 表达水平与CD4+T、Th2 细胞呈正相关;而与其余免疫细胞呈负相关(见图14)。

图13 HMMR 与各个肿瘤免疫细胞间的相关性

续图13 HMMR 与各个肿瘤免疫细胞间的相关性

图14 HMMR 在结直肠癌中与肿瘤免疫细胞间的相关性
2.11 HMMR 在结直肠癌的不同分子亚型和免疫亚型表达的差异。
在结直肠癌的分子亚型中,HMMR 在超突变单核苷酸受体(HM-SNV)表达最高,在基因组稳定性(GS)中表达最低(见图15)(P<0.01)。在结直肠癌的免疫分型中,HMMR 在IFN-γ 为主型表达最高,在炎症性表达最低(见图16)(P<0.01)。

图15 HMMR 在结直肠癌的不同分子亚型中的表达

图16 HMMR 在结直肠癌的不同免疫亚型中的表达
3 讨论
细胞周期的调节在肿瘤的发生发展过程中起到了重要作用。正常细胞的分裂分为G0、G1、S、G2以及M 五个阶段,而在癌细胞的分裂过程中常伴有丝分裂相关因子以及蛋白的表达异常。在有丝分裂过程中,着丝点准确地附着在染色体上,以保证其准确的分离。有丝分裂纺锤体的形成与细胞分裂、染色体的分离起到了关键性的作用[12]。HMMR 的表达受细胞周期调节,主要在G2晚期以及有丝分裂早期之间的峰值表达。HMMR 定位于纺锤体极,通过与微管的结合,进而使得纺锤体高度稳定,并通过激活纺锤体调控位点,进而在整个细胞周期过程中维持了纺锤体的完整性及稳定性。在GUO 等[13]报道,HMMR 的高表达与组织分级、病理分期和生存状态显著相关,HMMR在肝癌中表达为高水平。HMMR 的高表达可能是肝癌的不利预测因素。LI 等[14]研究表明HMMR在肺腺癌组织中处于高水平,同时,HMMR 可能促进了肺腺癌细胞增殖、迁移和侵袭。YE 等[15]报道,未分化多形性肉瘤(UPS)中含有大量细胞外基质(ECM),包括透明质酸(HA)。而透明质酸介导的HA 受体(HMMR)的表达在正常组织中呈现低表达,而在UPS 中表达上调。此外,HMMR 的高表达与较差的临床结局相关。通常来说,HMMR 在大多数正常组织中呈低表达,但在一些增生性组织如脾脏、睾丸、胎盘和胸腺中表达升高[16]。另一些癌症中,低表达的HMMR 往往提示预后较差。例如,超过一半的恶性周围神经鞘肿瘤中HMMR 表达下调[17];HMMR 表达在绝大多数的精原细胞瘤中降低[18]。上述研究表明HMMR 基因在不同类型肿瘤中可能发挥着不同的作用。
目前关于HMMR 在结直肠癌中的具体作用机制研究尚存争议。因此,本研究旨在通过生物信息学深入分析HMMR 基因,并探索HMMR 在结直肠癌与正常组织中的不同表达及与免疫细胞浸润、预后的关系。本研究发现,HMMR 在大部分肿瘤中呈高表达,表达增高的研究64 项,表达降低的研究8 项,HMMR 在结直肠癌中高表达的研究有9 项。在其他癌中,在肺癌、乳腺癌、肝癌等HMMR 呈现为高表达;而在血液系统肿瘤中呈现为低表达。这一结果与他人研究相一致。通过GEPIA 数据库分析发现,HMMR 基因的表达水平对结直肠癌患者的OS 存在显著影响,HMMR mRNA 高表达组结直肠癌患者的OS 显著延长,表明HMMR 高表达的结直肠癌患者预后可能会更好。继续通过Linkedomics 数据库挖掘到与HMMR共表达基因,并对其进行功能注释和KEGG 通路富集分析,发现主要涉及的KEGG 信号通路包括有细胞周期信号通路、P53 相关信号通路;功能注释主要涉及微管结合、有丝分裂纺锤体组装以及有丝分裂G2/M 转变等。HMMR 在有丝分裂早期与纺锤体的微管特异性结合,使得纺锤体高度稳定,加强了细胞周期G2/M 期检测点对肿瘤细胞的监控,进而促使结直肠肿瘤细胞凋亡并抑制其增殖。通过TISIDB 数据库发现,HMMR 与NK 细胞、B细胞、巨噬细胞、CD4+T 细胞和肥大细胞等细胞在结直肠癌组织的免疫微环境中的表达明显相关。推测是HMMR 参与了多种免疫细胞的免疫防御功能,减少了肿瘤细胞对免疫细胞的抑制作用,提高了结直肠癌患者机体防御力[19-20],从而延长结直肠癌患者总体生存期。通过Ualcan 数据库发现,在结直肠癌的不同Stage 分期中,HMMR 在Ⅰ期的表达显著高于Ⅱ、Ⅲ、Ⅳ期;在结直肠癌的不同淋巴结转移中,HMMR 在N0 组的表达显著高于N1、N2 组。这也同样证实了,HMMR 促使了结直肠肿瘤细胞凋亡并抑制其增殖。
综上所述,我们通过对结直肠癌组织中HMMR 相关基因信息的深入挖掘,进一步证明了HMMR 在CRC 患者中确实为高表达,且与结直肠癌的预后及免疫细胞浸润密切相关。今后可能作为CRC 患者潜在的分子标志物。相较于传统单一实验样本的研究,肿瘤数据库具有样本量大、可信度高等优点,对疾病的诊治与分析提供了强有力的生物学依据,也为进一步探索HMMR 基因与结直肠癌的关系奠定了基础。

