大肠癌患者血清与组织中骨膜蛋白的表达分析
张业霞,周 阳,李淑敏
(1菏泽医学专科学校;2菏泽市立医院,山东 菏泽 274000)
大肠癌是临床上常见的消化道恶性肿瘤,其发病率和死亡率占恶性肿瘤的第三位,是我国恶性肿瘤发病率上升最快的肿瘤之一[1]。复发和转移是致使患者预后较差和死亡的重要因素,也是威胁患者术后生存质量的主要原因。近年来发现的骨膜蛋白(periostin,POSTN)被认为是与恶性肿瘤侵袭性和转移性相关的重要蛋白质因子,同时也观察到大肠癌患者血清中POSTN含量升高。为进一步明确POSTN在大肠癌患者诊断、病情判断及预后评估中的作用,本研究通过免疫组织化学方法检测POSTN在大肠癌组织中的表达情况,探讨其与肿瘤细胞病理分型的关系,评估其作为判断恶性肿瘤生物学行为指标的可行性;同时通过酶联免疫吸附法检测血清POSTN含量,以此评估其作为大肠癌血清学检测指标的效能,进一步明确POSTN在肿瘤发生、发展中的作用,为指导临床诊断与治疗提供科学理论依据。
1 资料与方法
1.1 一般资料选择2016年8月—2018年12月在菏泽市立医院及周边医院住院手术切除的大肠癌患者61例,其中男39例,女22例;年龄30~72岁;Dukes临床分期:A期11例,B期27例,C期18例,D期5例;病理组织学分型:腺癌45例,黏液癌11例,未分化癌5例。同时选取同期健康体检人群30例为对照组。
1.2 材料选取所有患者术前均未进行放、化疗及其他治疗,均经术后病理诊断证实。手术前采集大肠癌患者及健康对照者静脉血液样本,离心后提取血清后测定血清POSTN含量;取患者术后切除组织进行病理切片及免疫组织化学染色,同时取距癌组织5 cm 以上的远端正常组织20例作为对照,检查POSTN的表达情况。
1.3 方法
1.3.1 血清POSTN含量的测定 采用酶联免疫吸附法(ELISA)对大肠癌患者与健康对照者血清POSTN含量进行测定。实验原理为双抗体夹心法,严格按试剂盒要求操作,然后绘制出标准曲线(标准品浓度为横坐标,OD值为纵坐标),结合待检样品OD值,于标准曲线上查找出对应浓度,再与稀释倍数相乘,即得所需待检样品的实际浓度。
1.3.2 免疫组织化学技术 以PV6000通用二步法进行操作,主要步骤:首先将石蜡切片脱蜡至水,然后用磷酸盐缓冲液(PBS)冲洗,再经乙二胺四乙酸(EDTA)进行抗原修复,然后滴加3%的H2O2以阻断内源性过氧化物酶,再滴加一抗,置37 ℃温箱孵育,结束后加二抗于光镜控制下行二氨基联苯胺(DAB)显色,最后苏木素复染、封片。阴性对照以PBS 缓冲液代替一抗进行操作。
判定标准:阳性:细胞着色为棕色或棕褐色;阴性:细胞呈无色或淡黄色;弱阳性(+):黄色或浅棕色;强阳性(++):棕黄色或棕褐色。
1.4 统计学处理应用SPSS19.0软件进行数据分析,计数资料以n(%)表示;采用 χ2检验;计量资料以± s表示,P<0.05表示差异有统计学意义。
2 结果
2.1 血清POSTN含量检测结果与对照组相比,大肠癌患者血清中POSTN水平显著升高(P<0.05);大肠癌Dukes分期中,A期和B期血清POSTN含量差异无统计学意义(P>0.05),C期和D期的血清POSTN水平显著高于A期和B期,且D期高于C期(P<0.01);不同病理类型患者血清标本中,未分化癌血清中POSTN水平显著高于黏液癌和腺癌(P<0.01)。见表1。
表1 血清骨膜蛋白含量检测结果(± s)
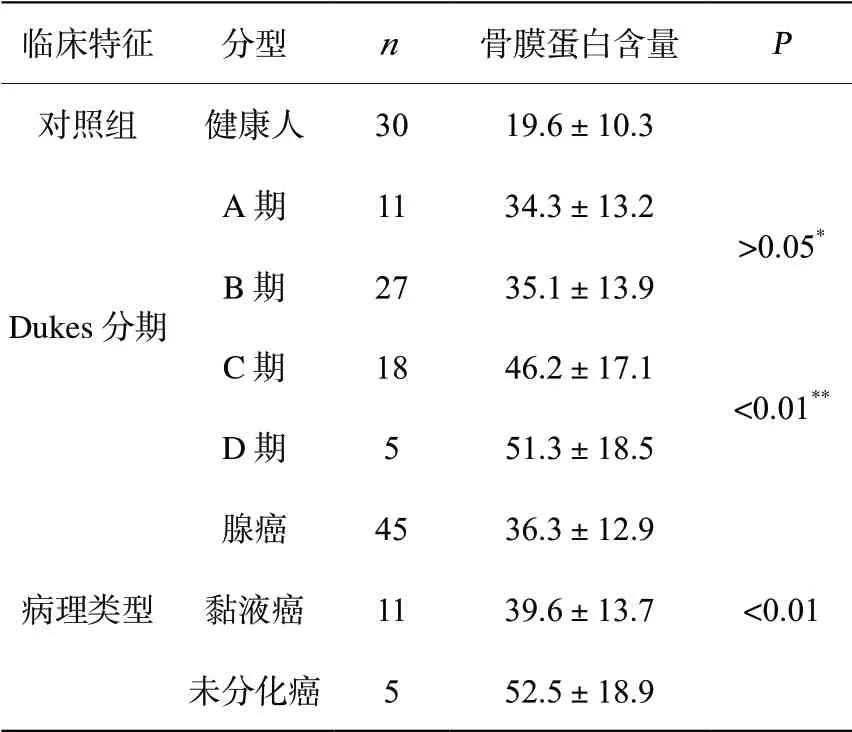
表1 血清骨膜蛋白含量检测结果(± s)
*A期与B期相比较;** C期与D期相比较。
临床特征 分型 n 骨膜蛋白含量 P对照组 健康人 30 19.6±10.3 A期 11 34.3±13.2 Dukes分期>0.05*B期 27 35.1±13.9 C期 18 46.2±17.1<0.01**D期 5 51.3±18.5腺癌 45 36.3±12.9病理类型<0.01黏液癌 11 39.6±13.7未分化癌 5 52.5±18.9
2.2 免疫组化染色结果患者术后组织免疫组化染色显示,大肠癌组织普遍表达POSTN,总阳性表达率75.4%(46/61),其中34例呈强阳性表达,占阳性表达数的73.9%(34/46)。癌细胞仅少数有POSTN的表达,其胞质中偶见黄色或浅棕色颗粒;染色颗粒主要位于癌组织基质的间质细胞的胞质中,内含有较多量的棕黄色颗粒,染色颗粒在间质细胞中的分布高于其在癌上皮细胞中的表达。研究还发现,POSTN在大肠癌组织的表达状况与患者临床Dukes分期有关,Dukes分期越晚,骨膜蛋白表达水平越高,差异有统计学意义(P<0.05)。在三种病理类型的大肠癌病例中,腺癌、黏液癌和未分化癌阳性表达率分别为73.3%、72.7%和100%,结果表明,除未分化癌表达阳性率较高外,另外两种类型表达阳性率差异无统计学意义,癌旁正常大肠组织中仅见有微弱表达。骨膜蛋白表达与年龄、性别无相关性(P>0.05),见表2。部分免疫组化染色结果如图1、2、3所示。

表2 大肠癌中POSTN表达情况与临床病理特征的关系

图1 低分化腺癌强阳性(免疫组化化学染色,x40倍)

图2 高分化腺癌阴性(免疫组化化学染色,x40倍)

图3 正常肠粘膜(免疫组化化学染色,x40倍)
3 讨论
目前常用的大肠癌肿瘤标志物如癌胚抗原(CEA)、糖链抗原19-9(CA19-9)、糖链抗原50(CA50)等,虽然在大肠癌的诊断及病情判断中有一定的临床意义,但在实际应用中有较大的局限性和不确定性,因此,寻找具有高灵敏度、高特异性的大肠癌肿瘤标志物,以协助大肠癌的早期诊断、判断有无转移及术后复发,意义重大。近年来骨膜蛋白似乎成为研究的热点,POSTN是一种多功能糖蛋白,是一种新发现的大肠癌候选标志物,研究发现其参与细胞外基质的组成,与肿瘤细胞的黏附、转移和生长密切关联。
POSTN又称为成骨细胞特异性因子-2(OSF-2),属转化生长因子-β(TGF-β)诱导的蛋白超家族,最早在鼠成骨细胞分泌的蛋白中被发现[2]。人源POSTN含836个氨基酸残基,基因位于第13号染色体长臂上,大小约为36 kb,相对分子质量约为93.33 kD,与鼠的氨基酸同源性约为89.2%,保守性强。近年来研究发现POSTN在组织修复、心脏损伤等机制中具有十分广泛的生理和病理性作用,且在多种人类肿瘤如乳腺癌、肺癌、卵巢癌等中,POSTN均是过表达[3-6]。POSTN尤其在肿瘤间质中广泛表达,与正常组织差异显著,参与恶性肿瘤的发生发展。肿瘤细胞常处于缺血、低氧等不良环境中,还须抵抗机体产生的各种抗肿瘤因子作用,故肿瘤细胞常利用自身分泌的蛋白质创造出利于肿瘤侵袭和转移的微环境。肿瘤微环境是一个复杂的综合系统,它由肿瘤细胞、间质细胞、微血管等多种细胞共同构成,对肿瘤的发生发展有重要作用,细胞只有在合适的靶器官微环境中才能生长[7-8]。大量国内外研究表明,在恶劣条件下,POSTN能够促进细胞生长及血管生成,维持肿瘤细胞的生存并促进其增殖[9]。
本研究免疫组化结果证实,大肠癌组织中POSTN表达明显高于正常组织,并主要表达于大肠癌细胞的间质中,这与Kikuchi等通过免疫组化和电镜证实POSTN由结肠腺周间质和结肠癌相关的间质细胞分泌结果一致[10]。因此,我们推断POSTN可能并非来源于肿瘤细胞,而是来源于大肠癌组织中的成纤维细胞,这与POSTN属于细胞外基质的理论相一致。肿瘤细胞外基质对肿瘤细胞的侵蚀及转染具有重要作用,多数肿瘤组织借助细胞外基质作为肿瘤细胞的物理支架及有丝分裂的场所,影响着肿瘤细胞的存活、生长、分化和转移。本研究还发现,POSTN在大肠癌组织的表达状况与患者临床Dukes分期有关,Dukes分期越晚POSTN表达水平越高,有统计学差异(P<0.05);23例C、D期病例中仅有1例阴性结果,POSTN阳性率高达95.7%(22/23),远高于A、B期的63.2%(24/38),但其表达与患者年龄、性别无相关性。有报道显示,超过80%的结肠癌组织中可以检测到POSTN的表达,肝脏转移的结肠癌患者其POSTN的表达水平更高,且转移前后有明显差异,与本研究结果一致。此结果预示POSTN与大肠癌的转移密切相关,其机制可能与经由整合素αvβ3激活的Akt/PKB信号通路有关。
为进一步评估POSTN作为大肠癌的血清学检测指标的价值,我们对大肠癌组和健康对照组进行了血清POSTN水平检测,结果表明:大肠癌患者血清中POSTN水平显著高于健康对照者,并随着Dukes分期的增高,血清中POSTN水平逐渐升高,C期和D期的血清POSTN水平显著高于A期和B期(P<0.01),与司志英等[11]的研究结果相符。因此,血清中POSTN水平在提示大肠癌患者具有侵袭和转移的风险评估中有重要意义,可以作为高风险的临床指标。同时,本研究也显示,在不同病理类型的患者血清标本中,未分化癌血清中POSTN水平最高,其次是黏液癌和腺癌,差异显著,故患者血清POSTN水平与癌组织病理类型有关。
综上所述,大肠癌患者无论是血液还是癌组织中骨膜蛋白均呈高表达状态,其表达水平与肿瘤Dukes分期和病理类型有一定关联,这在判断肿瘤进展、临床分期、术后复发及预后等方面具有一定意义。下一步研究重点是大样本测定血清骨膜蛋白含量在判断肿瘤转移、术后复发等方面的临床应用价值。

