BHT对黄瓜种子萌发和抗氧化酶活性的影响
孙子豪,郝柏慧,王成龙,王彩霞
(1.青岛农业大学植物医学学院/青岛市果蔬病虫害精准防控工程研究中心/山东省植物病虫害综合防控重点实验室,山东青岛 266109;2.青岛鑫润生物科技有限公司,山东青岛 266717)
黄瓜(Cucumissativus)是我国重要的葫芦科作物,目前我国已成为世界上黄瓜生产面积最大、总产量最高的国家[1]。黄瓜种子萌发过程中存在易霉变,难萌发,发芽率低,多弱苗等问题,严重影响黄瓜的产量和品质。育苗技术中培育壮苗的关键是种子播前预处理,目前主要通过物理方法、化学试剂和植物生长调节剂浸种等方式对种子进行播前处理,以提高种子发芽率,促进种子提前萌发和胚根生长[2-4]。
2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)是一种优良的非污染性抗氧化剂,具有淬灭单线态氧、清除自由基的功能,在食品加工、石油化工、塑料包装材料等产业中被广泛应用[5]。在农业上,关于BHT的研究多集中在其抑菌作用和诱导植物抗病性方面。马林等[6]研究发现BHT是内生放线菌娄彻氏链霉菌(Streptomycesrochei)的主要代谢产物之一,关晔晴等[7]报道BHT对多种植物病原真菌如梨黑斑病菌(Alternariaalternata)、灰葡萄孢(Botrytiscinerea)等具有显著抑制作用。最近研究发现BHT能够诱导提高植物抗病性,通过提高苹果果实内防御相关酶活性和抗氧化能力等,增加对苹果轮纹病、灰霉病等的抗性[8-10]。目前,对于BHT的促生作用及机制等研究尚未见报道。
种子贮藏、萌发阶段往往伴随着活性氧的产生和积累,其大量积累会对种子的萌发及生长发育造成损伤,而抗氧化酶是植物体内活性氧清除过程中的重要参与者。本研究以黄瓜种子为试材,用不同浓度BHT溶液处理种子进行发芽试验,旨在明确BHT对种子萌发的促生作用,并筛选出最适浓度;同时,通过测定种子萌发过程中抗氧化酶活性和总抗氧化能力(total antioxidant capacity,T-AOC)的时序变化,分析BHT对黄瓜种子萌发过程中的促生机制,以期为BHT在植物育苗生产中的开发应用提供参考依据。
1 材料与方法
1.1 试验材料
试验于2020年10月至2021年7月在青岛农业大学果树病害流行与综合防控实验室进行。供试黄瓜品种为‘中农116号’,购自中蔬种业科技(北京)有限公司;BHT购自美国Sigma公司。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性及总抗氧化能力测定试剂盒均购自南京建成生物工程研究所有限公司。
1.2 试验方法
1.2.1 BHT溶液制备
将BHT用甲醇溶解配制成1.0 mol·L-1的母液后,以无菌水稀释为0、0.1、0.2、0.5、1.0和2.0 mmol·L-1BHT溶液备用。
1.2.2 黄瓜种子消毒和催芽培养
挑选大小及饱满程度一致、种皮完整的黄瓜种子,用75%酒精浸泡30 s进行表面消毒,用无菌水冲洗干净后用吸水纸吸干种子表面水分。将表面消毒的黄瓜种子用1.2.1配制的不同浓度的BHT溶液共6个处理浸种8 h,其中无菌水(0 mmol·L-1BHT)为对照,每个处理30粒种子,3次重复。将浸种处理后的种子,用无菌水冲洗表面残留药剂,并用吸水纸吸干种子表面水分后置于铺有无菌吸水纸的培养皿中,于25 ℃培养箱中保湿暗培养。
1.2.3 种子萌发和胚根生长指标的测定
以胚根长度达到种子全长的一半为发芽。每天统计发芽数、测量种子胚根长度,第2天计算发芽势,第3天计算发芽率,第5天计算发芽指数,第7天用吸水纸吸干黄瓜幼苗表面水分,称量其鲜质量(30株幼苗)。并用烘干法[11]测量其干质量(30株幼苗):在105 ℃下杀青30 min,75 ℃烘干至恒重后称其干质量。
发芽指标用以下公式计算:
发芽率(%)=N2/N1×100 (N1表示供试种子数,N2表示发芽种子数);
发芽势(%)=N3/N1×100 (N3表示48 h发芽种子数);
发芽指数(GI)=∑Gt/Dt(Gt表示浸种后t日的发芽数,Dt表示相应的发芽日数)
1.2.4 黄瓜种子抗氧化酶活性和总抗氧化能力测定
以上述试验筛选出的最适浓度BHT溶液浸种处理黄瓜种子8 h,以无菌水浸种处理做对照。浸种完成后用无菌水冲洗黄瓜种子3遍,将其置于培养皿中保湿。于25 ℃恒温培养后0、12、24、48、72、96、120 h取样,每个处理10株,3次重复,样品用液氮速冻后于-80 ℃保存备用。
将样品用液氮研磨后,按1 g材料加入5 mL 0.1 mol·L-1的磷酸缓冲液(pH 7.4)比例混匀,于4 ℃,12 000 r·min-1离心10 min,所得上清液为粗酶提取液。分别以愈创木酚法、钼酸铵法和羟胺法测定POD、CAT和SOD的活性,T-AOC采用比色法测定,具体步骤参考南京建成生物工程研究所试剂盒说明书。酶活性和总抗氧化能力以每克植物组织鲜质量的酶单位数表示(U·g-1)。
1.3 数据处理
采用SPSS 21.0和Excel 2010软件对数据进行单因素方差分析、显著检验并作图。
2 结果与分析
2.1 不同浓度BHT对黄瓜种子萌发的影响
由表1可见,相比对照,各浓度BHT浸种处理对黄瓜种子萌发均有不同程度的促进作用。不同浓度BHT均可提高黄瓜种子发芽势,但各浓度间无显著差异,相比对照发芽势提高20.00%~30.91%。0.1~2.0 mmol·L-1的BHT均可提高黄瓜种子发芽率和发芽指数,其中BHT浓度为1.0 mmol·L-1时促进效果最显著,相比对照,发芽率和发芽指数分别提高19.45%和13.66%。
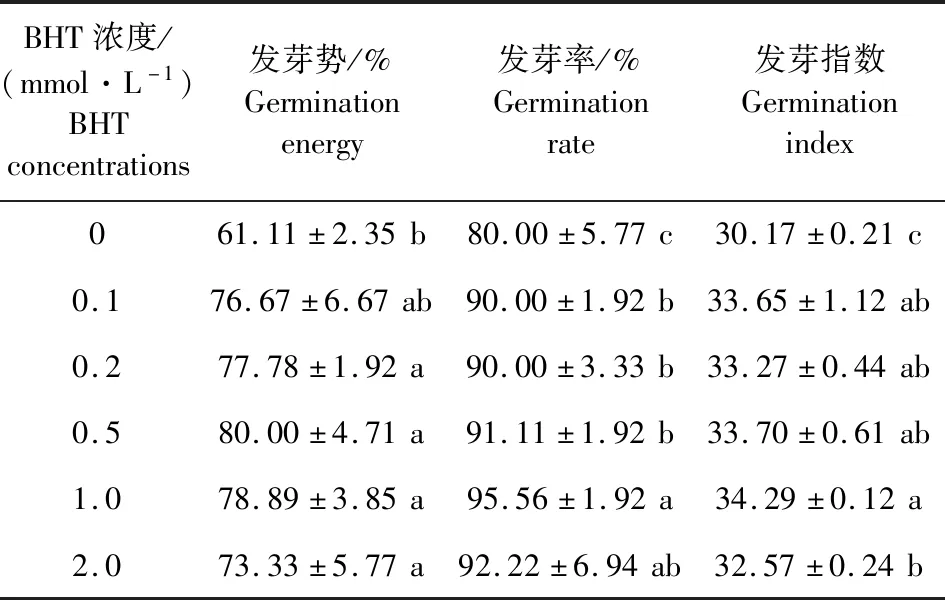
表1 不同浓度BHT溶液处理后黄瓜种子萌发指标的变化Table 1 Changes of germination indexes of cucumber seeds treated with different concentrations of BHT solution
2.2 不同浓度BHT对黄瓜种子胚根和幼苗生长的影响
由图1和表2可知,BHT浸种处理对黄瓜种子的胚根生长有明显的促进作用,各浓度处理均可提高黄瓜种子的胚根长度,其中1.0 mmol·L-1BHT处理对胚根的促生效果最显著,培养3 d时胚根长度达3.70 cm,比对照提高36.03%(表2)。BHT处理可显著提高黄瓜幼苗的鲜质量,但不同浓度BHT对幼苗鲜质量的影响无明显差异;此外,各浓度BHT处理均可显著增加黄瓜幼苗干质量,其中1.0 mmol·L-1BHT的处理效果最显著,浓度增加或降低,对幼苗干质量的促进作用均降低。因此,在后续研究中选择1.0 mmol·L-1BHT进行黄瓜种子抗氧化酶活性和总抗氧化能力指标测定。
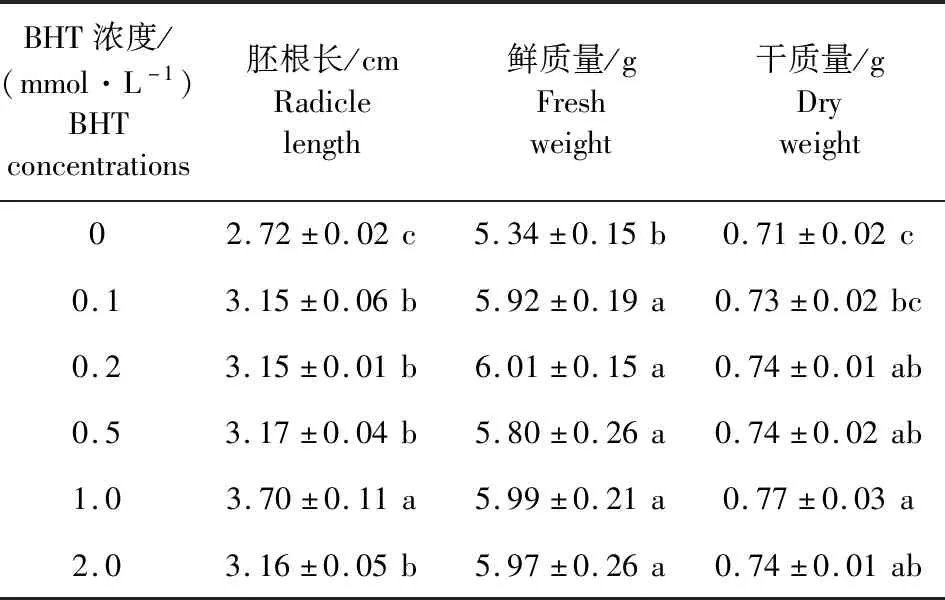
表2 不同浓度BHT溶液处理后黄瓜种子胚根长和幼苗重量的变化Table 2 Changes of radicle length and seedling weight of cucumber seeds treated with different concentrations of BHT solution
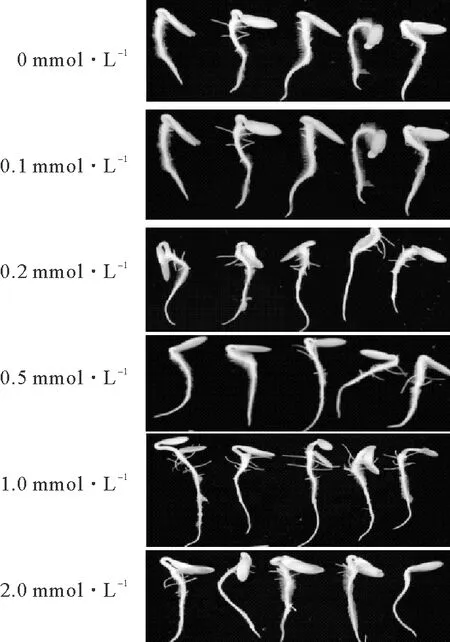
图1 不同浓度BHT溶液对黄瓜种子胚根生长的促进效果Fig.1 Promoting effects of different concentrations of BHT solution on radicle growth of cucumber seeds
2.3 BHT处理对黄瓜种子抗氧化酶活性和总抗氧化能力的影响
黄瓜种子萌发期间,测定了1.0 mmol·L-1BHT处理对3种抗氧化酶活性和总抗氧化能力变化趋势的影响(图2)。随处理后时间的增加,SOD活性呈现先升高后降低再升高的趋势,各时间点处理和对照无显著差异(图2A)。由图2B可知,黄瓜种子萌发过程中,POD活性升高后逐渐趋于稳定,BHT处理后12 h,POD活性显著高于对照,但其他时间点BHT处理酶活性与对照均无明显差异。CAT活性整体呈现先升高后降低的趋势,与对照相比,BHT处理黄瓜种子后24 h,其CAT活性开始显著升高,于处理后72 h到达峰值(492.92 U·g-1),随后于96 h活性急剧下降,但BHT处理CAT活性仍显著高于对照(图2C)。黄瓜种子处理后0~24 h,总抗氧化能力快速降低,且BHT处理和对照无明显差异,随后总抗氧化能力缓慢升高,处理后72 h、96 h和120 h,BHT处理总抗氧化能力显著高于对照,分别提高58.43%、69.44%、75.79%(图2D)。
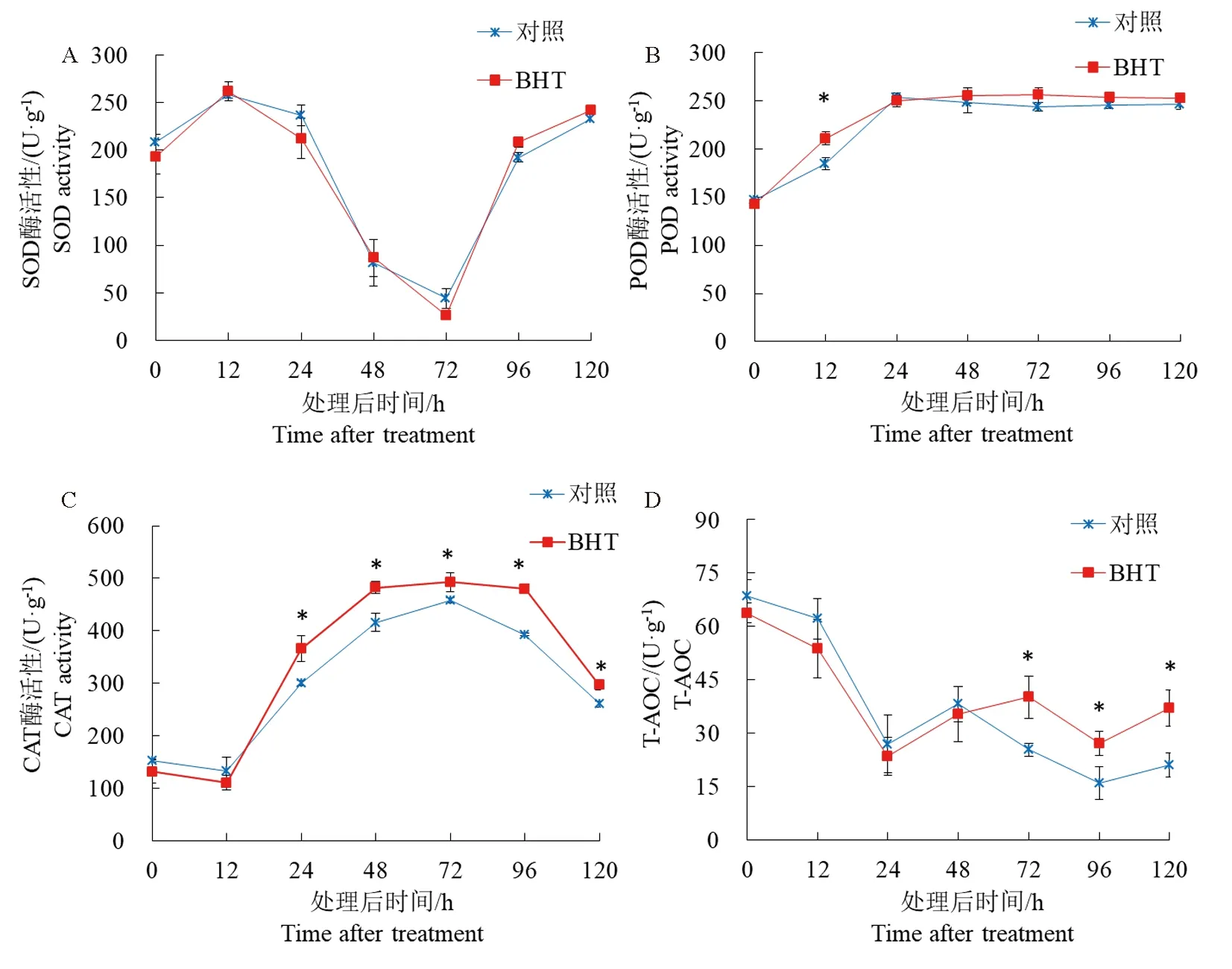
图2 1.0 mmol·L-1 BHT处理后不同时间黄瓜种子抗氧化酶活性和总抗氧化能力的变化Fig.2 Changes of antioxidant enzyme activities and total antioxidant capacity of cucumber seeds at different time after 1.0 mmol·L-1 BHT treatment注:*表示BHT处理和对照差异显著(P<0.05)。
3 讨论与结论
种子萌发是植物生长发育的关键阶段,对幼苗的形成起着决定性作用[12],多种化合物都具有促进种子萌发的功能[13-15]。本研究中BHT对黄瓜种子发芽势、发芽指数、胚根长度和幼苗干鲜质量等各指标的影响与其浓度密切相关,最适浓度为1.0 mmol·L-1,BHT浓度过高或者过低,促生作用均减弱。李艳等[16]研究发现铜绿假单胞菌M18的次生代谢产物申嗪霉素在适宜的浓度下对黄瓜种子发芽势、发芽指数和胚根生长等具有明显促进作用,但随浓度升高促生作用呈现先上升后下降的趋势,与本研究结果一致。
SOD、POD和CAT是植物主要的抗氧化酶,能够清除植物体内H2O2、超氧阴离子、羟基自由基,减少活性氧的积累,从而抵御活性氧对植物细胞的伤害[17-18]。总抗氧化能力指标能够很好地体现植物体内防御系统抗氧化能力的强弱程度[19]。杨若鹏等[20]研究发现水杨酸可以通过提高黄瓜种子的抗氧化酶活性来缓解干旱胁迫,促进幼苗生长;张秀玮等[21]发现硝普钠可以促进小麦、萝卜、黄瓜等作物种子的生长,并能显著提高其抗氧化酶活性,表明抗氧化酶活性升高有利于种子的胚根生长。本研究发现在黄瓜种子萌发期间SOD活性呈现先升高后降低再升高的趋势,相比0 h,处理后48~72 h酶活性显著降低,但BHT处理与对照SOD活性没有显著差异,该结果与刺槐和胡杨种子萌发过程中SOD酶活性变化趋势一致[22-23]。BHT处理可提高POD和CAT活性,尤其在处理后24~120 h,BHT处理CAT酶活性均显著高于对照;同时,BHT处理的总抗氧化能力在处理后72~120 h也均显著大于对照。表明BHT可能通过提高植物体内的抗氧化酶活性和总抗氧化能力,清除种子萌发过程中产生的自由基和活性氧,维持其平衡,从而促进黄瓜种子萌发和胚根生长。
综上所述,适宜浓度的BHT对黄瓜种子萌发具有显著促生作用,推测其可能在浸种过程中通过协助抗氧化酶清除种子萌发过程中产生的活性氧、自由基来促进种子萌发;并通过诱导提高胚根生长时期的POD、CAT等酶活性和总抗氧化能力来促进胚根生长。此外,已有研究表明BHT还具有抑菌、诱导植物抗性、不污染环境等优点[7-8],可见BHT在植物育苗生产中的开发应用具有巨大潜力,但种子萌发是一个复杂的过程,因此BHT对于植物促生作用的调控机制还需深入研究。

