两种含醛基的铱配合物用于半胱氨酸和OH-的识别
佟 鑫 赵世盛 楚 曦 李文豪 李红岩
(河北工业大学化工学院,天津300130)
0 引言
生物硫醇类化合物如半胱氨酸(Cys)、高胱氨酸(Hcy)和谷胱甘肽(GSH)在生物体内起着重要作用[1],其中Cys对人体内蛋白质的合成以及新陈代谢的正常进行具有重要影响[2-4]。人体内Cys浓度过高可能引发类风湿性关节炎、帕金森病、精神分裂症和阿尔茨海默病等疾病[5-8],而Cys缺乏可能导致生长迟缓、头发脱色、组织水肿、肌肉减少、皮肤和肝脏损伤等相关疾病的出现[9]。因此,对Cys的浓度监测具有重要意义。同时,自然环境如水的pH对维持动植物正常的生命活动具有重要意义[10]。然而,人类生产或生活过程中废水废气等的排放会影响环境pH的变化[11],即使环境pH的微小变化也会破坏动植物生命系统甚至生态系统的平衡[12]。因此,快速、灵敏地检测pH对于保护生物和生态环境是非常必要的。
目前,已经开发出一些方法用于检测Cys的浓度和pH值。如检测Cys的方法有毛细管电泳法[13]、电位滴定法[14]、高效液相色谱法[15]和质谱法[16]等,而检测pH的常见方法有电化学[17]、核磁共振波谱[18]和酸碱滴定[19]等方法。随着光学检测方法的不断发展,磷光检测因为具有较大斯托克斯位移、高化学稳定性和光稳定性以及较长的三重态寿命等优点,在化学传感中得到了广泛的应用[20]。相比于其他磷光金属配合物,Irバ配合物由于具有较高的量子产率、发光颜色可调节以及稳定性好等优点而被认为是最好的磷光传感材料之一[21-23]。在过去的几十年中,Irバ配合物被成功地应用于金属离子[24-25]、氧气[26]、氨基酸[27-28]和pH[29]等物质的检测中,并表现出较高的选择性和灵敏度。如Yu等[30]通过将二甲基吡啶胺基团引入Irバ配合物中实现了对Cu2+的磷光猝灭型检测。Shiu等[31]报道的铱配合物实现了对Cys的增强型检测,Mao等[32]合成的铱配合物可以对活体斑马鱼体内的Cys进行有效识别。然而,目前报道的应用于化学传感领域的铱配合物多数是针对单一分析物的检测,能够同时检测2种或2种以上分析物的磷光铱配合物相对较少。因此,对基于铱配合物的多功能磷光探针的设计和合成具有一定的研究意义。
我们合成了具有[Ir(C^N)2(N^N)]PF6(C^N为环金属配体,N^N为中性配体)结构的2种铱配合物[Ir(L1)2(dbr-bpy)]PF6(Ir1)和[Ir(L2)2(dbr-bpy)]PF6(Ir2)(L1=6-苯基烟醛,L2=6-(4-三氟甲基苯基)吡啶-3-甲醛,dbr-bpy=4,4′-二溴-2,2′-联吡啶)。对这2个铱配合物的光物理性质和电化学性质进行了测定和讨论,研究了它们对Cys和OH-的双向检测性能。
1 实验部分
1.1 试剂和仪器
主要试剂有苯硼酸(AR,购自阿拉丁试剂有限公司)、4-三氟甲基苯硼酸(AR,上海皓鸿生物医药科技有限公司)、6-溴-3-甲醛吡啶(AR,北京百灵威有限公司)、四(三苯基膦)钯(AR,陕西开达化工有限公司)、IrCl3·nH2O(wIr≥54%,昆明铂锐金属材料有限公司)、dbr-bpy(AR,北京伊诺凯科技有限公司)、六氟磷酸钾(AR,阿拉丁试剂有限公司)、2-乙氧基乙醇(AR,北京百灵威科技有限公司)。其他试剂均为市售分析纯,没有经过进一步的提纯。
1H和13C NMR采用Bruker AM 400 MHz核磁共振仪完成。质谱通过ESI-MS(Bruker Scientific Instruments LC-MS)质谱仪进行测定。吸收光谱和发射光谱分别在UV-2700紫外可见分光光度计和Hitachi F-2700荧光光谱仪上测得。磷光寿命是在Edinburgh FLS920P光谱仪上测得并经过拟合处理。循环伏安(CV)实验在CHI 760E电化学工作站上进行,测定时以铂盘电极为工作电极,铂丝电极为对电极,Ag+/Ag为参比电极,使用四丁基六氟磷酸铵(0.10 mol·L-1)为支持电解质,测定过程电压的扫描速度为0.1 V·s-1。采用Gaussian09软件包进行理论计算,利用密度泛函理论(DFT)含时密度泛函理论(TD-DFT)对配合物分子结构进行基态结构优化。计算过程中,铱原子采用LANL2DZ赝势基组,其他原子采用6-31G(d,p)基组。
1.2 配合物的合成
配 体L1、L2和 二 桥 配 合 物[(L1)2Ir(μ-Cl)]2、[(L2)2Ir(μ-Cl)]2按照文献报道方法合成[33-34]。配合物Ir1和Ir2的合成路线如图1所示。
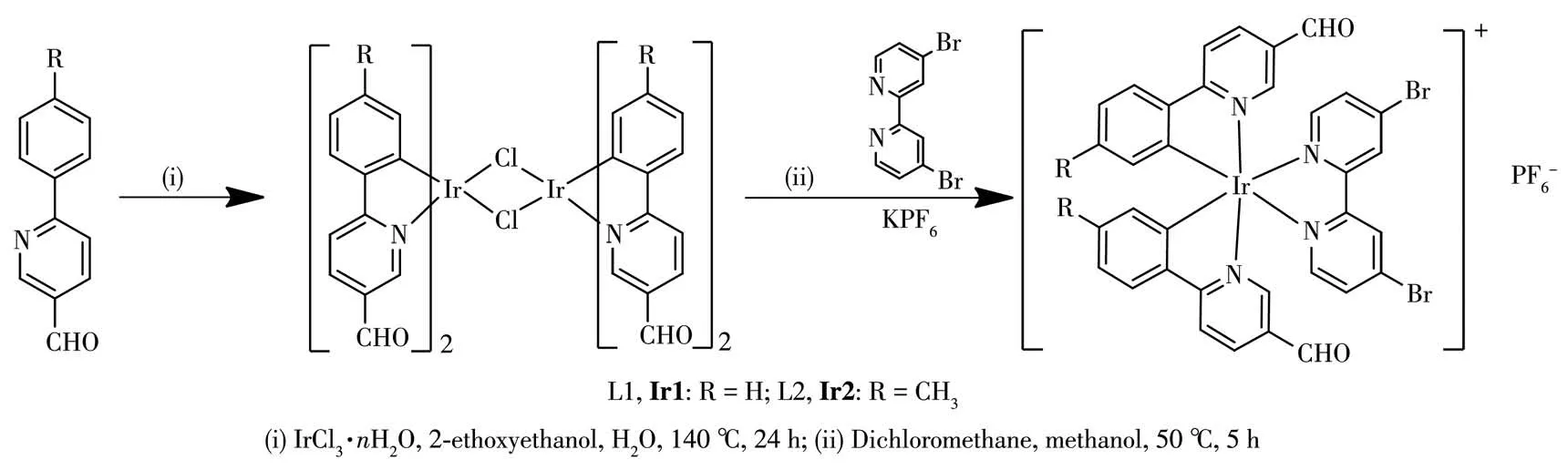
图1 Irバ配合物Ir1和Ir2的合成路线Fig.1 Synthetic routes of Irバcomplexes Ir1 and Ir2
在氮气氛围条件下将0.32 g(0.30 mmol)[(L1)2Ir(μ-Cl)]2、0.09 g(0.60 mmol)dbr-bpy溶解在二氯甲烷和甲醇的混合溶液中,50℃下反应5 h,冷却至室温,加入0.11 g(0.60 mmol)KPF6,室温搅拌1 h,除去溶剂后粗产物用硅胶柱层析分离,洗脱剂为二氯甲烷和甲醇的混合溶剂(10∶1,V/V),得0.31 g配合物Ir1,为深红色固体,产率78%。1H NMR(400 MHz,DMSO-d6):δ9.81(s,2H),9.37(d,J=1.9 Hz,2H),8.46(d,J=8.5 Hz,2H),8.30(dd,J=8.5,1.7 Hz,2H),8.14(d,J=1.4 Hz,2H),8.06~8.00(m,4H),7.66(d,J=5.9 Hz,2H),7.08(t,J=8.0 Hz,2H),6.97(t,J=7.4 Hz,2H),6.26(d,J=7.4 Hz,2H)。13C NMR(101 MHz,DMSO-d6):δ190.68,171.54,156.62,153.21,152.27,151.04,143.13,138.08,136.48,132.68,132.34,131.99,131.46,129.71,127.50,123.49,120.68。IR(KBr,cm-1):3 109(m),1 691(s),1 596(s),1 396(s),1 220(s),827(vs),742(s),555(s)。MS(ESI):m/z=870.978 1[M-PF6]+,[C34H22Br2IrN4O2]+理论值870.971 8。
Ir2的合成过程与Ir1相似,将0.45 g(0.30 mmol)[(L2)2Ir(μ-Cl)]2、0.17 g(0.60 mmol)dbr-bpy和0.11 g(0.60 mmol)KPF6反应后得到0.35 g配合物Ir2,为橙黄色固体,产率60%。1H NMR(400 MHz,DMSO-d6):δ9.86(s,2H),9.40(s,2H),8.65(d,J=8.4 Hz,2H),8.45(d,J=8.4 Hz,2H),8.33~8.24(m,4H),8.05~7.99(m,2H),7.65(d,J=6.0 Hz,2H),7.43(d,J=8.3 Hz,2H),6.37(s,2H)。13C NMR(101 MHz,DMSO-d6):δ190.69,169.52,156.52,153.77,151.46,147.36,138.73,136.83,132.87,132.46,131.17(q,30 Hz),129.87,127.75,127.19,125.46,122.74,122.10,120.71。IR(KBr,cm-1):3 120(m),1 697(s),1 599(s),1 481(s),1 402(s),1 321(vs),1 136(s),852(vs),559(s)。MS(ESI):m/z=1 006.948 6[M-PF6]+,[C36H20Br2F6IrN4O2]+理论值1 006.946 6。
1.3 Cys的检测实验
首先配制浓度为0.50 mmol·L-1的配合物Ir1和Ir2的乙腈溶液,然后配制浓度为0.10 mol·L-1的Cys和其他不同种类氨基酸的水溶液,包括丙氨酸(Ala)、精氨酸(Arg)、天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、组氨酸(His)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、蛋氨酸(Met)、苯丙氨酸(Phe)、丝氨酸(Ser)、苏氨酸(Thr)、色氨酸(Trp)、酪氨酸(Tyr)和缬氨酸(Val)。选择性实验是向铱配合物的溶液中分别加入1.0 mmol·L-1的各种氨基酸溶液,然后测试发射光谱的变化。竞争实验是首先向铱配合物的溶液中分别加入1.0 mmol·L-1的除Cys外的其他氨基酸溶液,测试该混合溶液的发射光谱,然后在上述混合溶液中再分别加入1.0 mmol·L-1的Cys溶液,测试发射光谱的变化。滴定实验是向铱配合物的溶液中逐步加入Cys溶液,使其浓度为0~2.0 mmol·L-1,然后分别测试发射光谱。所有测试溶液都是混合2 min后进行发射光谱的测试。
1.4 OH-检测实验
配制浓度为0.50 mmol·L-1的配合物Ir2的二甲基亚砜(DMSO)溶液作为储备液,将其在DMSO/H2O(7∶3,V/V)溶液中稀释至2.5 μmol·L-1作为使用液。然后配制OH-(NaOH)和其他不同种类阴离子的水溶液,包括Cl-、CO32-、HCO3-、SO42-、SO32-、NO2-、Ac-、HCOO-、Br-、PO43-和HSO3-,所用阴离子均为相应的钠盐或钾盐。选择性实验是向Ir2的溶液中分别加入100 mmol·L-1的各种阴离子溶液,然后测试发射光谱的变化。竞争实验是首先向Ir2的溶液中分别加入除OH-外的其他阴离子溶液,测试混合溶液的发射光谱,然后在上述溶液中再分别加入OH-溶液,测试发射光谱变化。滴定实验是向Ir2的溶液中逐步加入OH-溶液,使其浓度为0~100 mmol·L-1,然后在荧光光谱仪下进行发射光谱的测试。
2 结果与讨论
2.1 配合物的光物理性质
图2所示是配合物Ir1和Ir2在室温条件下、乙腈溶液中的紫外可见吸收光谱和发射光谱,相关的数据列于表1中。图2a表明在250~400 nm范围内,Ir1和Ir2都出现较强的吸收峰,这些吸收可以归属于以配体为中心的自旋允许的π-π*跃迁。在低能量范围(>400 nm)的吸收峰可以归属于金属-配体间的电荷转移跃迁吸收,即MLCT吸收,包括自旋允许的1MLCT和自旋禁阻的3MLCT的混合跃迁吸收[35-37]。在低能量区域,配合物Ir2的吸收峰相比于Ir1的吸收峰蓝移了12 nm,这是配合物中环金属配体结构的不同导致的[38]。铱配合物的最高占据分子轨道(HOMO)主要分布于金属Irバ和环金属配体上(表S1,Supporting information),与Ir1相比,Ir2的环金属配体上引入了强吸电子的CF3基团,造成配合物Ir2的HOMO能级降低,能隙增大,从而使低能量区域的吸收带产生蓝移。
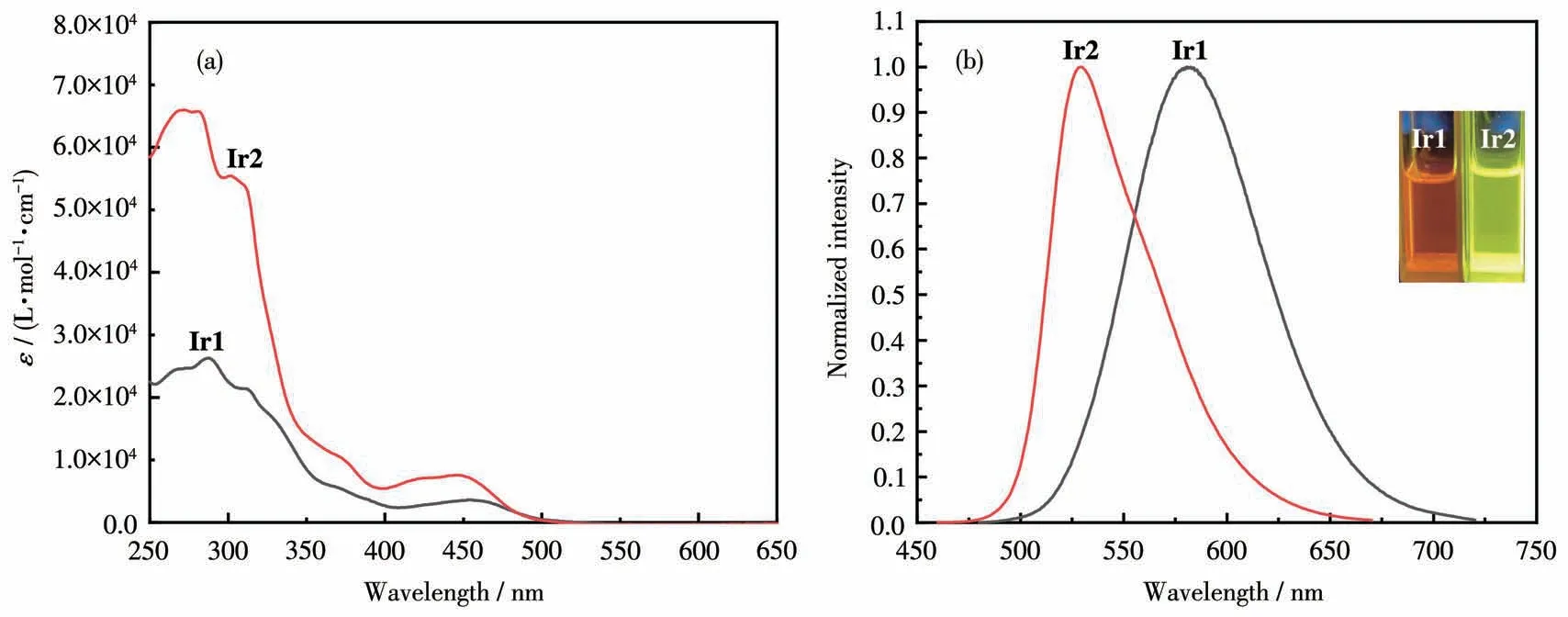
图2 配合物Ir1和Ir2在乙腈溶液(20 μmol·L-1)中的UV-Vis吸收光谱(a)和发射光谱(b)Fig.2 UV-Vis absorption spectra(a)and emission spectra(b)of complexes Ir1 and Ir2 in CH3CN

表1 配合物Ir1和Ir2的光物理和电化学性质Table 1 Photophysical and electrochemical properties of complexes Ir1 and Ir2
图2b为配合物Ir1和Ir2在室温条件下乙腈溶液中的发射光谱图。从图中可以看出Ir1和Ir2的发射光谱表现出典型的宽峰而且无精细结构。配合物Ir1的最大发射峰位于584 nm,为橙红光。配合物Ir2的最大发射峰位于530 nm,为黄光。文献报道的以3-甲基-2-苯基吡啶为环金属配体、以dbr-bpy为中性配体的铱配合物[39]的发射峰位置为630 nm,和这个配合物相比,将醛基引入铱配合物的环金属配体后,Ir1的发射峰位置蓝移了46 nm。在此基础上,在环金属配体的苯环上再引入CF3基团,配合物Ir2的发射峰又蓝移了54 nm。这说明在铱配合物的环金属配体中引入吸电子的醛基和三氟甲基基团后,可以使HOMO能级降低,配合物的能隙差增大,发射光谱蓝移。量子效率和寿命是用来衡量磷光材料光物理性质的重要参数,以fac-Ir(ppy)3作为参比物质,利用配合物在乙腈溶液中的紫外可见吸收光谱和发射光谱计算得到了配合物Ir1和Ir2的发光量子效率,分别为49%和66%(表1)。在MLCT激发和最大发射波长处监测,测定了Ir1和Ir2在乙腈溶液中的激发态寿命,分别为1.6和3.3 μs,处于微秒级别。以上结果表明这2种配合物是典型的磷光发光材料。
2.2 电化学性质和理论计算
采用CV法研究了配合物Ir1和Ir2的电化学性能,CV曲线如图3所示,相关电化学数据列于表1。在阳极氧化过程中,配合物Ir1和Ir2在1.00~1.60 V(vs Ag+/Ag)范围内均表现出可逆的氧化还原峰,这可以归因于以金属为中心的Irバ/Irビ的氧化还原。Ir1和Ir2的氧化电位分别为1.08和1.33 V。和Ir1相比,Ir2的氧化电位正向移动了0.25 V,这表明Ir2的环金属配体中CF3的引入使HOMO能级降低,配合物更难从HOMO轨道失去电子,故氧化电位增大。
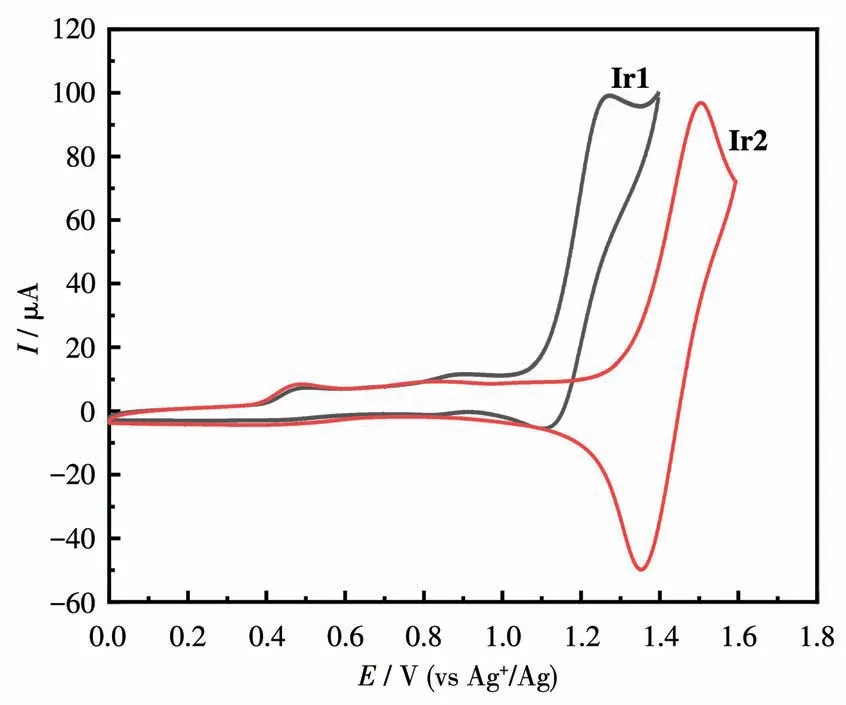
图3 室温下配合物Ir1和Ir2在CH2Cl2/CH3CN(1∶1,V/V)溶液中的CV曲线Fig.3 CV curves of complexes Ir1 and Ir2 in CH2Cl2/CH3CN(1∶1,V/V)solution at room temperature
利用DFT和TD-DFT对配合物Ir1和Ir2进行了理论计算,其前线分子轨道的电子云分布图及相应轨道能级见图4,HOMO和LUMO(最低未占分子轨道)的构成和主要的电子跃迁位置及性质分别列于表S1~S3。由图4可见,配合物Ir1和Ir2的LUMO主要分布在中性配体(84.58%~92.66%)上,少量分布于环金属配体(4.22%~15.43%)和铱原子的d轨道(2.54%~3.12%)上。HOMO主要位于环金属配体(48.31%~50.00%)和 铱 原 子 的d轨 道(46.34%~48.11%)上,少量位于中性配体(3.58%~3.67%)上,HOMO和LUMO的电子云分布规律和文献报道的多数铱配合物的前线分子轨道的组成一致[40]。根据理论计算,配合物Ir1和Ir2的LUMO能级非常接近,分别为-3.03和-3.10 eV,这与它们有相同的中性配体有关。配合物Ir1和Ir2的HOMO能级分别为-6.11和-6.38 eV,说明吸电子基团CF3的引入可以有效地稳定HOMO能级,从而扩大HOMO和LUMO之间的能隙差,这与Ir2具有较高的氧化电位一致,也与紫外可见吸收光谱在低能量区的光谱移动规律相吻合。
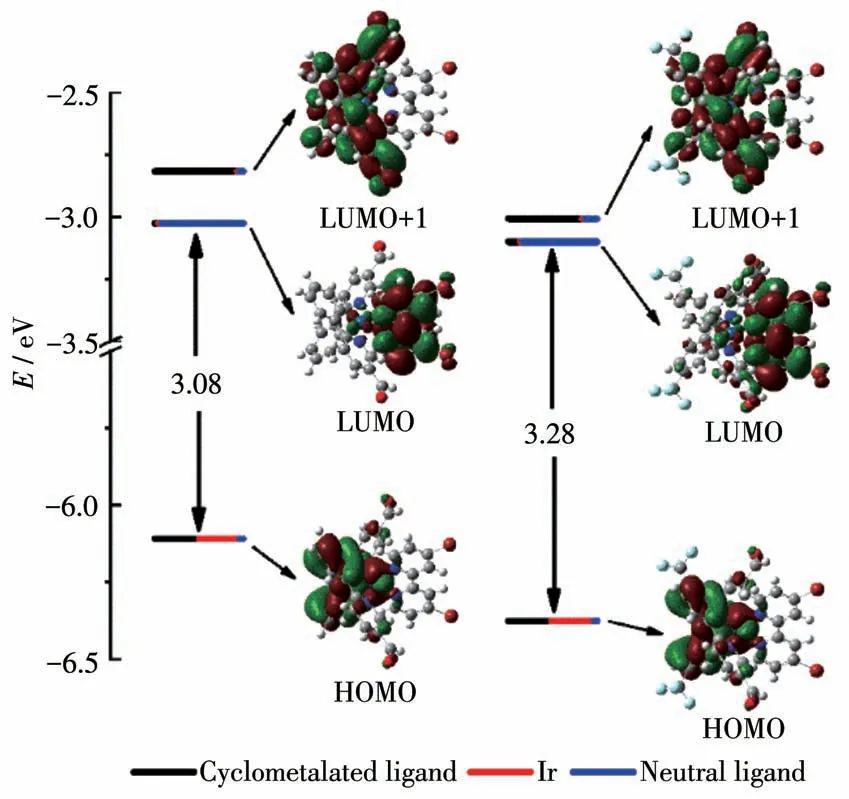
图4 DFT方法计算得到的配合物Ir1和Ir2的前线分子轨道图以及环金属配体(黑线)、铱原子(红线)和中性配体(蓝线)在分子轨道中的组成比例Fig.4 Frontier molecular orbital diagrams of complexes Ir1 and Ir2 calculated by the DFT method and the composition ratio of cyclometalated ligand(black line),iridium atom(red line),and neutral ligand(blue line)in molecular orbitals
2.3 铱配合物对Cys的检测性能
对性能优异的磷光传感材料来说,高选择性是必要的。为了研究配合物Ir1和Ir2对Cys的检测性能,在Ir1和Ir2的乙腈溶液(0.5 mmol·L-1)中分别加入1.0 mmol·L-1的氨基酸(Cys、Ala、Arg、Asp、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Ser、Thr、Trp、Tyr和Val),测定了配合物在不同氨基酸存在下的磷光光谱的响应变化。如图S7a所示,在Ir1的溶液中加入Cys后,Ir1的光致发光显著猝灭,发射峰强度降低了近82%,而加入其他氨基酸时,Ir1的发光强度变化很小。从图S7b可以看出,配合物Ir2也得到类似的结果,加入Cys后发射峰强度降低了近87%。以上结果表明,配合物Ir1和Ir2对Cys具有较高的选择性,可作为对Cys的猝灭型磷光分子探针。
抗干扰能力对于磷光传感材料也是十分重要的。通过竞争实验研究了共存氨基酸(Ala、Arg、Asp、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Ser、Thr、Trp、Tyr和Val)对Cys测定的影响,结果如图5所示。在其他竞争性氨基酸存在的条件下,配合物Ir1和Ir2仍然可以实现对Cys的识别,并且受到竞争性氨基酸的影响较小。结果表明,配合物Ir1和Ir2对Cys的检测具有较强的抗干扰能力。
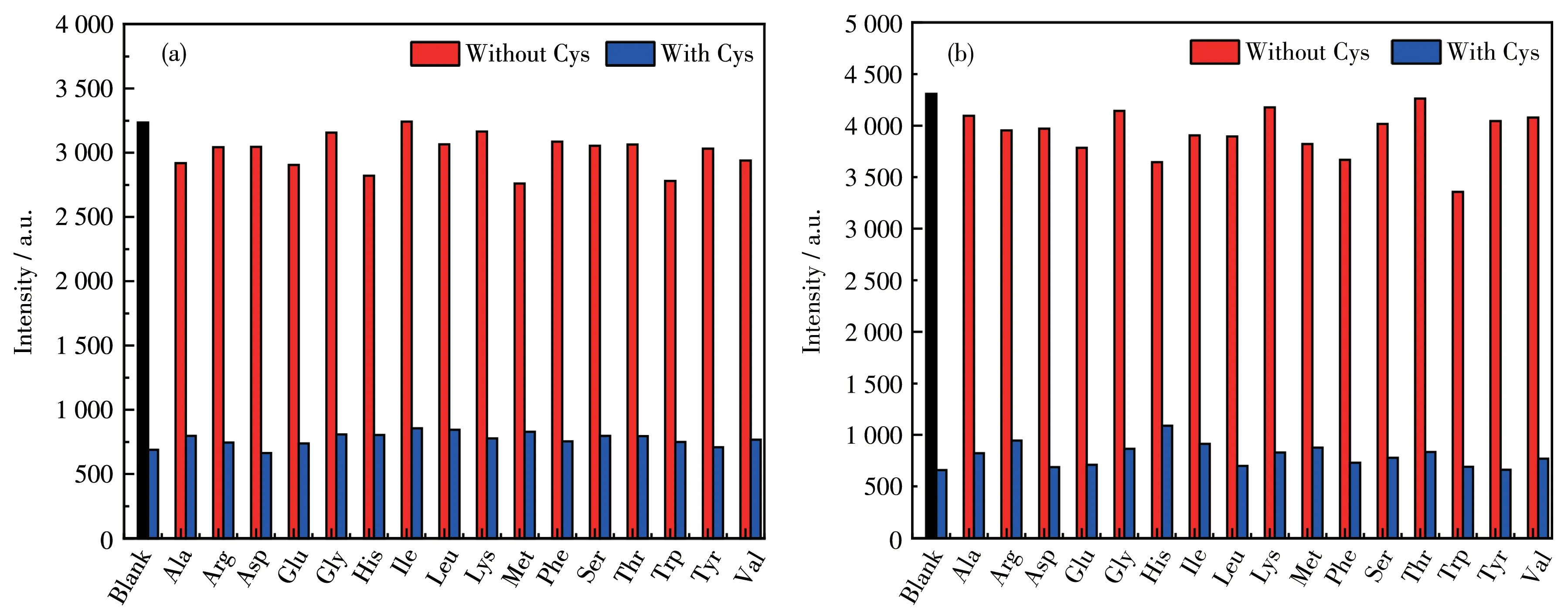
图5 在各种氨基酸不存在和存在下配合物Ir1(a)和Ir2(b)的磷光响应Fig.5 Phosphorescence response of complexes Ir1(a)and Ir2(b)in the absence and presence of various amino acids
为了进一步考察配合物Ir1和Ir2对Cys的检测性能,研究了在配合物Ir1和Ir2的乙腈溶液中逐步加入不同浓度的Cys后的发射光谱,从而分析配合物的发光强度与Cys的浓度之间的线性关系。如图6a所示,在配合物Ir1的溶液中逐步滴加Cys后,发光强度逐渐减小,直至加入1.0 mmol·L-1的Cys后发光强度保持不变。在Cys浓度为0~1.0 mmol·L-1范围内,Ir1在584 nm处的发光强度随Cys浓度的变化曲线呈现良好的线性关系(图6a插图),且Ir1与Cys的结合比约为1∶2。同样,通过磷光发射光谱的强度变化,进行了Ir2与Cys的滴定实验,结果如图6b所示。在Ir2的乙腈溶液中逐渐加入Cys时,Ir2在530 nm处的发光强度不断降低,直到加入1.0 mmol·L-1的Cys后发光强度基本保持不变。通过公式LOD=3σ/k[41]计算出配合物Ir1和Ir2对Cys进行选择性识别的检出限(LOD)分别为35.1和18.5 μmol·L-1,公式中σ为空白测量的标准偏差,k为配合物发光强度随Cys浓度的变化曲线的斜率。根据文献[42-43],配合物Ir1和Ir2选择性识别Cys可能的机理如图7所示,Irバ配合物中的醛基可与β-氨基硫醇类化合物反应,生成具有噻唑烷结构的化合物,从而改变铱バ配合物激发态性质,使配合物的发光强度显著降低。
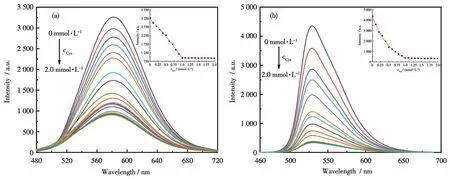
图6 在配合物的乙腈溶液中逐渐加入不同浓度Cys后的发射光谱变化Fig.6 Changes in the emission spectra of the complexes in acetonitrile solution with various concentrations of Cys
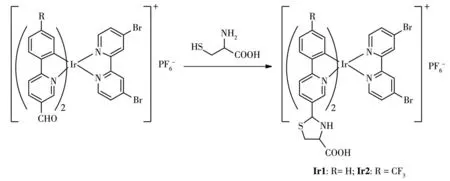
图7 配合物Ir1/Ir2与Cys结合的可能机制Fig.7 Possible mechanism of the combination of Ir1/Ir2 with Cys
2.4 配合物Ir2在OH-检测中的应用
以配合物Ir2为例,研究了铱配合物在OH-检测中的应用。首先通过时程实验研究了Ir2对OH-的响应时间,结果如图S8所示。在加入OH-(100 mmol·L-1)后的360 min内,配合物Ir2的发光强度随着时间增加而逐渐增强,发射峰位置从550 nm蓝移到506 nm,在360~480 min的时间范围内,配合物的发光强度不再发生明显变化。因此,配合物Ir2检测OH-的稳定时间为360 min,以下实验均采用360 min的反应时间。
为了获得最佳的传感性能,我们测试了DMSO/H2O溶剂中不同H2O体积分数下配合物Ir2对OH-的检测性能,结果如图8a所示。当DMSO中H2O的含量为30%时,在配合物Ir2的溶液中加入100 mmol·L-1的OH-后,显示出最高的发射峰强度。和纯DMSO溶剂条件下的发射光谱相比,H2O的含量为30%时的光谱发生明显蓝移(14 nm),发光颜色由黄绿色变为绿色。随着H2O比例的进一步升高,Ir2的发光强度逐渐减弱,这种现象也可以在紫外光(365 nm)照射下用肉眼观察到(图S9)。
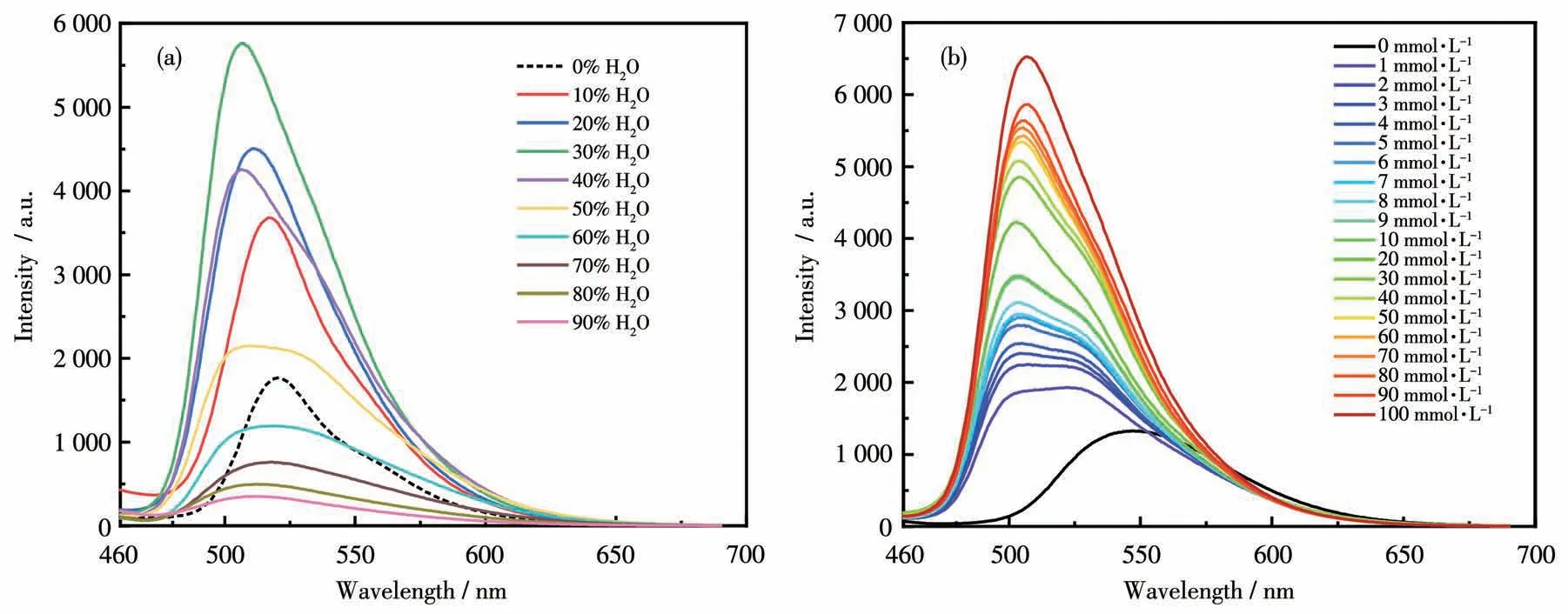
图8 (a)DMSO/H2O溶剂中不同H2O体积分数下,在配合物Ir2的溶液中加入OH-(100 mmol·L-1)后的发射光谱;(b)在配合物Ir2的DMSO/H2O(7∶3,V/V)溶液中,逐渐加入不同浓度OH-后的发射光谱Fig.8(a)Emission spectra of Ir2 with OH-(100 mmol·L-1)added in a system containing different volume fractions of H2O in DMSO;(b)Emission spectra of Ir2 upon the increasing concentration of OH-in DMSO/H2O(7∶3,V/V)
在优化溶剂条件后,进一步研究了配合物Ir2在DMSO/H2O(7∶3,V/V)中对不同浓度OH-的检测效果,结果如图8b所示。在配合物Ir2的溶液中逐渐加入不同浓度的OH-(0~100 mmol·L-1)后,配合物的发射峰强度逐渐增强,当OH-的浓度达到100 mmol·L-1时,配合物的发光强度增强至原来的5倍。同时,随着OH-浓度的增大,配合物的发射峰位置从550 nm蓝移到506 nm。在0~100 mmol·L-1的OH-浓度范围内,OH-浓度和配合物的发光强度成正比,计算得到Ir2对OH-的LOD为0.396 mmol·L-1,表明配合物Ir2对OH-的检测具有较高的灵敏度。根据加入的OH-的物质的量和溶液的体积计算得到了溶液的pH,不同pH下的发光照片如图S10所示。当溶液为中性时,配合物为橙黄光,随着pH的逐渐增大,溶液发光由橙黄色逐渐变为绿色。配合物Ir2对OH-检测的选择性和竞争性实验结果如图S11所示,在加入其他阴离子后,配合物Ir2的发射光谱强度均无明显增强。而在配合物Ir2和其他阴离子的混合溶液中再加入100 mmol·L-1的OH-后,Ir2的发光强度仍能增强至原来的5倍以上,这表明Ir2对OH-的检测有较强的抗干扰能力。配合物Ir2对OH-识别的可能机理:通过亲核取代反应,OH-取代了配合物Ir2的中性配体dbr-bpy中的溴取代基,从而形成了中性配体含有羟基的新的配合物(图S12)[39],中性配体上吸电子的溴取代基被供电子能力较强的羟基取代后,会使LUMO能级升高,从而使发射光谱蓝移。
3 结论
以4,4′-二溴-2,2′-联吡啶为中性配体,合成了2种含醛基的Irバ配合物Ir1和Ir2。在光激发下,配合物Ir1和Ir2在乙腈溶液中的发射峰分别位于584和530 nm,发光颜色分别为橙红光和黄光。配合物Ir1和Ir2在无氧乙腈溶液中的量子效率分别为49%和66%。2种配合物对Cys的加入表现出快速的猝灭型磷光响应,与Cys的结合比为1∶2,而且对Cys的检测具有良好的选择性,最低检测限达到18.5 μmol·L-1。同时配合物Ir2对OH-有良好的识别性能,可以作为增强型的磷光探针应用在OH-的检测中。本文的研究为设计基于铱配合物的多功能磷光探针提供了思路。
Supporting information is available at http://www.wjhxxb.cn

