钴取代的链状Strandberg结构磷钼酸盐的合成及其对Aβ错误折叠聚集过程的调节
滑继爱卫雪曼张 娜陈鹏举马 翔*,,4
(1太原工业学院化学与化工系,太原030008)
(2海军军医大学第一附属医院老年病科,上海200081)
(3太原工业学院生化药学实验室,太原030008)
(4南京大学配位化学国家重点实验室,南京210023)
0 引言
阿尔茨海默病(Alzheimer′s disease,AD)作为蛋白错误折叠类疾病中最为典型的代表[1],近年来逐渐成为生物无机化学与药物化学研究的热点领域[2]。由淀粉样蛋白(Aβ)错误折叠聚集而形成的老年斑是AD主要的病理特征[3-4]。处于非β折叠构象状态的Aβ是大脑内一种正常代谢的膜蛋白,能够参与特定的生理活动[5-6]。然而,当处于病理状态时,例如脑内存在错误折叠的Aβ模板或者金属离子处于紊乱状态,Aβ可以转化成为具有极强神经毒性的富含β错误折叠的聚集体[7-10]。此外,新生的金属-Aβ蛋白复合物能够催化产生大量的活性氧物种(ROS),而ROS也被认为是造成神经元损伤的重要诱导物质[2,10-11]。因此,抑制Aβ的错误折叠聚集过程以及消除ROS被认为是治疗AD的关键。
据报道,Aβ错误折叠聚集体的形成途径是可以被调节的[12],其中小分子化合物(如dopamine、calmidazolium chloride以及铂类配合物等)可以抑制Aβ的纤维化[13-16]。近来,多金属氧酸盐(POMs)被发现可以用来抑制蛋白的错误折叠。曲晓刚教授课题组报道了一系列基于Dawson结构的Aβ聚集抑制剂[17-19]。刘杰教授也利用纳米级的钼簇成功干预了Aβ的聚集过程[20]。我们设计了一种有机无机杂化的基于Keggin结构的POM,其可以通过氢键等非共价作用力调控Aβ聚集体的β错误折叠构象,进而使聚集体瓦解[21]。然而,迄今为止,上述设计的POMs都是单功能调节剂,没有直接的抗氧化作用。药物化学最新观点认为,之所以用单靶点药物治疗AD这种多病因疾病难以取得理想的疗效,是因为疾病的多因子特点和细胞补偿机制使单靶点作用不足以促成发病系统的复原[22]。因此,复合Aβ构象调节能力和抗氧化功能的分子可能会更有效地应对这些棘手的问题。
在本文中,我们将介绍一例新设计、合成的一维线状纳米尺度的钴取代磷钼酸盐化合物(H2en)6{[Co(H2O)4](P2Mo5O23)}3·11H2O(简 称CoPM,en=乙 二胺)。据我们所知,CoPM是第一例纯无机的一维链状钴取代的Strandberg结构POM,其内部还存在有趣的循环链节。CoPM能够破坏Aβ聚集体的β折叠构象,并且还能够消除其产生的ROS。作为概念的验证,多功能分子CoPM为治疗AD提供了一种新的思路和方法,具有较大的潜在应用价值和理论研究意义。
1 实验部分
1.1 试剂
所用的试剂均为分析纯试剂,购买后直接使用。氯化钠(NaCl)、盐酸(HCl)、醋酸锌(Zn(OAc)2)、氯化铜(CuCl2)、氯化钴(CoCl2)、十二水合磷酸氢钠(Na2HPO4·12H2O)、en(C2H8N2)、二 水 合 钼 酸 钠(NaMoO4·2H2O)、人Aβ40购自麦克林化学试剂公司(中国)。硫黄素T(ThT)、2′,7′-二氯荧光素二乙酸酯(DCFH-DA)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、神经生长因子7S(NGF-7S)和三羟甲基氨基甲烷(Tris)购自Sigma-Aldrich试剂公司(美国)。Aβ40、Zn(OAc)2和CuCl2的储备溶液按照文献报道的程序进行配制[16]。所有溶液均通过Milli-Q超纯水制备系统所制备的超纯水配制,并通过0.22 μm过滤器(微孔隙)过滤。神经元嗜铬细胞瘤细胞(PC12细胞)来源于American Type Culture Collection(ATCC)。
1.2 合成
首先,分别制备了2种溶液A和B。溶液A:NaMoO4·2H2O(2.416 g,10.00 mmol)和Na2HPO4·12H2O(2.399 g,6.70 mmol)在搅拌下溶解在水(30 mL)中。溶 液B:CoCl2(1.300 g,10.00 mmol)和en(0.10 mL,1.49 mmol)在搅拌下溶解在水(30 mL)中。搅拌10 min后,将得到的溶液B加入到溶液A中,于室温下再搅拌10 min,然后使用HCl(6 mol·L-1)调节pH=5.0。所得混合液在95℃下回流1 h,而后热过滤。所得滤液置于室温下敞口挥发。1周后,有无色透明晶体从溶液中析出,表征其结构为Strandberg结构化合物H6P2Mo5O23[23]。然后使用塑料薄膜密封烧杯,以防止溶液进一步挥发。大约3周后,无色透明晶体转化为粉红色晶体,晶体照片见图S1插图(Supporting information),产率基于Na2MoO4·2H2O计算,约为25%。元素分析(C12H106Co3Mo15N12O92P6)理论值(%):C 3.90,N 4.55,H 2.89;测试值(%):C 3.85,N 4.48,H 2.77。
1.3 实验方法
1.3.1 X射线衍射数据的收集与结构精修
衍射数据于296 K下,在Bruker Apex-2衍射仪CCD探测器上收集,使用MoKα射线(λ=0.071 073 nm)。使用SAINT方法进行数据运算[24]。采用了常规的洛伦兹修正和偏振校正。使用SADABS法进行多扫描吸收校正[25]。该结构采用直接方法求解,并在F2上使用全矩阵最小二乘进行细化。剩下的原子是在F2上连续的全矩阵最小二乘细化得到的并经傅里叶合成。所有计算均使用SHELXL-97程序包运行[26]。CoPM的单晶和结构精修数据在表1中展示。
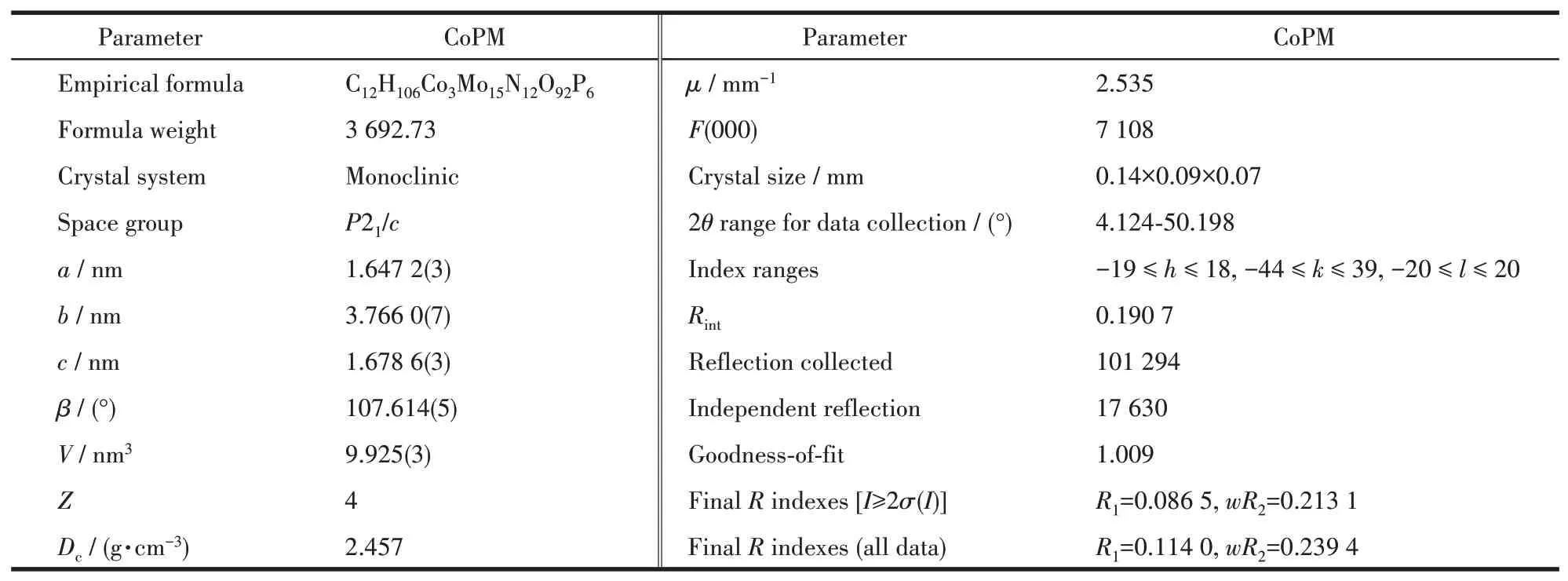
表1 CoPM的单晶和结构精修数据Table 1 Crystallographic and structural refinements data for CoPM
CCDC:1944799。
1.3.2 常规表征
红外光谱使用KBr压片在NICOLET iS10红外光谱仪上4 000~400 cm-1范围内扫描。元素分析由PQEXCeⅡICP-MS进行。热重分析(TGA)在STA449F3 TG-DSC分析仪上进行。将含有或不含CoPM(200 μmol·L-1)的Aβ40(200 μmol·L-1)、D2O/H2O/DMSO-d6混合液(10∶85∶5,V/V)于37℃孵育24 h,离心得到上清液。上清液的1H NMR谱由Bruker DRX-600核磁共振谱仪测试。
1.3.3 生化实验
ThT荧光法:将Aβ40(20 μmol·L-1)溶解在Tris缓冲液(20 mmol·L-1Tris-HCl+150 mmol·L-1NaCl,990 μL)中并与Zn(OAc)2(4 μL,10 mmol·L-1)混合。然后分别加入CoPM(最终浓度为0~25 μmol·L-1),并在37℃水溶液中孵育24 h。每个样品(300 μL)被分别注入到96孔黑色板(康宁Costar公司)的一个孔中。每个孔同时加入ThT溶液(2 μL,5 mmol·L-1),并在37℃再孵育1 h。荧光强度(λex=415 nm,λem=485 nm)由Varioskan Flash microplate reader(Thermo Scientific)记录。数据由至少3个独立实验的平均值±标准差表示。
比浊度法:样品的制备方法如上所述。每个样品都被注入一个96孔透明板(康宁Costar公司)的孔中。记录位于405 nm处的吸光度来反映溶液的浊度。数据以3个独立实验的平均值±标准差表示。
形态学分析:样品的制备方法与ThT荧光法相同。在室温下,在300目的碳涂层铜网上滴加1滴样品溶液(10 μL)。2 min后,除去多余的溶液,并使用醋酸铀酰(10 μL,0.01 g·mL-1)染色,然后用二次水(10 μL)洗涤。样品在JEOL JEM-2100 LaB6(HR)透射电子显微镜(TEM)上进行观测(100 kV)。
圆二色谱(CD)法:将Aβ40(20 μmol·L-1)溶解在Tris缓冲液中,并分别加入Zn(OAc)2或者CuCl2(40 μmol·L-1)。然后将CoPM(20 μmol·L-1)加入上述溶液中,在37℃下孵育24 h。样品溶液的CD光谱在
JASCO J-810 automatic recording spectropolarimeter(日本东京)上测量,测量范围为190~260 nm。以Tris缓冲溶液的结果为阴性对照。
ROS抑制实验:DCFH-DA储备液(1 mmol·L-1)和辣根过氧化物酶(HRP,4 μmol·L-1)用Tris缓冲液按照文献方法制备[27]。将含有Aβ40(20 μmol·L-1)的溶液 与CuCl2(40 μmol·L-1)混 合,并 加 入CoPM(20 μmol·L-1)。然后,在样品中加入抗坏血酸溶液(10 μmol·L-1),并于37℃下孵育10 min。将以上样品(200 μL)注入到96孔黑色板的一个孔中。然后将HRP(0.04 μmol·L-1)和DCFH-DA(100 μmol·L-1)注入孔中,并在37℃下避光孵育。荧光强度(λex=485 nm,λex=650 nm)由Varioskan Flash microplate reader(Thermo Scientific)从0到2 400 min每隔10 min测量1次。其他实验对照组均按上述方法进行分析。
MTT法:用于测试神经毒性和突触功能障碍的PC12细胞如文献方法进行培养[28]。分化成熟的PC12细胞与Aβ40(20 μmol·L-1)以及CoPM(20 μmol·L-1)共孵育24 h,而后采用MTT法评价CoPM对Aβ聚集体神经毒性的抑制性效果。其他对比组均按上述方法进行分析。数据以至少3个独立实验的平均值±标准差表示。
细胞形态学分析:用于此形态学分析的PC12细胞如上所述制备。培养24 h后,用荧光倒置显微镜捕捉这些细胞的形态学照片。
统计分析方法:结果来自3个独立的实验,并以独立实验的平均值±标准差表示。结果采用双倍方差分析(*p≤0.05,**p≤0.01,***p≤0.001)进行比较。
2 结果与讨论
2.1 晶体结构
通过X射线单晶衍射对CoPM的结构进行表征分析,其键长数据见表S1。如图1a所示,X射线单晶衍射结构分析显示,CoPM是由Strandberg结构的磷钼氧簇[P2Mo5O23]6-和钴配合物[Co(H2O)4]2+交替连接而形成。有趣的是,CoPM并不是一个简单的一维链化合物,事实上,如图1b和1c所示,CoPM链的每个循环单元包含3个{[Co(H2O)4](P2Mo5O23)}4-最小结构单位,这些结构单位各自的延展方向与配位环境均不相同(见键价和(BVS)计算部分),这在POM化学中是非常少见的。如图1d所示,[P2Mo5O23]6-簇可以被认为是一个由5个接近共平面的{MoO6}八面体(Mo—O:0.169 0(9)~0.251 1(9)nm)通过共角/共边而形成的扭曲的褶环,褶环中心上各配位了一个{PO4}四面体(P—O:0.149 3(9)~0.157 7(9)nm)。如图1e所示,[Co(H2O)4]2+作为一个连接体通过与2个相邻的[P2Mo5O23]6-极点位置上的P配位而形成一维无限延展结构。据我们所知,CoPM是第一例纯无机一维钴取代Strandberg型多聚磷钼酸盐。CoPM的红外谱图及热重分析图见图S1和S2。
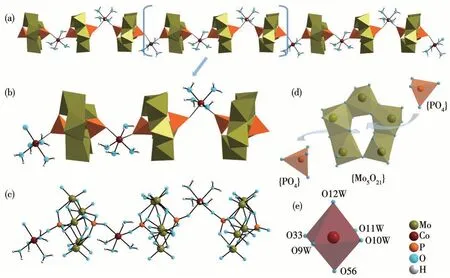
图1 (a)CoPM的一维链状结构多面体示意图;(b)CoPM最小循环单元多面体结构示意图;(c)CoPM最小循环单元球棍结构示意图;(d)[P2Mo5O23]6-多面体结构示意图;(e)CoPM中钴离子的配位环境示意图Fig.1(a)Combined polyhedral/ball-and-stick view of the 1D linear structure of CoPM;(b)Polyhedral view of one CoPM subunit in the crystal;(c)Ball-and-stick representation of one CoPM subunit in the crystal;(d)Polyhedral view of one[P2Mo5O23]6-;(e)Polyhedral view of the coordination mode of Co ions in CoPM
根据文献报道的方法,我们进一步计算了CoPM中Co和P的氧化态(Vi)[29]。简单地说,CoPM中阳离子i的氧化态计算公式如下:
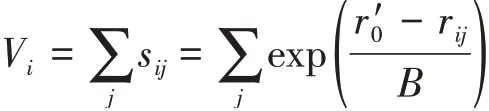
其中sij表示阳离子i和阴离子j之间的键价,rij表示表S1中列出的实测键长,而r0′则表示2个离子间键长的理论值,B设定为0.37[29]。Mo—O键长的理论值来自于文献,其中的r0′(Mo6+—O)和r0′(Mo5+—O)分别为0.191 5和0.184 8 nm,r0′(P5+—O)为0.162 4 nm,r0′(Co2+—O)为0.169 2 nm[29-30]。如表S2所示,CoPM中Co和P的Vi分别为2.019和4.955。此外,每个Strandberg结构磷钼氧簇由一个Mo5+和4个Mo6+构成。
目前,基于POMs的不同结构,其与Aβ相互作用的分子作用机制可概括为2种类型:第1类即通过POMs上的过渡金属离子(例如钴离子[18]、镉离子[31])与Aβ上咪唑基团直接发生配位作用,进而影响Aβ的聚集。第2类即POMs通过其富氧表面[21]或静电作用[20,32]干预构成β折叠所必需的Aβ之间氢键的形成,进而影响其聚集过程。CoPM的分子设计同时满足上述2种作用模式所需的结构基础。
首先,CoPM的链节中含有大量钴离子,这些钴离子与构筑块上的2个氧原子及4个配位水形成较为稳定的六配位八面体构型。当与咪唑基相遇时,根据软硬酸碱理论可知,配位能力稍弱的水分子会被咪唑基团取代,从而使得钴离子与Aβ形成更稳定的配合物[18]。因此,我们使用核磁共振谱研究了CoPM孵育后Aβ聚集体的咪唑基信号。如图2a所示,位于δ=6.8、7.5和8.0处的几组峰对应于Aβ上咪唑残基的3个氢的核磁信号[16]。然而,如图2b所示,在与CoPM共孵育后,1H NMR信号发生了很大的变化,这表明Aβ上的咪唑基团的化学环境受到了较大的影响,尤其是3号位的氢几乎消失,说明CoPM与Aβ间存在配位作用。
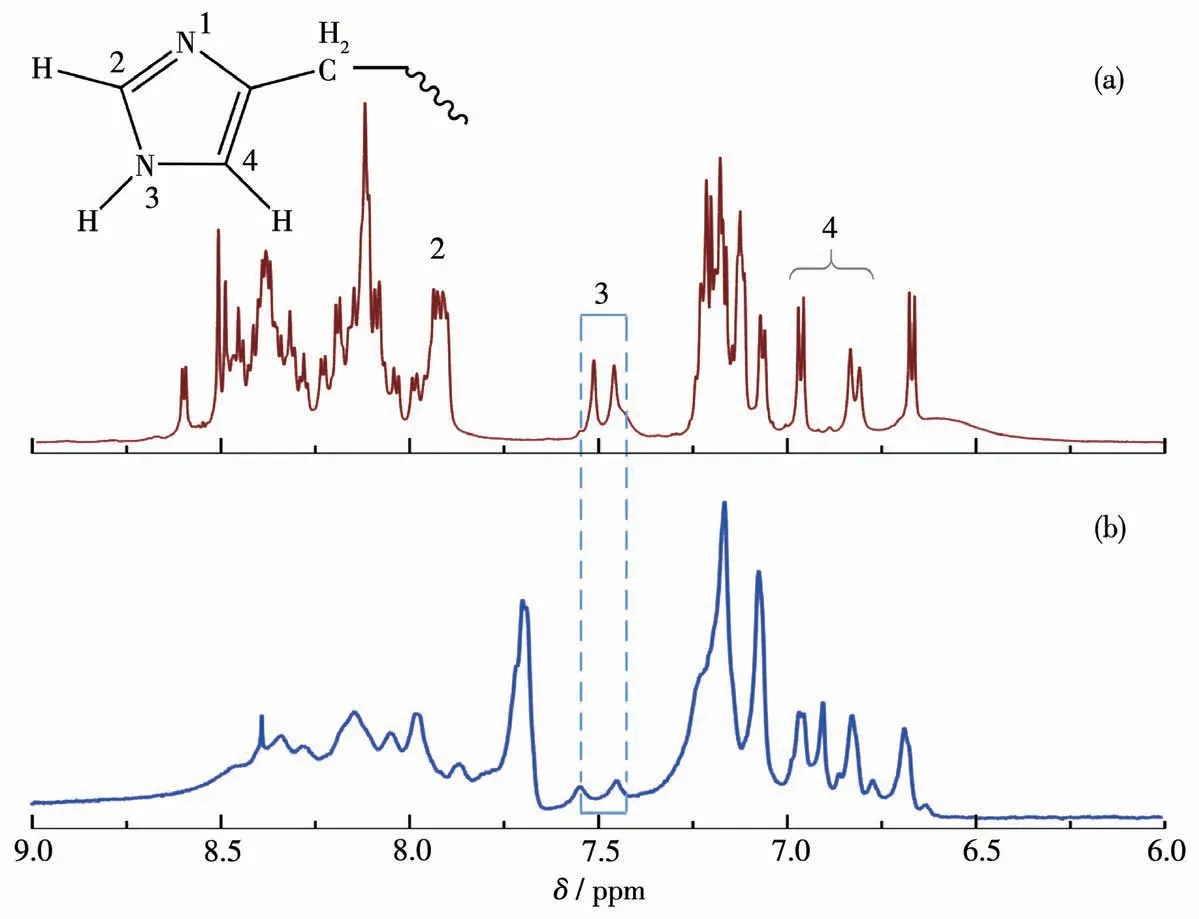
图2 Aβ40(a)及其与CoPM在37℃和pH 7.4条件下共孵育(b)24 h后的1H NMR谱图Fig.2 1H NMR spectra of Aβ40 in the absence(a)and presence(b)of CoPM after incubation at 37℃and pH 7.4 for 24 h
其次,作为纯无机POMs,CoPM的构筑块具有很高的负电荷和丰富的表面氧原子[33]。CoPM中的70个氧原子可分为端氧Ot、二重桥氧Oμ2、三重桥氧Oμ3和四重桥氧Oμ4。如图3所示,BVS为0~1.60之间的O原子可以作为质子供体;而BVS为1.90~2.00之间的O原子具有比较密集的电子云,可以作为质子的受体。因此,CoPM表面的O原子可以与其他质子供体或者受体(例如蛋白等)相互作用形成氢键。一般来说,POMs构筑块上会有离域的质子附着,这种现象在POM化学中很常见,在许多文献中均有报道,例如[H3W12O40]5-[33]和[Ni(enMe)2]3[H6Ni20P4W34(OH)4O136(enMe)8(H2O)6]·12H2O[34]。
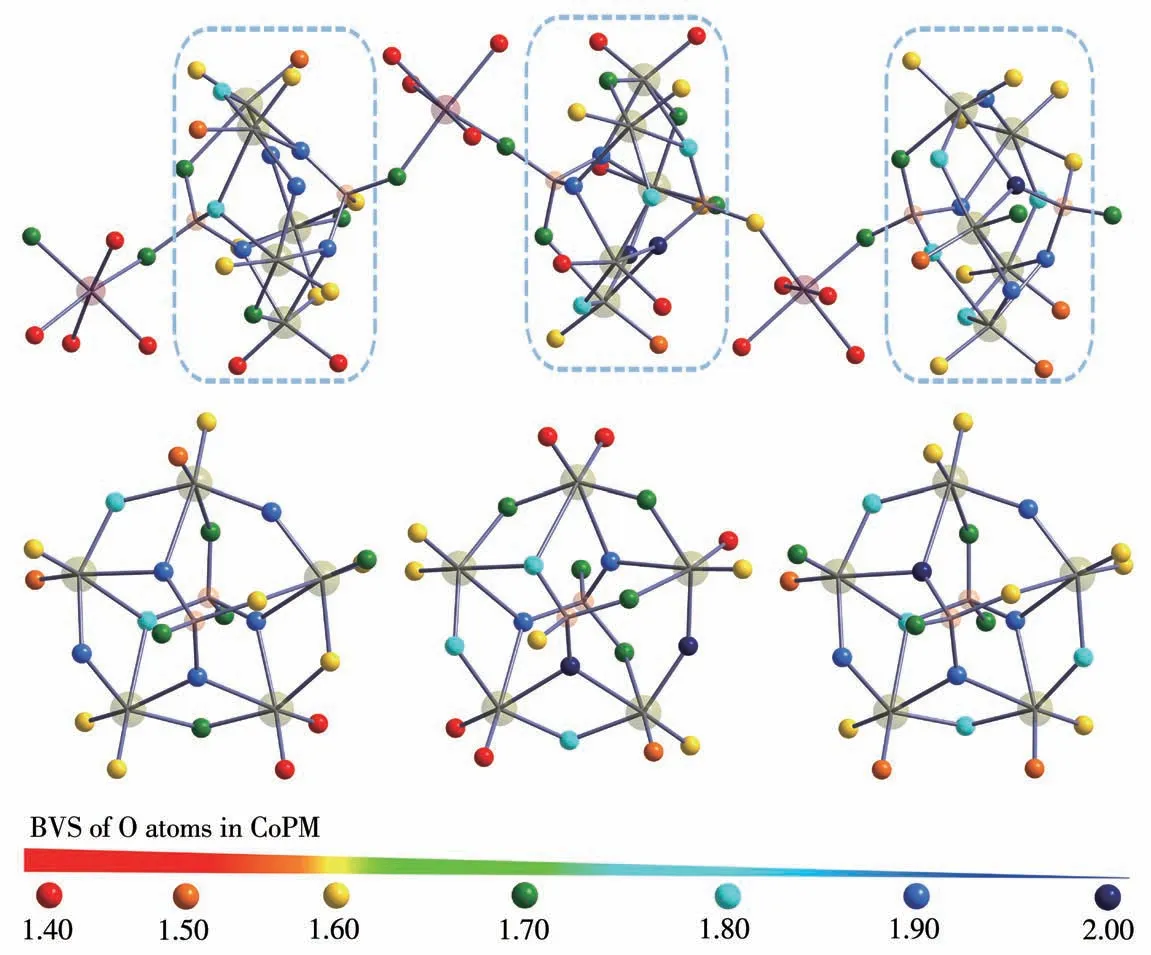
图3 CoPM最小重复单元中O的BVSFig.3 BVS of O atoms in the CoPM unit
此外,CoPM的BVS计算也表明,其最小重复单元内的3个基本单元所处的配位环境均不相同,有着不同的BVS。
2.2 Aβ错误折叠的抑制作用
由于Zn2+可以有效地诱导Aβ错误折叠聚集过程,因此,我们通过比浊度法和ThT荧光法研究CoPM对Zn2+诱导的Aβ的β折叠形成的抑制作用。浊度可反映溶液中所有类型蛋白聚集体的整体水平;ThT荧光法被广泛用于检测这些聚集体中的β折叠体的含量[35]。首先,Aβ与Zn2+共孵育而获得富含各种聚集体的悬浊液。然后,在这些悬浊液中加入不同浓度的CoPM,孵育1 d,以测试其对已形成的β折叠构象的影响。如图4所示,随着CoPM浓度的增加,ThT荧光急剧下降,这表明Aβ的错误折叠聚集过程被逆转了。另一方面,这些溶液的浊度也在某种程度上随着CoPM的加入而降低。考虑到CoPM对β折叠聚集体的综合影响,我们选择20 μmol·L-1进行后面的实验。
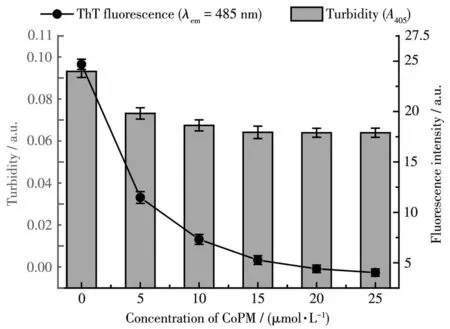
图4 一系列浓度梯度的CoPM对Zn2+诱导的Aβ40错误折叠聚集体的干预效果:比浊法(左,柱状图)和ThT荧光法(右,线状图,λex=415 nm,λem=480 nm)Fig.4 Intervention effect of a series of concentration gradients of CoPM on Zn2+-induced Aβ40 misfolded aggregates:turbidimetry(left,histogram)and ThT assay(right,line graph,λex=415 nm,λem=480 nm)
2.3 形态学分析
接下来,我们使用TEM观察CoPM对Zn2+、Cu2+以及自聚集诱导的Aβ错误折叠聚集体微观形态的影响。如图5a~5c所示,在各种诱导因素存在的情况下,与对照组相对照,这些溶液中均出现了纤维丝状的蛋白聚集体,这是富含β错误折叠蛋白构象的典型特征[35]。这些结果可以印证,在上述条件下,孵育液中存在着大量的富含β折叠构象的Aβ聚集体。然而,如图5d~5f所示,在CoPM存在下,没有纤维丝状物质出现,取而代之的是一些类似油状印记的无定形态物质。
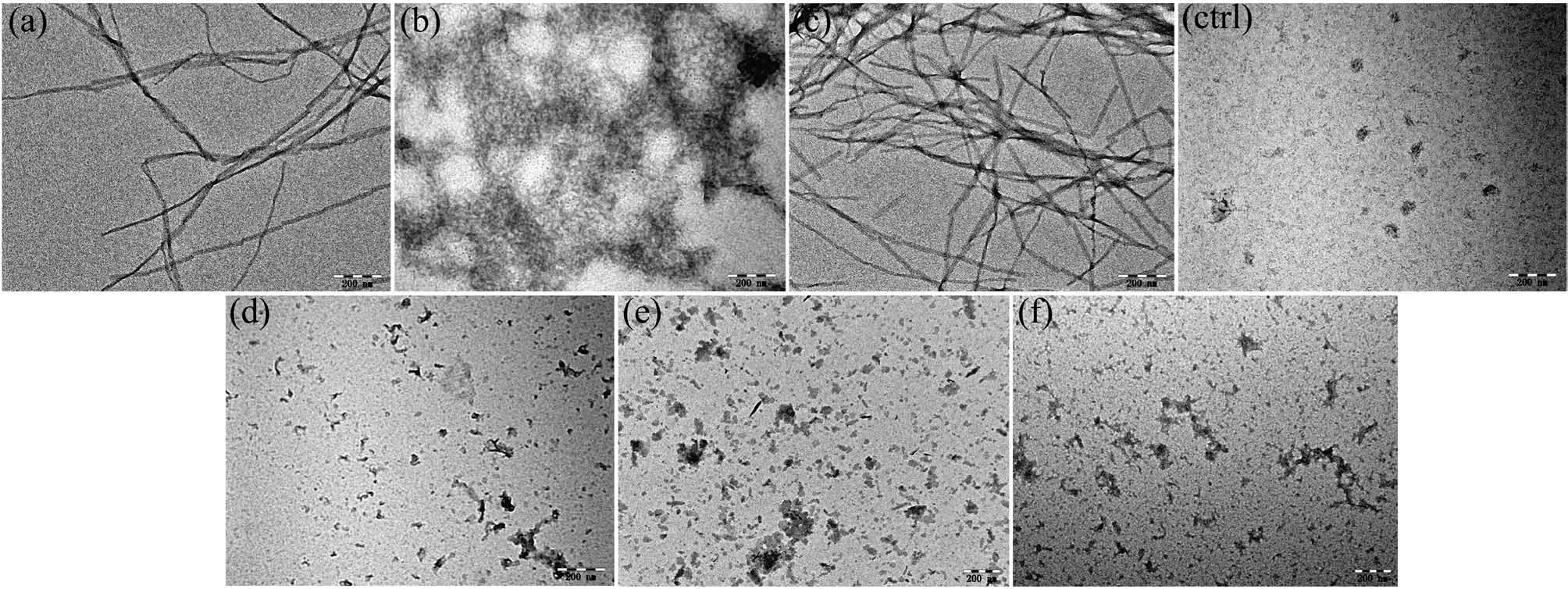
图5 CoPM对各种因素诱导形成的Aβ40(20 μmol·L-1)聚集体影响的TEM图Fig.5 TEM images for the effect of CoPM on Aβ40(20 μmol·L-1)aggregates induced by various factors
2.4 Aβ构象调节
进一步,我们利用CD谱验证CoPM对Zn2+、Cu2+以及自聚集诱导的Aβ错误折叠体构象的影响。如图6所示,Aβ40与Cu2+共孵育后,在约215 nm处检测到一个负峰,表明Cu2+诱导形成了β折叠构象[32]。用Zn2+孵育后的Aβ拥有一个较Aβ40+Cu2+组更强的CD谱峰。这表明,Zn2+诱导效应更加强烈。而在CoPM存在下,无论是Zn2+还是Cu2+孵育组,这个CD谱峰都出现了明显的衰退。这说明CoPM可以抑制金属离子诱导的Aβ的β折叠相关构象转化。此外,CoPM处理的Aβ40组的负CD谱峰也比单独的Aβ40弱,这可能意味着CoPM也可以抑制Aβ的自聚集。目前,大多数报道的单功能螯合剂只能防止金属离子诱导的构象错误折叠,而不能与Aβ本身相互作用,因此对Aβ的自聚集束手无策[36]。以上结果表明,CoPM是通过调节β折叠构象而非螯合机制起作用的。
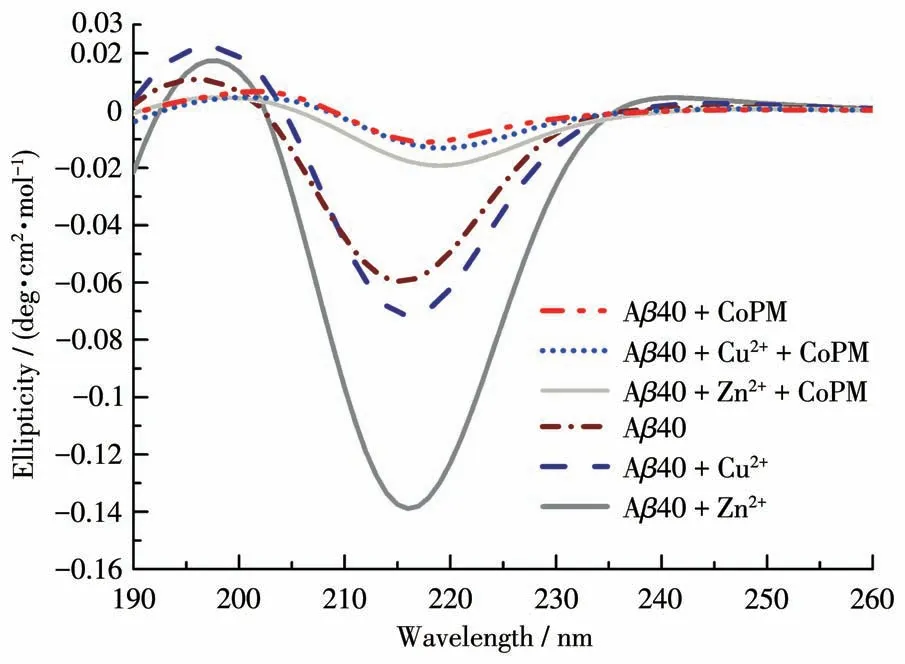
图6 CoPM对各种因素诱导形成的Aβ40聚集体构象影响的CD谱图Fig.6 CD spectra for the effect of CoPM on the conformation of Aβ40 aggregates induced by various factors
2.5 抑制ROS的产生
ROS是导致AD的另一个关键神经毒性物种[2]。Cu2+-Aβ复合物能够有效地催化ROS的产生,并对神经元造成损伤[37]。因此,我们使用2′,7′-二氯荧光素(DCF)荧光法检测CoPM对Cu2+介导的ROS生成的抑制作用。DCFH-DA本身没有荧光,它可以在HRP存在下与ROS反应,生成具有荧光的物质DCF。因此,体系中DCF荧光的强弱可以揭示Cu2+-Aβ复合物诱导产生的ROS的总量[38]。如图7所示,从始至终,CoPM与Cu2+-Aβ复合物共孵育组的DCF荧光强度明显低于Cu2+-Aβ复合物对照组,这表明含有CoPM组的ROS总产量远远低于无CoPM组的ROS产出量。此结果说明CoPM可以有效地抑制体系中ROS的生成[39]。
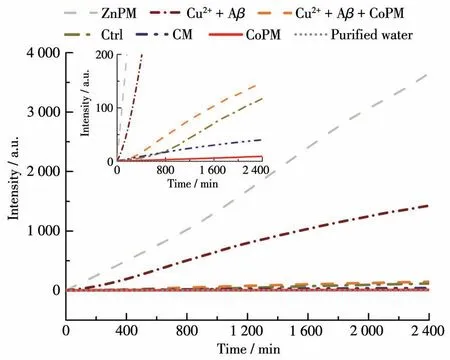
图7 ZnPM、Cu2++Aβ、Cu2++Aβ+CoPM、CM、CoPM与纯水孵育组和对照组的DCF荧光强度随时间的变化曲线Fig.7 Variation curves of DCF fluorescence intensity with time for ZnPM,Cu2++Aβ,Cu2++Aβ+CoPM,CM,CoPM,and pure water incubation group and control group
以往文献中报道,某些构象调节剂也可以通过瓦解Cu2+-Aβ复合物而减少其ROS的产生,但其本身并无抗氧化作用[32]。因此,CoPM是通过瓦解能产生ROS的聚集体而抑制体系产生ROS,还是本身具备抗氧化性?这需要验证。如图7中插图所示,单独使用CoPM的实验组产生的ROS明显减少,甚至低于环境对照组。然而,同构型的锌取代的多金属氧酸盐(H2en)6{[Zn(H2O)4](P2Mo5O23)}3(ZnPM)则能够产生大量的ROS[40]。以上实验结果揭示,CoPM的结构并不影响实验组HRP的活性,并且CoPM本身即具有抗氧化功能。有趣的是,钼酸钴(CM)也在一定程度上具有抗氧化能力。而CoPM的抗氧化作用优于CM,这说明CoPM独特的结构使其具有更强的抗氧化能力。综上,与以往文献报道的单功能螯合剂和调节剂相比,CoPM抑制ROS的机制是不同的[41]。一方面,CoPM可以像单功能螯合剂或者调节剂一样通过解聚Cu2+-Aβ复合物来减少ROS的产生[41];另一方面,CoPM自身就具有抗氧化特性,能够将环境中的ROS清除。据我们所知,CoPM是首例同时具有错误折叠构象调节和抗氧化多功能的POM,这将拓展POM在抗蛋白错误折叠疾病中的应用。
2.6 细胞毒性的抑制
我们以常用的PC12细胞为模型[42]通过MTT实验研究CoPM对Aβ40和金属离子诱导的Aβ40聚集体细胞毒性的抑制作用。如图8所示,PC12细胞在Zn2+/Cu2+处理的Aβ40环境下孵育后,其存活率相当低(小于40%或30%),这也与文献报道一致,并提示这些Zn2+/Cu2+处理过的Aβ40聚集体对PC12细胞具有相当高的毒性[43]。相比之下,在CoPM存在下,相应的PC12细胞存活率达到约60%。此外,与单纯Aβ40孵育组相比,有CoPM的Aβ40孵育组的细胞存活率将近70%。在以往的研究中,大多数单功能螯合剂只能通过竞争金属离子而抑制它们对Aβ错误折叠的诱导作用,而螯合剂本身并不能与Aβ产生相互作用。因此,这些单功能螯合剂对Aβ自聚集体没有影响,属于间接作用机制[44-45]。而以上结果表明,CoPM不但可以抑制由金属离子诱导而产生的Aβ错误折叠聚集体的神经毒性;还能够直接作用于Aβ自聚集本身,削弱它们的细胞毒性,这也是CoPM与以前的抗AD螯合剂之间的最为显著的功能差异。
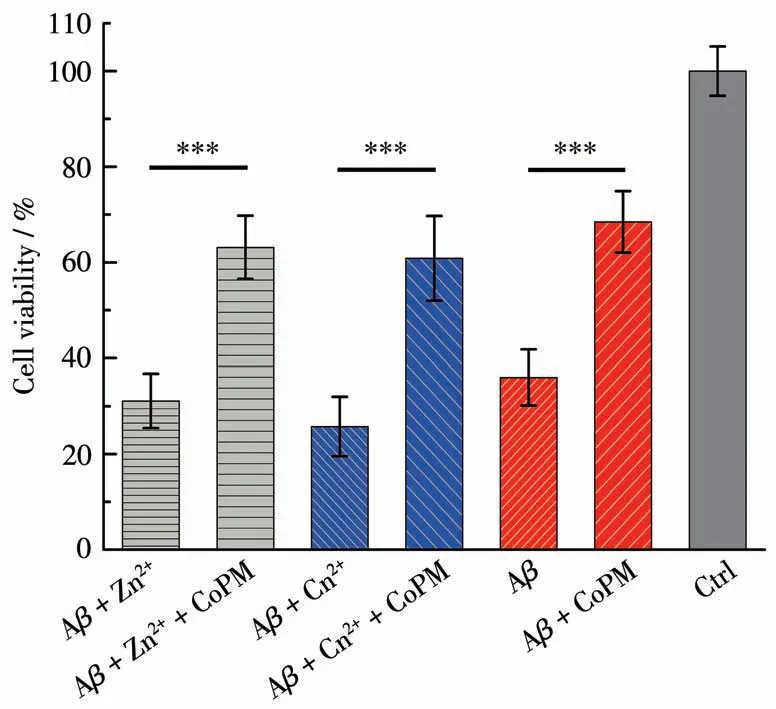
图8 MTT法检测CoPM对各种因素诱导产生的Aβ聚集体的细胞毒性抑制作用Fig.8 Inhibitory effect of CoPM on the cytotoxicity of Aβ aggregates induced by various factors by MTT assay
接下来,我们通过观察PC12细胞形态学变化,进一步研究CoPM对Aβ40自聚集和金属离子诱导的Aβ40错误折叠聚集体的细胞毒性的抑制。如图9所示,PC12细胞(对照组)呈多边形,其中大多数细胞有厚而长的突触,并与其他细胞连接而形成网络。在与Zn2+/Cu2+诱导或自聚集的Aβ错误折叠聚集体孵育24 h后,PC12细胞呈现出球形,神经突触收缩,神经元的树突状网络被破坏(图9a、9c和9e)。特别是与Aβ40+Cu2+孵育组,其神经元上的突触断裂,细胞体开始膨胀并变成球形。与之相对,在CoPM存在的情况下,尽管仍有淀粉样斑块的沉积,但PC12的细胞形态尽可能保持完整(图9b、9d和9f),并且细胞体增大的趋势也受到了抑制。细胞体多为梭形,突触清晰可见。此外,神经元的突触网络也被保留了下来。有研究报道,Aβ可以诱导产生突触毒性,导致神经元突触的损伤和功能障碍,因此对突触的保护在抗AD中也是非常重要的内容[46]。以上结果表明,CoPM可以保护神经元,减轻Zn2+/Cu2+诱导或自聚集产生的Aβ错误折叠聚集体的毒害。

图9 CoPM对各种因素诱导产生的Aβ聚集体的细胞毒性抑制作用的细胞显微照片Fig.9 Cell micrographs of the cytotoxic inhibitory effect of CoPM on Aβ aggregates induced by various factors
3 结论
淀粉样蛋白(Aβ)的聚集在阿尔茨海默病(AD)的发病机制中起着关键作用。β折叠构象是这些具有细胞毒性物质的核心结构。此外,由这些有害聚集体所产生的活性氧物种(ROS)是另一个重要的神经退行性因子。本文介绍了一例纳米线状钴取代的多聚磷钼酸盐(H2en)6{[Co(H2O)4](P2Mo5O23)}3·11H2O(CoPM),它复合了构象调节和抗氧化双功能。一方面,CoPM作为一种构象调制剂,不但可以抑制由金属离子诱导产生的富含β错误折叠的Aβ聚集体;还能够抑制Aβ的自聚集;另一方面,CoPM作为一种抗氧化剂,能有效抑制和消除Cu2+-Aβ复合物所产生的ROS。因此,CoPM可以保护神经元,减轻错误折叠的Aβ聚集体和ROS等相关神经毒性物种的侵害。
还有许多疾病,如帕金森病、亨廷顿病、2型糖尿病、克-雅病和新变异型克-雅病,也是蛋白质错误折叠类疾病[47-48]。其致病过程是相似的,即将蛋白质的构象转化为疏水的β错误折叠结构,大量错误折叠的蛋白质和由其产生的ROS破坏大脑细胞和组织。由于大多数该类疾病是多病因的,均涉及蛋白质错误折叠和ROS氧化应激[48],因此,CoPM的复合多功能设计思路亦有可能应用于抗其他蛋白错误折叠疾病药物的开发[5,48]。Supporting information is available at http://www.wjhxxb.cn

