着丝粒蛋白T在乳腺癌中表达及其启动子区变异的研究
毕佳欣,王晓雪,赵若晗,韩 旭,宋 洁*
(牡丹江医学院生物学教研室,黑龙江 牡丹江157011)
着丝粒蛋白(centromere specific proteins,CENPs)是装配在染色体DNA上的一个多蛋白大型复合体,是着丝粒组装和功能发挥的基本组成单位。在有丝分裂过程中形成动粒,动粒-微管组成连接,为细胞有丝分裂中染色体的移动提供动力。CENPs结构异常、表达异常或与DNA作用异常,将影响着丝粒点的形成、激活、对称性等,从而影响染色体的稳定存在和正确分离。近年来,研究表明着丝粒蛋白调节异常或功能障碍会导致非整倍性并促进癌变。目前,在人体细胞中发现了多种CENPs,最先发现的是CENP-A、CENP-B,近期发现的有CENP-I、CENP-U、CENP-T等[1],构成了动粒核心蛋白网络(constitutively centromere-associated network,CCAN)。目前,文献证实CCAN中CENPs如CENP-A、CENP-E、CENPF、CENP-H、CENP-W、CENP-U在多种肿瘤中出现过表达,并与肿瘤的发生发展密切相关。而CENP-T作为着丝粒内部结构,是直接参与着丝粒染色质的构建的重要成员,对细胞的CCAN网络构成发挥重要作用[2-3],但CENP-T在肿瘤中的表达情况及其在肿瘤发生发展中的作用机制还未见报道。因此,本课题以组织和细胞水平实验研究CENP-T在乳腺癌中的表达、生物学功能及机制,为阐明动粒网络蛋白在肿瘤中的作用机制研究提供基础数据。
1 材料与方法
1.1 样本及主要试剂
收集2017年10月—2018年4月间牡丹江市肿瘤医院外科手术切除标本,乳腺癌患者的乳腺癌组织及远离癌组织3~5 cm的癌旁正常乳腺组织26对,液氮保存。所有患者术前均未行任何治疗,采集标本均得到患者的同意,标本经术后病理证实为浸润型乳腺导管癌和乳腺导管内癌,排除其他肿瘤。本研究所使用的人体材料通过牡丹江医学院医学伦理委员会批准(批准文号2017-G11)。
正常人乳腺细胞系MCF10A和乳腺癌细胞系MCF7和MDA-MB-231均购于上海生命科学研究院细胞资源中心;兔抗人CENP-T多克隆抗体购于美国Gene Tex公司;CENP-T基因序列的特异性siRNA由广州锐博公司设计并合成,转染试剂Lipofectamine 2000购于美国Invitrogen公司,兔超敏二步法免疫组化检测试剂PV-6001及DAB购于北京中杉金桥公司;碘化丙啶(propidium iodide,PI)购于碧云天公司;Annexin V-FITC细胞凋亡检测试剂盒购于BD公司。
1.2 免疫组织化学法检测CENP-T蛋白表达
兔二步法(兔聚合物法检测系统PV)进行IHC。石蜡切片常规脱蜡水化,以柠檬酸钠进行抗原修复,依次滴加过氧化物酶室温孵育10 min、正常山羊血清室温孵育15 min,CENT-P一抗(稀释度均为1∶300,4℃过夜)、生物素标记的二抗,室温孵育20 min,辣根过氧化物酶标记链霉卵白素工作液室温孵育15 min,DAB显色,自来水冲洗,苏木精复染,脱水透明,封片。用PBS代替一抗作阴性对照。以卵巢癌石蜡切片为阳性对照。所有切片采用双盲法,细胞核和胞浆内出现棕黄色颗粒为阳性细胞,阳性程度根据其阳性细胞的比率和染色程度进行综合评定。
1.3 CENP-T启动子甲基化检测
乳腺癌组织和癌旁正常乳腺组织10例进行启动子甲基化检测,采用Methprimer及EEMB OSS/cpgplot在线工具分析CENP-T启动子区CpG岛,两个网站的预测结果一致,共存在一个CpG岛,位置在1 819 bp至2 142 bp,长度324 bp,亚硫酸氢盐修饰后测序(bisulfite sequencing PCR,BSP)法检测CENP-T启动子区CpG岛甲基化水平。使用2对测序引物,分别为:1F:TTTGGTTATTGATAGAGAAGG;1R:AATA AAACCTTAAAACCCC;2F:GATAGGGATAAAGTTT TT;2R:AATAAAACCTTAAAACCCC,约需1~2套巢式引物,提取组织样本DNA,亚硫酸盐修饰DNA,PCR扩增,回收产物,1个样本BSP单次产物挑取10个克隆,进行TA克隆测序。
1.4 CENP-T启动子突变检测
乳腺癌组织和癌旁正常乳腺组织10例进行CENP-T启动子突变的检测,使用染料终止子(Bigdye terminator,BDT)反应的Sanger测序法,BDT反应:10 μL反应体系,依次加入1 μL引物、2~5 μL模板、0~3 μL dH2O和4 μL预配好的Bigdye mix。每种样品与试剂加入的顺序,按照从上到下,或者从左到右的顺序依次加入,加完引物、模板、dH2O以及Bigdye mix后,需要将实验用的反应板进行离心,1 000 r/min离心,PCR反应程序:94℃、5 min;94℃、20 s,55℃、20 s,72℃、90 s 35个循环;72℃、7 min。然后电泳回收扩增的2 000 bp条带DNA产物,最后用3对引物1F/1R、2F/2R和3F/3R进行测序。反应引物:1F,CGACATCGCACCACA GCACT;1R,CTTTTTCTCTAGTCAGGACCGT。2F,ATATGCAGGGTCAGTGGCTTT;2R,GGGCACGTAG ATTTCAGACTT。3F,GTTATTTCAAGACCTGTAGA;3R,TATGGTCGGGAACAGGGTGA。
1.5 MCF7细胞培养及siRNA转染
MCF7细胞用含20%胎牛血清的高糖DMEM培养液,加入100 mg/L链霉素和1×105U/L青霉素,置于CO2体积分数为5%、湿度95%、37℃恒温培养箱中培养。转染实验的细胞:MCF7细胞按每孔2.5×105个接种于6孔板,当细胞汇合度达60%~80%时进行转染,转染方法参照riboFECTTM说明书进行。siRNA转染分为3组:未转染对照组(NC)、转染阴性对照组(NC siRNA)和 转 染siRNA实 验 组(CENP-T siRNA)。转 染siRNA实验组设计3对序列,评估CENP-T siRNA的序列1为5′-GGAGGTATTTGCTGCTCAT-3′,序列2为5′-GGAGGTCAATGCCTTTGCT-3′,序列3为5′-GAA GTTGAGTGGCCAAACA-3′。转染6 h后,在荧光显微镜下观察转染指示剂进行的转染,判定当前转染条件下细胞的转染效率,确定siRNA转染成功。转染后使用含20%胎牛血清无双抗培养基继续培养,然后进行CENP-T蛋白表达水平检测,筛选出敲减CENP-T蛋白表达水平50%以上的特异性siRNA序列,进行细胞增殖能力,细胞周期时相分布以及细胞凋亡率的检测。
1.6 Western blot法检测CENP-T蛋白的表达
采用Western blot法检测乳腺癌组织、癌旁正常乳腺组织及MCF7、MDA-MB-231细胞和转染后细胞中CENP-T和GAPDH蛋白的表达。组织液氮研磨加入裂解液裂解匀浆,超声破碎,4℃离心20 min取上清液,电泳结束后将蛋白转移至PVDF膜,5%脱脂奶粉封闭1 h,CENT-P一抗4℃过夜孵育(CENP-T工作液稀释比例均为1∶300;GAPDH为1∶5 000)。二抗(工作液稀释比例均为1∶5 000),室温孵育1 h,Super ECL超敏发光液,避光作用1 min,采用Amersham Imager600系统进行显色。
1.7 MTT法检测细胞活力
MCF7细胞转染24 h后,于96孔培养板中每孔加入100 μL细胞悬液,每组设3个复孔。siRNA转染MCF7细胞系分别于24、36、48和72 h后每孔加入5 mg/mL的MTT溶液10 μL,室温下培养4 h后,吸弃孔内原有培养液,每孔加100 μL DMSO,紫外分光光度计检测490 nm波长处各孔吸光度值D(490),以时间为横坐标,以吸光度值为纵坐标,绘制细胞生长曲线,分析细胞活力。
1.8 细胞集落形成实验检测细胞增殖能力
收获转染后48 h的CENP-T siRNA组和NC siRNA组细胞接种于6孔板中,每孔接种200个细胞,培养10~14 d,当出现肉眼可见的集落时,终止培养,PBS冲洗3次,甲醇固定15 min,Giemsa染色15 min,清水冲洗掉多余的染液,镜下计数,计算集落形成率。集落形成率=集落数/接种细胞数×100%,每组设置3个复孔,实验重复3次。
1.9 流式细胞术检测细胞周期及细胞凋亡率
接种2.5×104个MCF7细胞于6孔板中,每个样本设置3个复孔,采用20%无双抗培养基培养24 h。转染CENP-T siRNA后的MCF7细胞系和NC siRNA组的MCF7细胞系用20%无双抗培养基置于37℃、CO2体积分数为5%的培养箱中继续培养48 h。将每组细胞制备成单细胞悬液用于检测细胞周期;加入1 mL预冷的70%乙醇,4℃固定过夜;1 000 g离心5 min,沉淀细胞,加入1 mL预冷PBS,重悬细胞;每管样本中加入0.5 mL碘化丙啶染色液,流式细胞仪(FACS Calibur,BD)在激发光波长488 nm处检测荧光,同时检测光散射情况。用于检测细胞凋亡情况的CENP-T siRNA组和NC siRNA组MCF7细胞用胰酶消化1 min,获得单细胞悬液,用预冷的PBS洗涤细胞两次,然后将细胞重悬于1×结合缓冲液并稀释浓度至1×106个/mL;取100 μL溶液(1×105个细胞)转移至5 mL培养管中,分别加入5 μL的Annexin V-FITC和5 μL的PI轻轻涡旋细胞,在室温(25℃)下避光孵育15 min;向每管中加入400 μL的1×结合缓冲液,在1 h内用流式细胞仪检测分析。
1.10 统计学处理
数据分析采用SPSS 16.0统计软件分析。计数资料用χ2检验。计量资料以xˉ±s表示,用t检验或方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CENP-T在乳腺癌组织中的蛋白表达水平下调
采用在线数据库GEPIA检测CENP-T在乳腺癌组织(n=1 085)和癌旁正常乳腺组织(n=291)中的表达,结果如图1A和B所示:与癌旁正常乳腺组织相比,CENP-T在乳腺癌组织的表达显著降低,差异具有统计学意义(P<0.05,图1G)。免疫组化的检测结果显示CENP-T在乳腺癌和癌旁正常乳腺组织内主要着色于胞核,高倍镜可观察到胞核内有棕黄色颗粒,胞浆内也有部分表达(图1C~F)。CENP-T在26对乳腺癌组织和癌旁正常乳腺组织中阳性表达率分别为84.62%和92.31%,阳性表达率差异无统计学意义(χ2=0.754,P=0.385)。然而,CENP-T在乳腺癌组织与癌旁正常乳腺组织中的表达程度差异有统计学意义(χ2=11.346;P=0.003)(见图1,表1)。由此可见,CENP-T在乳腺癌组织细胞和癌旁正常乳腺组织细胞中均表达,只是表达的程度有差异,乳腺癌组织中CENP-T的蛋白表达水平下调。
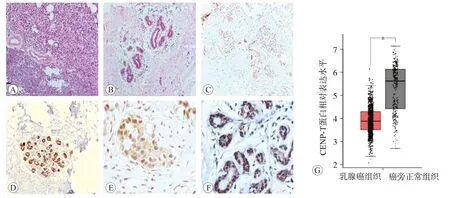
图1 CENP-T蛋白在乳腺癌及癌旁正常乳腺组织中的表达
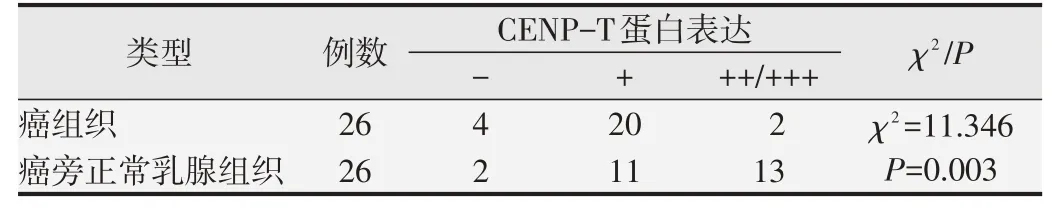
表1 CENP-T蛋白在乳腺癌组织与癌旁正常乳腺组织中的表达情况分析(n=26)
2.2 乳腺癌组织中CENP-T基因启动子甲基化增加且启动子突变
数据库预测CENP-T甲基化位点。在乳腺癌中CENP-T蛋白表达下调的组织,匹配癌旁正常乳腺组织进行CENP-T基因启动子序列PCR产物测序和DNA片段甲基化检测,见图2A。CENP-T基因启动子甲基化检测结果显示:乳腺癌组织CENP-T基因启动子甲基化程度(15.34±0.01)%,癌旁正常乳腺组织CENP-T基因启动子甲基化程度(10.26±0.016)%,乳腺癌组织与癌旁正常乳腺组织比,CENP-T基因启动子甲基化程度增加,差异有统计学意义(t=4.567,P=0.002),见图2B。启动子突变情况分析结果,乳腺癌组织和癌旁正常乳腺组织进行CENP-T启动子序列PCR产物测序见图3,将测序结果进行blast比对,发现在乳腺癌组织中2例出现突变,1例组织检测出启动子的2个位点碱基突变分别为C1545T、C1628G,另外1例乳腺癌组织启动子区C1417T碱基突变。

图2 Western blot和BSP检测乳腺癌组织及癌旁正常乳腺组织中CENP-T蛋白表达及其基因启动子CpG岛甲基化水平图

图3 乳腺癌组织中CENP-T基因启动子区突变分析
2.3 敲减CENP-T可能促进乳腺癌MCF7细胞增殖能力
首先,构建CENP-T敲减细胞系:如图4A显示CENP-T在细胞系中的蛋白表达情况,CENP-T在正常人乳腺细胞系MCF10A中蛋白表达水平高于乳腺癌细胞系MCF7和MDA-MB-231;CENP-T在MCF7细胞系的蛋白质表达水平较高而MDA-MB-231无表达,因此以MCF7为靶细胞构建CENP-T瞬时敲减细胞系。3种siRNA常规转染MCF7后,Western blot检测干扰效率如下图4B和C。siRNA均能降低CENP-T的表达,其中CENP-T siRNA1的敲减率最高为98%,干扰后CENP-T几乎不表达,CENP-T siRNA3的敲减率77%,CENP-T siRNA2的敲减率为45%。因此,后续实验使用CENP-T siRNA3作为干扰序列观察表达降低程度对细胞生物学特征的影响。

图4 CENP-T在3种细胞系的表达及siRNAs序列沉默后的Western blot检测结果
MTT实验检测细胞增殖能力。为检测CENP-T对MCF7细胞的生长的作用,将细胞接种于96孔培养板上,设立CENP-T siRNA组和阴性对照siRNA组,连续培养3 d,计数结果按实验方法中描述的绘制生长曲线如图5A。CENP-T siRNA组表达下调促进了MCF7细胞的增殖,统计学分析CENP-T siRNA与NC在24、36、48、72 h的时间点上(t=1.692,P=0.160;t=2.636,P=0.054;t=5.475,P=0.005;t=4.328,P=0.012)。
细胞集落形成实验检测细胞增殖能力。阴性对照siRNA、CENP-T siRNA细胞的增殖情况如图5B和5C所示,CENP-T siRNA组细胞集落形成率为82%,阴性对照siRNA集落形成率为62%,CENP-T siRNA组细胞集落形成率明显高于另外两组,与阴性对照siRNA组比较差异有统计学意义(P<0.01),说明,CENP-T siRNA组增殖能力高于阴性对照siRNA组(P<0.05)。
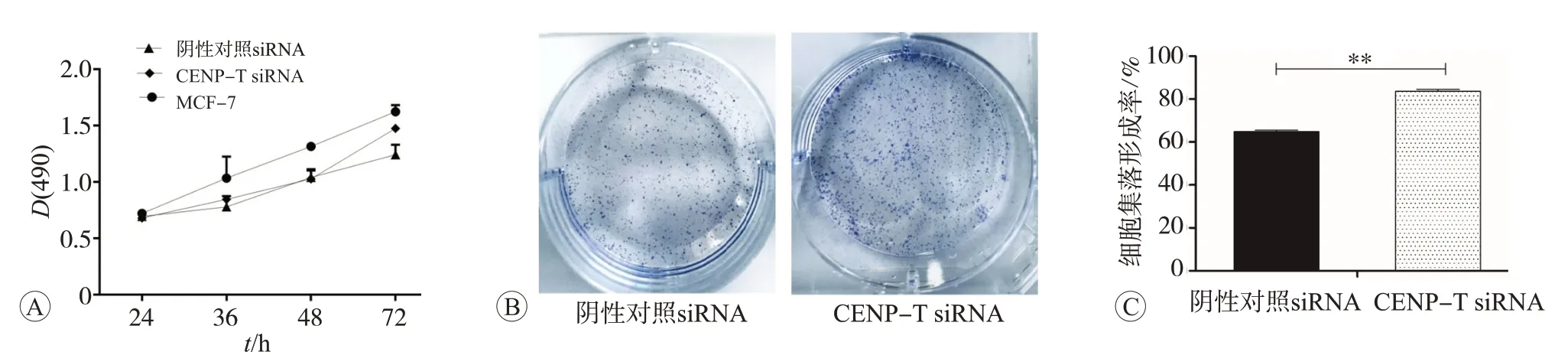
图5 敲减CENP-T对MCF7细胞增殖能力的影响
2.4 敲减CENP-T后乳腺癌MCF7细胞G2/M期阻滞
流式细胞仪细胞周期检测结果见图6,结果显示CENP-T siRNA组的MCF7细胞G1期细胞占(56.3+0.3)%,S期和G2/M期细胞分别占(30.8+0.8)%和(12.9+0.5)%。阴性对照siRNA组的MCF7细胞G1期细胞占(59.1±1.5)%,S期和G2/M期细胞分别占(31.6±0.8)%和(9.4±0.7)%(如图6所示)。敲减CENP-T后的G1期细胞百分率减少了2.78%,S期细胞百分率下降了0.78%,G2/M期细胞百分率增加了3.45%(P<0.01)。与阴性对照siRNA组相比,CENP-T siRNA组细胞的G2/M期明显延长,S期的细胞数目几乎无变化。
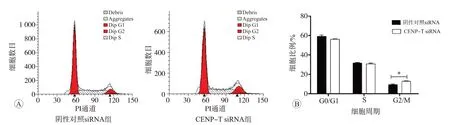
图6 流式细胞术检测敲减CENP-T后MCF7细胞周期时相分布图
2.5 敲减CENP-T可能抑制乳腺癌MCF7细胞凋亡
利用流式细胞术检测48 h各组细胞凋亡率,如图7所示,CENP-T siRNA的总凋亡率为(0.12±0.11)%,与阴性对照siRNA组相比,t=24.68,P<0.01,发生明显抑制。
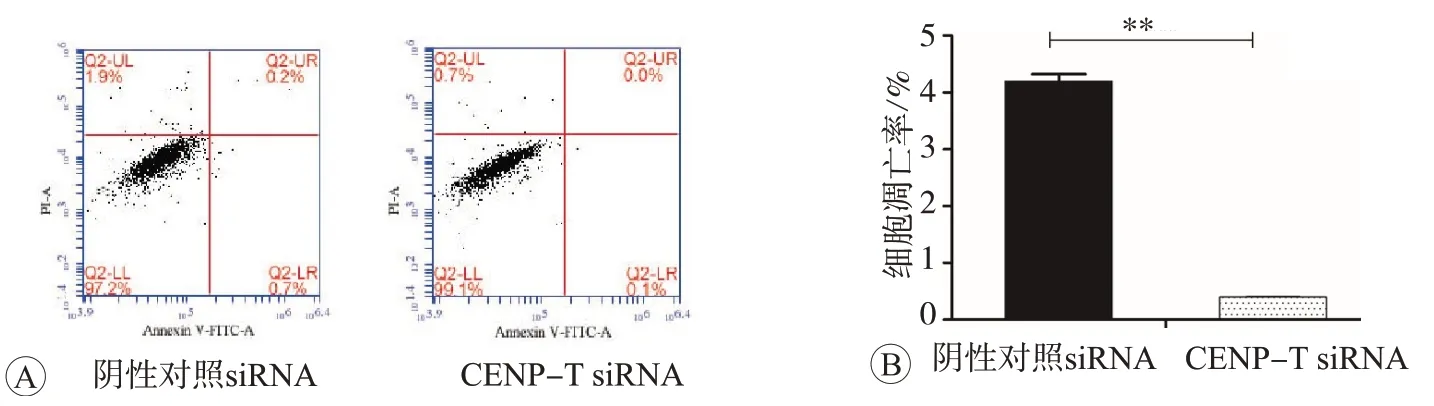
图7 流式细胞术检测敲减CENP-T后MCF7细胞凋亡率
CENP-T siRNA组的早期凋亡率为(0.10±0.01)%,与阴性对照siRNA组的(0.70±0.03)%相比,凋亡率降低,两者比较差异有统计学意义(t=30.6,P<0.01),CENP-T表达下调抑制细胞凋亡形成。
3 讨论
着丝粒是保证染色体稳定存在,保证细胞正常分裂的基本结构和功能元件之一。着丝粒蛋白家族有很多成员,其中哺乳类细胞中着丝粒蛋白的数目预计超过100,大多数命名为着丝粒蛋白,这些蛋白有的参与构成着丝粒,有的参与着丝粒发挥功能过程中的调控[4]。
早在1980年,Fritzler等[5]首先在硬皮病患者的血浆中发现了与着丝粒上不同的蛋白结合抗体,该发现促进了着丝粒蛋白的研究。CENP-T作为着丝粒蛋白成员之一,CENP-T的研究目前集中在其正常生物学结构和功能上。人类CENP-T基因位于染色体16q22.1,共由17个外显子组成。Hellwig等[6]用荧光显微镜技术分析内部动粒蛋白CENP-T在活人类细胞中动力学变化。着丝点是染色体分离所必需的,它是通过包含许多着丝点蛋白的动态过程组装起来的。CENP-T是一种内部的着丝点蛋白,在有丝分裂期间为外部着丝点Ndc80复合物的组装提供平台,确保了在有丝分裂过程中精确的着丝粒组装[7-9]。着丝点组装是由CENP-A启动的,它与内部着丝点组成的着丝点相关网络(CCAN)的组成成分发生物理相互作用,CENP-T也是组装必须的[10]。缺乏CENP-T、CENP-A引起分裂后期滞后和分离错误[11]。着丝粒蛋白A(CENP-A)通过组成CENP-T复合体的着丝粒相关网络来组织功能性的着丝粒。CENP-T可以直接与Holliday连接识别蛋白(HJURP)结合,通过时间调控的HJURP-CENP-T相互作用将CENP-T组装到着丝粒上[12]。Thakur报道[13],亚铁还原能力实验揭示了CENP-T在S期与着丝粒DNA结合,CENP-T独立连接着丝粒α卫星重复序列-171 bp到外部动粒。Rago等[14]报道在着丝粒区域,CENP-T/CENP-W是CCAN上游调控分子,直接参与的着丝粒染色质结构的构建。而Hori等[15]实验进一步证明,CENP-A和H3-CENP-T/W着丝粒蛋白复合体在调节着丝粒的构成和动粒活动具有特异性,使细胞可以在染色质构型之间切换,从而相互支持着丝粒的复制,并将着丝粒转化为有丝分裂的状态[16]。敲减CENP-T增加了CDH1(FZR1)的水平,导致(APC)-CDH1复合体的活性增加,抑制CCNB1水平,最终影响减数分裂[17]。多能干细胞(PSCs维持着丰富的CENP-A、CENP-C和CENP-T,但这些重要的着丝粒成分在干细胞着丝粒上显著减少[18]。
目前,已经报道着丝粒蛋白许多重要成员在肿瘤的发生发展中发挥重要作用,例如Athwal、Arimura等[19-20]报道CENP-A基因过表达状态影响基因的调控,影响染色质的脆性,而致恶性肿瘤的发生。研究人员在宫颈癌、胃癌[21-22]中也发现CENP-H的高表达,且与预后相关;CENP-W在胶质瘤组织中普遍高表达,对细胞的增殖侵袭有促进作用[23],CENP-F表达与宫颈癌鳞状细胞癌正相关[24],而CENP-T与肿瘤相关文献报道仅有1篇[25]。因此我们以CENP-T为靶点,探讨其在肿瘤中的作用及机制。
本实验采用免疫组织化学法研究CENP-T在乳腺癌的表达。实验结果显示乳腺癌中CENP-T的蛋白水平较癌旁正常乳腺组织蛋白表达水平显著下降(P<0.01)。这个结果与利用在线工具http://gepia.cancerpku.cn/检索结果一致,并且该数据库显示CENP-T在其他肿瘤中也有相同的表达水平下调的情况。为进一步分析CENP-T在乳腺癌低表达的原因,本研究利用RNA敲减技术构建降低CENP-T表达的细胞系,探讨CENP-T对肿瘤周期,细胞增殖以及细胞凋亡的影响,与对照组MCF7细胞比较,实验结果发现,敲减CENP-T基因表达后,G1期细胞所占比例略有降低,S期细胞所占比例不变,G2/M期细胞所占比例明显升高(P<0.01),同时,CENP-T基因表达减少率为77%后,当CENP-T敲减36 h时,MCF7细胞的增殖活性出现明显增高(P<0.005),集落形成能力增强(P<0.01);表明CENP-T表达下调可能促进乳腺癌细胞增殖能力。可见CENP-T表达下调通过干扰遗传物质的分配促进细胞的增殖。CENP-T siRNA转染后,细胞系中发生凋亡的细胞比例显著低于siRNA阴性对照组细胞(P<0.01);说明CENP-T表达下调可抑制乳腺癌细胞发生凋亡。
以上结果与已经报道CENPs在肿瘤中过表达相悖[21-24],可能因为CENP-T在细胞中具有其他着丝粒蛋白家族不同的特点。虽然肿瘤发生发展中存在遗传物质的不稳定性分配,但CENPs仍然是一个完整复合结构,在出现异常表达时各种CENPs作用调控不同的信号途径。因此,我们进一步对CENP-T启动子区的序列测序以及甲基化水平进行检测,发现CENP-T启动子区甲基化水平增加49.5%,并在过表达的乳腺癌组织中发现C1417T、C1545T、C1628G,3个位点两种形式碱基突变,进一步以生物信息学筛选出与CENP-T密切相关的转录因子,以解释CENP-T表达下调的分子机制,发现1545C是转录因子PR B,PR A结合位点,1628C、1417C是转录因子C/EBP BETA为结合位点。本研究只是发现了CENP-T启动子区甲基化水平变化及突变,要证实这个启动子区突变和CENP-T表达水平之间存在因果关系,还需要更多的实验来支持。
综上所述,CENP-T在乳腺癌表达下调,下调与启动子区的序列甲基化修饰及突变密切相关。敲减CENP-T基因表达致增殖指数增加,促进细胞分裂进行,增强乳腺癌MCF7细胞增殖能力,抑制细胞凋亡。启动子区的改变在乳腺癌中CENP-T表达下调的促癌细胞特征,究竟是何机制,还存在哪些信号分子作用改变肿瘤细胞的生物学行为,促进癌发生有待进一步研究。

