11株鲑源嗜冷黄杆菌药物敏感性分析
刘媛媛,宋 健,樊 丹,王 荻,邓福容,李绍戊,刘 敏
(1.东北农业大学 动物科学与技术学院,黑龙江 哈尔滨 150038;2.中国水产科学研究院 黑龙江水产研究所/黑龙江省水生动物病害与免疫重点实验室,黑龙江 哈尔滨 150070;3.上海海洋大学 水产科学国家级实验教学示范中心,上海201306)
【研究意义】细菌性冷水病(bacterial cold water disease,BCWD)是一种爆发频繁、致死率较高的鱼类细菌性疾病[1-2],其病原为嗜冷黄杆菌(Flavobacterium psychrophilum)。该菌属黄杆菌科(Flavobacteriaceae)黄杆菌属(Flavobacterium),是一种呈全球性地理分布、宿主范围广泛的革兰氏阴性菌,最适培养温度为15~18 ℃[3-4]。嗜冷黄杆菌是鲑科鱼类易感的重要病原菌之一,曾在美国五大湖鲑鱼亲鱼、养殖虹鳟(Oncorhynchus mykiss)幼鱼[5-6]和智利虹鳟、大西洋鲑(Salmo salar)和银鲑(Oncorhynchus kisutch)养殖中造成大量感染和死亡[7]。Gómez 等[8]于2014 年对嗜冷黄杆菌的疫苗研发进行了探索性研究,但迄今为止未见商品化的疫苗面世。在缺乏高效疫苗的情况下,化学药物仍是该病防控的有效方法。但病害防控过程中,药物的广泛使用降低了嗜冷黄杆菌的药物敏感性,并使其耐药菌株产生的频率升高[9-10]。因此,系统掌握嗜冷黄杆菌全球性药敏特性变化趋势及采取适当的治疗策略和精准用药具有重要意义。【前人研究进展】自21 世纪初开始,不同国家和地区的研究者们先后采用K-B 纸片[6,11]、琼脂稀释[12]和微量肉汤稀释[13-14]等方法对嗜冷黄杆菌分离株药物敏感性进行了分析和研究。嗜冷黄杆菌的智利分离株对阿莫西林、氟苯尼考敏感,对恶喹酸等耐药[16];美国分离株中24%的菌株对土霉素耐药,所有分离株对氟苯尼考等药物敏感[17];英国分离株对氟苯尼考等敏感,而对氟甲喹、恩诺沙星耐药[12,18]。土耳其[15]、加拿大[19]、丹麦[20]、芬兰[21]、日本[22]、西班牙[23]等国家临床分离株的药物敏感性也差异较大。【本研究切入点】我国对嗜冷黄杆菌病原学特性及防控方法的相关研究起步较晚,国内现行嗜冷黄杆菌分离株的药物敏感性的报道仅见本实验室前期柴静茹等[2]及Li 等[24]对部分代表性嗜冷黄杆菌分离株的8 种药物敏感性的分析报道。因此,系统全面的了解和掌握我国嗜冷黄杆菌现行分离株药敏特性,对于BCWD 的精准施药和高效防控病害至关重要。【拟解决的关键问题】为了解我国鲑源嗜冷黄杆菌分离株的药物敏感性,本研究以实验室前期分离保藏的11株鲑源嗜冷黄杆菌为研究对象,拟采用微量肉汤稀释法检测分离株对20种药物的敏感性,进而分析菌株药物敏感性与分离地区、时间和宿主的关联性,以期为我国养殖鲑鳟BCWD 的科学防控提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株 试验用11株嗜冷黄杆菌分离自黑龙江省和吉林省的鲑鳟鱼养殖场,由中国水产科学研究院黑龙江水产研究所水产病害与防治研究室鉴定保藏。采样时间为2019年和2020年。细菌分离的宿主包括美洲红点鲑(Salvelinus fontinalis)、亚东鲑(Salmo truttaL.)和白点鲑(Salvelinus leucomaenis)(表1)。

表1 11株鲑源嗜冷黄杆菌分离株基本信息Tab.1 Information of 11 Flavobacterium psychrophilum isolates recovered from salmonids
1.1.2 主要试剂及仪器 胰蛋白胨和酵母提取物购自赛默飞世尔科技(中国)有限公司,MH肉汤培养基购自美国BD 公司;恩诺沙星(enrofloxacin,ENRO)、氟甲喹(flumequine,FLUQ)、恶喹酸(oxolinic Acid,OXO)、左氧氟沙星(levofloxacin,LVX)、链霉素(streptomycin,STR)、卡那霉素(kanamycin,KAN)、阿米卡星(amikacin,AMI)、庆大霉素(gentamicin,GEN)、新霉素(neomycin,NEO)、四环素(tetracyclines,TET)、土霉素(oxytetracycline,OXY)、阿莫西林(amoxicillin,AMO)、氨苄西林(ampicillin,AMP)、甲氧苄啶(trimethoprim,TMP)、氯霉素(chloroamphenicol,CHL)、氟苯尼考(florfenicol,FFC)、甲砜霉素(thiamphenicol,TAP)、利福平(rifampin,RIF)、红霉素(erythromycin,ERY)、呋喃唑酮(furazolidone,AOZ)等抗菌药物均购自上海麦克林生化科技有限公司。
1.2 试验方法
1.2.1 细菌培养 采用胰蛋白酵母提取物(tryptone yeast extract salts,TYES)琼脂平板培养嗜冷黄杆菌(TYES 培养基配方:0.4%胰蛋白胨、0.04%酵母提取物、0.05%七水硫酸镁、0.05%无水氯化钙,pH 7.2)[25]。从-80 ℃冰箱取出实验室保存的甘油冻存菌,用一次性接种环划线于TYES 平板,18 ℃培养48~72 h 后挑取单菌落于TYES 液体培养基,18 ℃120 r/min 震摇48 h。随后,将培养好的菌液用1∶7 稀释的MH肉汤培养基稀释至1×106CFU/mL备用。
1.2.2 最小抑菌浓度测定 按照CLSI 指南[26-27]中推荐的方法制备20 种抗菌药物母液,进而采用微量肉汤稀释法测定喹诺酮类、氨基糖苷类等共计9 类20 种药物对嗜冷黄杆菌分离株的最小抑菌浓度(Minimal inhibition concentration,MIC)。
首先在96孔板第2列到12列加入1∶7稀释的MH肉汤100µL,然后将配制好的药物母液用1∶7稀释的MH 肉汤稀释至合适浓度,分别加入到96 孔板第1 列中,每孔200µL。每种药物从96 孔板第1 列2 倍倍比稀释直至第11 列,并设置第11 列为不加菌液只加药物的阴性对照,第12 列为不加药物只加菌液的阳性对照;在第1~10和12列每孔分别加入100µL稀释好的菌悬液。将96孔板置于18 ℃培养48 h后,观察并读取MIC值。
1.2.3 MIC 值的判定及数据分析 MIC 值的判定参考CLSI 标准和Vliet 等[17]报道,并使用Excel 分析数据,利用分离株对20种药物对应的MIC分布用Origin 2021作图分析。
2 结果与分析
2.1 嗜冷黄杆菌MIC值分析
根据测得的MIC 结果,得到11 株嗜冷黄杆菌的最小抑菌浓度的百分比分布表,如表2 所示。喹诺酮类药物对36.4%~54.5%的嗜冷黄杆菌分离株MIC 为≤0.125 µg/mL,其中FLUQ 和OXO 的部分MIC偏高,FLUQ 对36.4%、18%的菌株的MIC 分别为8 µg/mL、16 µg/mL;OXO 对27.3%、9%的菌株的MIC分别为8 µg/mL、16 µg/mL。氨基糖苷类药物中,AMI 对72.7%的菌株的MIC≤0.125 µg/mL,GEN 对36.4%的菌株的MIC 为≤0.125µg/mL。有45.5%的菌株对STR 的敏感性较低,MIC 高达32µg/mL。四环素类药物中,嗜冷黄杆菌对OXY 的敏感性比TET 高。OXY 对63.6%的菌株的MIC 为≤0.125 µg/mL。OXY 对分离株的MIC 均小于2 µg/mL,TET 的MIC 分布在0.5~8 µg/mL。β-内酰胺类药物中,AMP 对36.4%的菌株的MIC≤0.125 µg/mL。磺胺类药物TMP 的MIC 集中在8~16 µg/mL,TMP 对72.7%的菌株的MIC 为16 µg/mL。氯霉素药物的MIC 大多集中在0.5~4µg/mL,有18%的菌株对CHL、TAP 两种药物的敏感性略偏低,集中在8~16µg/mL。利福平RIF 对90.9%的菌株MIC≤0.125µg/mL。大环内酯类ERY的MIC分布在0.25~8µg/mL。呋喃类药物AOZ的MIC均≤1µg/mL,且有45.4%的菌株MIC为1µg/mL。
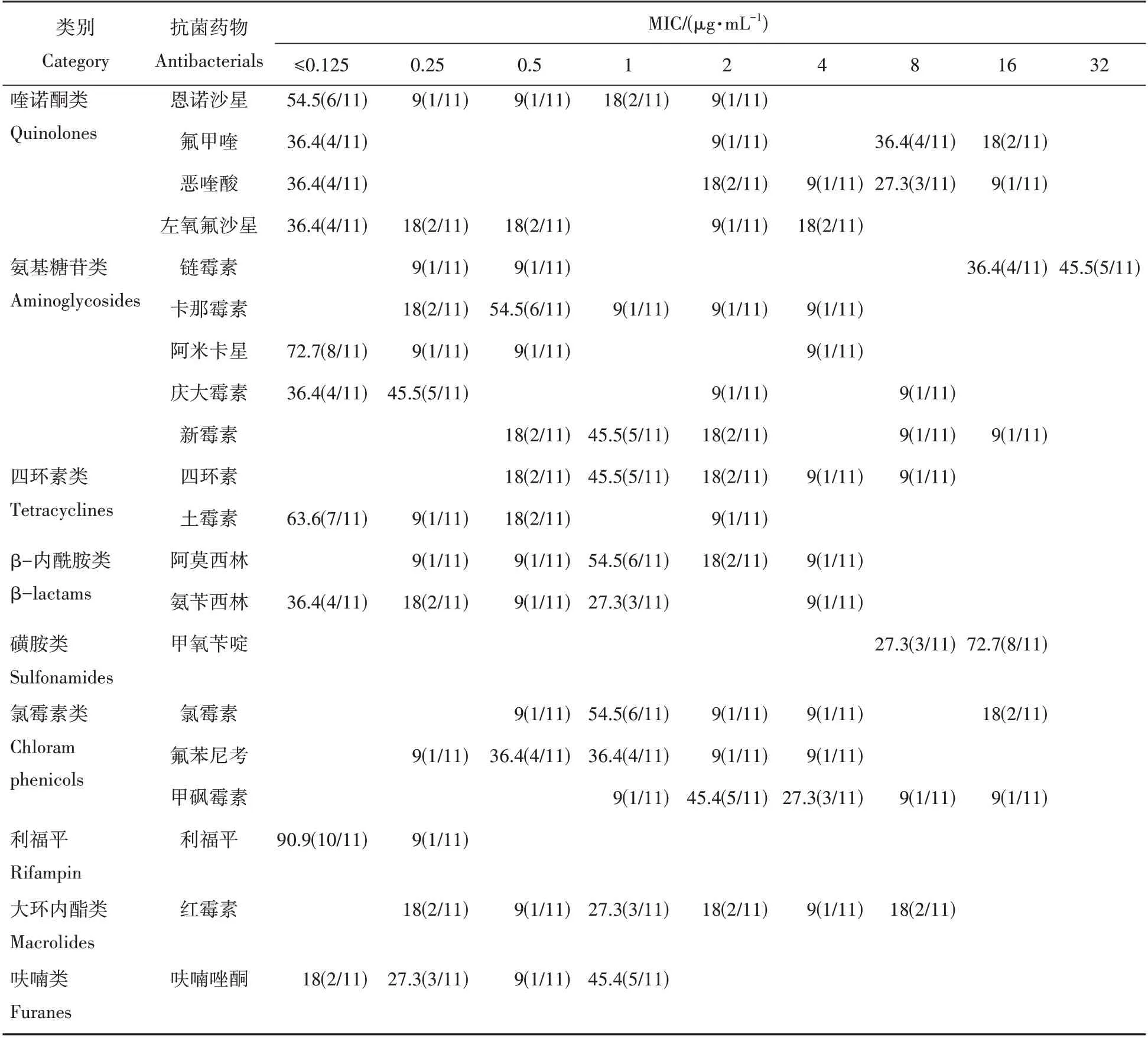
表2 20种抗菌药物对11株嗜冷黄杆菌的最小抑菌浓度分布百分比Tab.2 Percent distribution of minimum inhibitory concentrations of 11 F. psychrophilum strains to 20 antimicrobial agents
2.2 嗜冷黄杆菌药物敏感性与宿主的关联性分析
本试验对白点鲑源、美洲红点鲑源和亚东鲑源嗜冷黄杆菌的药物敏感性进行了研究,结果显示,3种宿主来源菌株均对ENRO、GEN、RIF药物敏感性较高,对STR、TMP药物敏感性较低;白点鲑源、美洲红点鲑源分离株对氯霉素类药物药物敏感性偏低;氟喹诺酮类药物对亚东鲑源分离株的抑制效果较好,而对美洲红点鲑源分离株抑制效果较差。
2.2.1 白点鲑源嗜冷黄杆菌MIC 结果 根据测得的MIC 结果,构建20 种药物对3 株白点鲑源嗜冷黄杆菌的最小抑菌浓度百分比分布,如表3 所示:3 株白点鲑源嗜冷黄杆菌对ENRO、AMI、GEN、RIF、AOZ 的敏感性较高,对STR、NEO、TMP、CHL的药物敏感性较低。

表3 20种抗菌药物对3株白点鲑源嗜冷黄杆菌的最小抑菌浓度分布百分比Tab.3 Minimum inhibitory concentration distribution of 3 F.psychrophilum strains recovered from Salvelinus leucomaenis with 20 antimicrobial agents
根据测得的MIC结果,构建3株白点鲑源嗜冷黄杆菌对20种药物的最小抑菌浓度弦图,如图1所示:药物对菌株的MIC 值大多分布在1~8µg/mL,且MIC 值为16~32µg/mL 的4 种药物对嗜冷黄杆菌的抑制效果较弱,即CHL、TMP、NEO、STR。
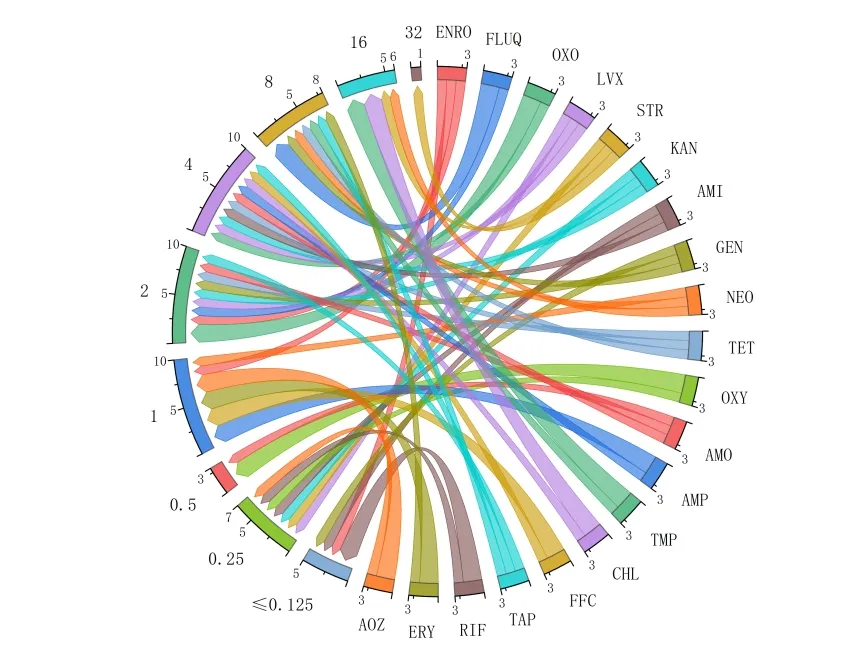
图1 20种药物对3株白点鲑源嗜冷黄杆菌的最小抑菌浓度弦图Fig.1 Strogram of the minimum inhibitory concentrations of 3 Salvelinus pluvius Hilgendorf F.psychrophilum strains from 20 drugs
2.2.2 美洲红点鲑源嗜冷黄杆菌MIC 结果 根据测得的MIC 结果,构建20 种药物对6 株美洲红点鲑源嗜冷黄杆菌的最小抑菌浓度百分比分布,如表4 所示:6 株美洲红点鲑源嗜冷黄杆菌对ENRO、LVX、AMI、GEN、OXY、AMP、RIF、AOZ的敏感性较高,对FLUQ、OXO、STR、TMP、TAP的药物敏感性较低。

表4 20种抗菌药物对6株美洲红点鲑源嗜冷黄杆菌的最小抑菌浓度分布百分比Tab.4 Minimum inhibitory concentration distribution of 6 Salvelinus fontinalis Source F. psychrophilum strains with 20 antimicrobial agents
根据测得的MIC 结果,构建20 种药物对6 株美州红点鲑源嗜冷黄杆菌的最小抑菌浓度弦图,如图2 所示:药物对菌株的MIC 值大多≤0.125µg/mL,其中MIC 值为1µg/mL 的菌株占比也较高。STR、TMP两种药物对嗜冷黄杆菌的抑制效果较弱,MIC值为16~32µg/mL。
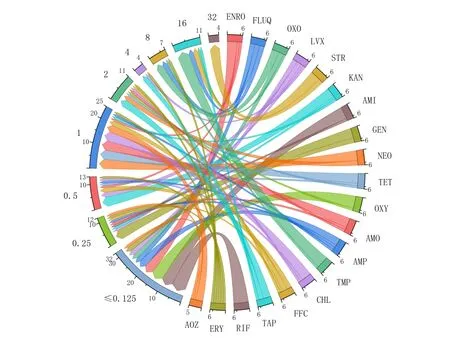
图2 20种药物对6株美洲红点鲑源嗜冷黄杆菌的最小抑菌浓度弦图Fig.2 Strogram of the minimum inhibitory concentrations of 6 Salvelinus fontinalis F.psychrophilum strains from 20 drugs
2.2.3 亚东鲑源嗜冷黄杆菌MIC 结果 根据测得的MIC 结果,构建20 种药物对2 株亚东鲑源嗜冷黄杆菌的最小抑菌浓度百分比分布,如表5 所示:对2 株亚东鲑源嗜冷黄杆菌ENRO、FLUQ、OXO、LVX、AMI、GEN、OXY、AMP、RIF 的药物敏感性较高,对STR、TMP的药物敏感性较低。
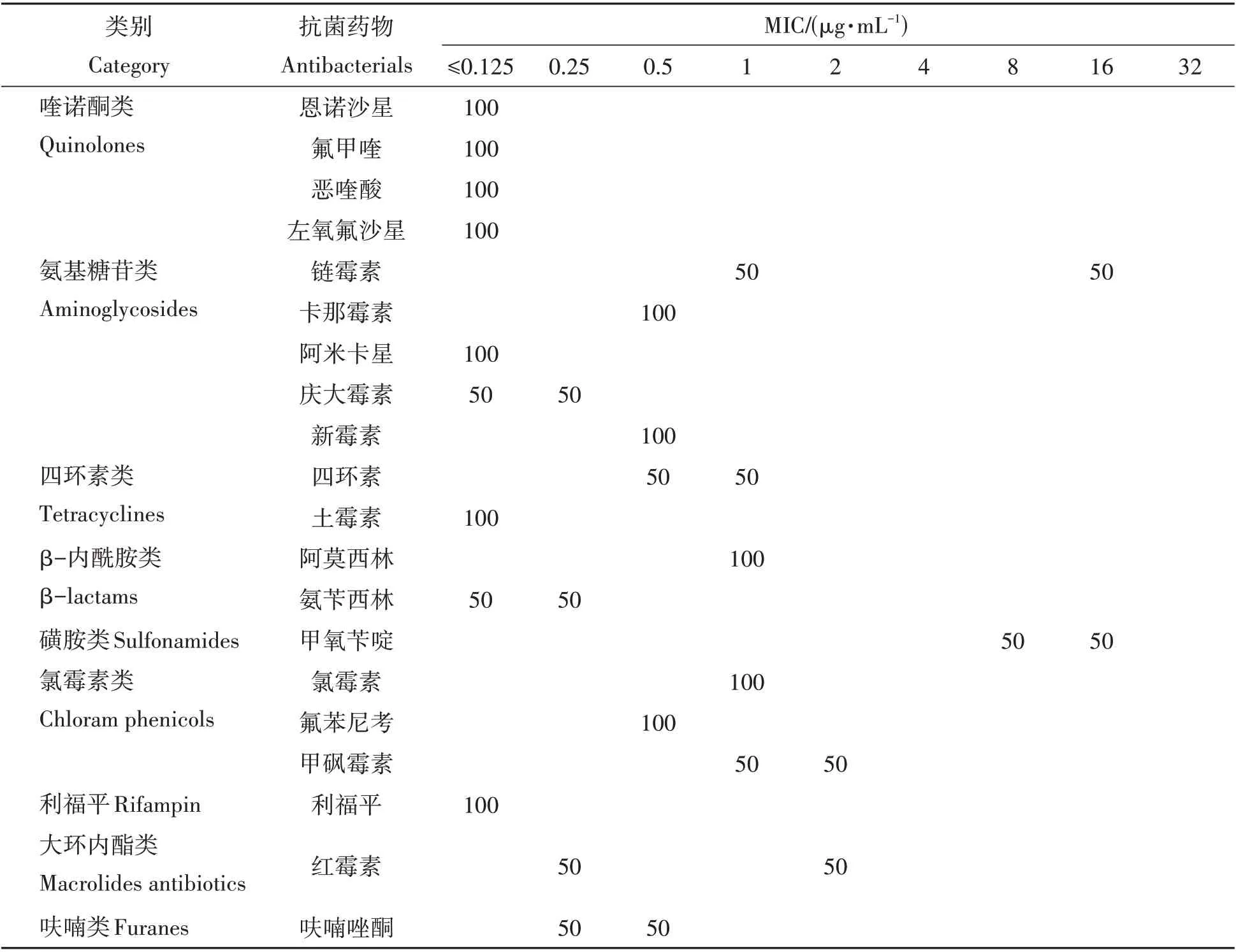
表5 20种抗菌药物对2株美洲红点鲑源嗜冷黄杆菌的最小抑菌浓度分布百分比Tab.5 Minimum inhibitory concentration distribution of 2 Salmo trutta L. F. psychrophilum strains with 20 antimicrobial agents
根据测得的MIC 结果,构建20 种药物对2 株亚东鲑源嗜冷黄杆菌的最小抑菌浓度弦图,如图3 所示:药物对菌株的MIC 值大多≤0.125µg/mL,其中MIC值为0.5µg/mL、1µg/mL的菌株占比也较高。STR、TMP 两种药物对嗜冷黄杆菌的抑制效果较弱,MIC值为8~16µg/mL。
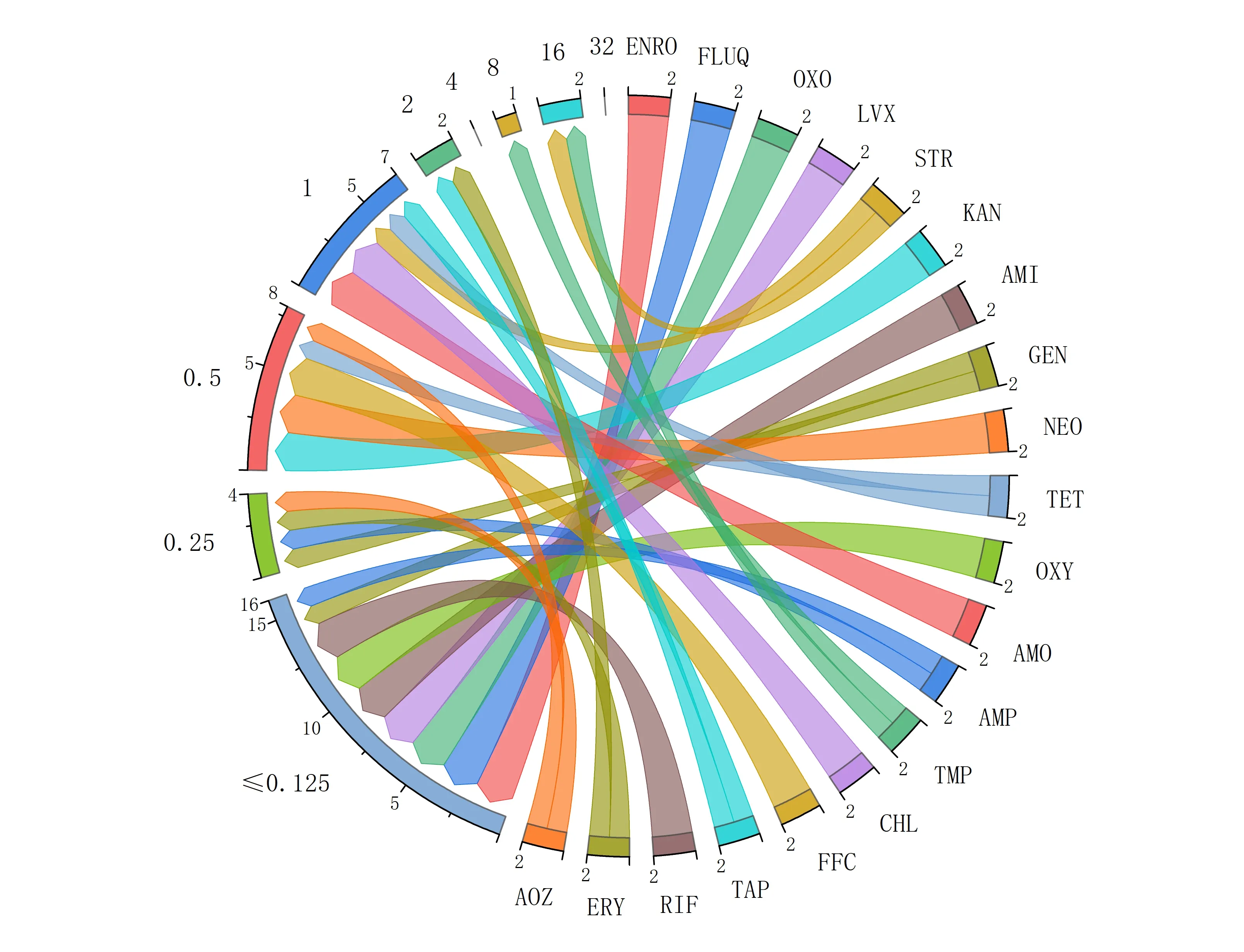
图3 20种药物对2株亚东鲑源嗜冷黄杆菌的最小抑菌浓度弦图Fig.3 Strogram of the minimum inhibitory concentrations of 2 Salmo trutta L.F.psychrophilum strains from 20 drugs
2.3 嗜冷黄杆菌药物敏感性与时空分布的关联性分析
2.3.1 不同地区嗜冷黄杆菌MIC 结果 根据测得的MIC 结果,分别构建分离自黑龙江省和吉林省的嗜冷黄杆菌对20种药物的不同最小抑菌浓度丰度分布雷达(图4)。

图4 20种药物对黑龙江省及吉林省嗜冷黄杆菌的最小抑菌浓度个数分布Fig.4 The distribution of minimum inhibitory concentrations of 20 drugs with 8 F.psychrophilum strains in Heilongjiang and Jilin Province
由图4a 可见,黑龙江省嗜冷黄杆菌分离株对ENRO、FLUQ、OXO、LVX、AMI、OXY、AMP、RIF 8 种药物的敏感性偏高,MIC 值多分布于小于0.125µg/mL 处;而TMP、STR 的敏感性则大部分偏低,MIC 分别为16µg/mL和32µg/mL。
由图4b 可见,吉林省地区的嗜冷黄杆菌分离株对RIF 药物敏感性偏高,大部分MIC≤0.125µg/mL;而FLUQ、GEN、NEO、TET、TAP 5 种药物的敏感性则较低,为8 µg/mL;TMP、CHL 两种药物的MIC 为16 µg/mL;STR的MIC最高,为32µg/mL。
由图4a和4b结果可见,两地嗜冷黄杆菌分离株对TMP和STR的敏感性较低,MIC分别为16µg/mL和32µg/mL;而吉林省分离株对FLUQ、GEN、NEO、TET、TAP 及CHL 6 种药物的敏感性也明显低于黑龙江省分离株。
2.3.2 不同年份嗜冷黄杆菌MIC 结果 根据测得的MIC 结果,分别构建20 种药物对分离自2019 年和2020年的嗜冷黄杆菌的不同最小抑菌浓度丰度分布雷达(图5)。

图5 20种药物对2019、2020年嗜冷黄杆菌的最小抑菌浓度个数分布Fig.5 The distribution of minimum inhibitory concentrations to 20 drugs of F.psychrophilum strains in 2019 and 2020
由图5a 可见,2020 年嗜冷黄杆菌对ENRO、FLUQ、OXO、LVX、AMI、GEN、OXY、AMP、RIF 九种药物的敏感性较高,大部分MIC≤0.125 µg/mL;而分离株对TMP、STR 的敏感性则大部分偏低,MIC 分别为16µg/mL 和32µg/mL。
由图5b 可见,2019 年嗜冷黄杆菌对ENRO、AMI、OXY、RIF 四种药物的敏感性较高,大部分MIC≤0.125 µg/mL;而FLUQ(50%分离株)、OXO 两种药物的敏感性则较低,MIC 为8 µg/mL;FLUQ(50%分离株)、TMP两种药物的MIC为16µg/mL;STR的MIC最高,为32µg/mL。
由图5a和5b结果可见,近两年嗜冷黄杆菌分离株均对TMP和STR的敏感性偏低,分别为16µg/mL和32µg/mL;而2019年分离株对FLUQ及OXO两种药物的敏感性明显低于黑龙江省分离株。
3 讨 论
嗜冷黄杆菌感染可引发鲑鳟细菌性冷水病,给全世界的鲑鳟养殖造成重大损失[28-30]。本研究按照CLSI 执行标准[26],选用MIC 值进行区分和比较分析9 大类20 种水产药物对我国东北地区鲑源嗜冷黄杆菌分离株药物敏感性,较前人采用MIC与MBC相结合的评估方法[31]获得了更为理想的趋势和数据,也筛选出了受试菌株的敏感性药物。CLSI给出了以参考菌株大肠杆菌(Escherichia coli)(ATCC25922)和杀鲑气单胞菌(Aeromonas salmonicida)(ATCC33658)为代表的8 种药物阈值标准[26]。从而掌握我国现行嗜冷黄杆菌分离株药敏特性及其变化趋势,同时也为完善多种药物阈值标准提供参考依据。
本研究中分别有81.9%和100%的菌株对STR 和TMP 药物敏感性较低;而有90.9%和100%的菌株对RIF、ENRO 和AOZ 药物敏感性偏高;不同地区分离株对FLUQ、GEN、NEO、TET、CHL 的敏感性差别较大。说明东北地区鲑源嗜冷黄杆菌分离株对链霉素和甲氧苄啶的药物敏感性下降趋势较严峻,同时多种药物也显示出不同程度的敏感性下降,亟需科学施药。
3.1 β-内酰胺类抗生素——阿莫西林
在智利[16]、丹麦[22]、英国[12]的分离株中,阿莫西林敏感性降低的分离株MIC 分布范围分别为0.016~128µg/mL、0.5~4µg/mL和1~4µg/mL,菌株占比最大的MIC数值也不尽相同,分别为0.032,1,2 µg/mL,可以看出智利分离株对阿莫西林的药物敏感性明显高于英国和丹麦分离株。而在土耳其25 株嗜冷黄杆菌分离株的体外敏感性均未降低[32]。本研究结果表明,我国11 株鲑源嗜冷黄杆菌对阿莫西林的MIC 数值主要集中在1 µg/mL,和英国分离株药物敏感性一致,高于智利分离株,而低于丹麦分离株。
3.2 大环内酯类抗生素——红霉素
在欧洲、美国和土耳其等国家和地区,红霉素在水产养殖中是禁用的[22],但在这些地方仍有嗜冷黄杆菌分离株对其药物敏感性降低的现象。Smith等[11]和Ngo等[12]报告,来自英国和丹麦的所有分离株对红霉素的药物敏感性均有所降低,MIC数值分布范围分别为0.5~4µg/mL和0.5~8µg/mL,MIC数值均主要集中在2µg/mL。在土耳其Saticioglu等[32]的报告中,有20%的菌株对红霉素的药物敏感性降低,而本试验中的嗜冷黄杆菌对红霉素的MIC数值主要集中在0.25~2µg/mL,与英国、丹麦分离株的耐药水平相近。
3.3 氯霉素类抗生素——氟苯尼考
在大多数国家,FFC 是治疗嗜冷黄杆菌感染的首选药物[32],来自智利[16]、美国[17]、丹麦[11]、英国[12]共428株嗜冷黄杆菌分离株的研究中,仅有2 株来自智利[16]的分离株(<0.5%)被报道为敏感性降低的菌株。而本研究中,嗜冷黄杆菌分离株的MIC 值较小,药物敏感性均高于国外。中国嗜冷黄杆菌对氟苯尼考的MIC 值最高限低于国外4~8倍,但2020年也出现了敏感性降低趋势,MIC 值为1µg/mL 的菌株数增多,这样的结果可能与近年来FFC在水产养殖中的高效广泛使用有关。
3.4 喹诺酮类抗生素
除美国不允许在食用动物中使用喹诺酮类药物外,许多国家已使用喹诺酮类药物治疗嗜冷黄杆菌感染[17,22]。然而,随着敏感性降低的菌株越来越多地出现,药物防治效果大幅下降,导致近年来这类药物的使用有所减少。在2016 年与2018 年Smith 等[11]和Ngo 等[12]报告来自英国和丹麦的菌株大多出现了药物敏感性降低的现象,对FLUQ 的MIC 最高值均为4µg/mL。Miranda 等[16]研究显示,智利的嗜冷黄杆菌对FLUQ 的MIC 最高值为0.5µg/mL。本研究中,黑龙江省嗜冷黄杆菌对ENRO、FLUQ、OXO、LVX 的MIC都主要集中在≤0.125µg/mL,但部分菌株对FLUQ 的MIC 最高值达到16µg/mL,药物敏感性低于智利[16]、丹麦[11]、英国[12];吉林省分离株的MIC值集中在2~8µg/mL,对喹诺酮类药物均出现了较低药物敏感性,且FLUQ 的药物敏感性明显低于其他3种药物。值得注意的是,黑龙江省大部分分离株对OXO 的药物敏感性较高,两省份均出现了药物敏感性降低的趋势。
3.5 四环素类抗生素
四环素类药物已广泛应用于人医和兽药,在畜牧业中用作生长促进剂,在农业和水产养殖中用作防治药物。由于药物的不科学不合理使用,四环素药物敏感性降低的现象几乎已经扩散到所有的细菌种属[13,32],而OXY为嗜冷黄杆菌防治的常用药物[34]。2016年,智利、英国和丹麦分别有70%和46%的嗜冷黄杆菌分离株对OXY 敏感性降低[16,22];而2018 年英国又有报道指出58%的嗜冷黄杆菌的药物敏感性升高[29];2017年Van 等[17]研究来自美国某地的菌株,对OXY 的MIC 最高值为8µg/mL。Kum 等[6]发现土耳其分离的嗜冷黄杆菌对OXY 的药物敏感性极低(75%)。本试验中我国东北地区临床分离的嗜冷黄杆菌对OXY 的MIC 均小于2µg/mL,显著低于智利[16]、丹麦[22]、美国[17]和土耳其[6],与2018 年英国试验菌株MIC 最大值持平。
3.6 氨基糖苷类抗生素
嗜冷黄杆菌对氨基糖苷类药物的药敏试验结果较少,Kum 等[6]在土耳其采用平板扩散法和琼脂稀释法均表明20 株嗜冷黄杆菌菌株对GEN 具有抗性(平板扩散法:70%;琼脂稀释度:95%),2017 年Van Vliet 等[17]在美国密歇根州观察到GEN 的MIC 值呈单峰分布,最常见的MIC 为0.12 µg/mL,大多分布在0.06~2 µg/mL。本试验中,63.5%的嗜冷黄杆菌分离株对GEN 的MIC 值分布在0.25~8µg/mL,最常见的MIC 为0.25µg/mL,低于美国分离株的药物敏感性。黑龙江省62.5%的分离株的MIC 为0.25µg/mL,MIC最高值高达8µg/mL;吉林省33.3%的分离株的MIC 为≤0.125µg/mL 和8µg/mL,黑龙江省和吉林省分离株的药物敏感性均低于美国。2019年有33.3%分离株对GEN的MIC≤0.125µg/mL,2020年42.9%分离株的MIC为0.25µg/mL,呈现逐年增长趋势。
3.7 其他类抗生素
利福平在防治嗜冷黄杆菌的应用较少,在本试验中,绝大多数分离株的MIC≤0.125µg/mL,但2019—2020年,分离株对RIF的MIC≤0.125µg/mL占比从100%降至85.7%,药物敏感性有一定降低。
虽然呋喃唑酮已被列为水产禁用药物,但由于前期病害防控或人类及动物的药物使用导致水体或土壤中有药物残留,因此试验中也将水产禁药对嗜冷黄杆菌的MIC值进行了比较分析,以确定细菌对药物的敏感性是否发生变化。在本实验中100%的分离株MIC均已≤1µg/mL,2019—2020年AOZ的MIC为1µg/mL 的菌株占比由50%降至42.9%,药物敏感性略有升高趋势,也应加强监测检测力度,确保水环境无污染及残留。
磺胺类抗生素中,2018 年英国有36%的分离株对磺胺甲恶唑-甲氧苄啶较敏感[12],而2008 年土耳其分离株则呈现100%耐药[6]。本试验中,所有分离株对TMP 的MIC 均分布在8~16µg/mL,药物敏感性介于英国和土耳其分离株之间,且不同来源分离株均出现了药物敏感性降低的趋势,可能与近年来药物的广泛使用有关,应引起重视。
4 结 论
本研究表明我国东北地区临床分离的鲑源嗜冷黄杆菌对呋喃唑酮(AOZ)、恩诺沙星(ENRO)和土霉素(OXY)较敏感,但由于呋喃唑酮、土霉素为水产禁用药,故在鲑鳟鱼养殖过程中建议选用恩诺沙星来防治嗜冷黄杆菌引起的细菌性冷水病。研究结果对于我国鲑鱼养殖中BCWD的科学防控具有重要参考价值。
致谢:中央级公益性科研院所基本科研业务费专项(HSY201902Q)和中国水产科学研究院冷水性鱼类病害防控创新团队项目(2020TD43)同时对本研究给予了资助,谨致谢意!

