复合微生物发酵饲料对肉鸡生长性能、屠宰性能及免疫功能的影响
熊志伟,熊忠华,周光斌,陈 晨,章高维,徐田放,王飞兵,杨 艳,姜文娟,曹华斌,杨 帆*
(1.江西农业大学 动物群发性疾病监测与防治研究所,江西 南昌 330045;2.江西农业大学 农学院,江西 南昌330045;3.江西省宜春市丰城市农业农村局,江西 宜春 331199;4.厦门海关技术中心,福建 厦门 361013;5.江西瑞博特生物科技有限公司,江西 抚州 344400;6.江西省农业技术推广中心,江西 南昌 330096;7.江西省抚州市金溪县农业农村局,江西 抚州 344800)
【研究意义】抗生素是指一类具有抗病原体或其它活性的一类次级代谢产物,在促进畜禽生长和防治畜禽疾病等方面具有显著功效,曾被广泛应用于畜牧养殖业中。然而,由于抗生素的不规范、不合理使用而导致的药物残留、“超级细菌”等问题逐渐显露[1]。2019 年7 月10 日,农业农村部出台“禁止抗生素在饲料中添加”的相关规定,有效遏制了国内抗生素滥用的问题。因此,为满足现代化规模养殖需求,寻求抗生素“替代物”已成为当下畜牧养殖业的热门话题。而具有无残留、无副作用、促生长等优点的益生菌也成为抗生素的“替代物”之一,其中乳酸菌(Lactobacillus beijerinck)是最具代表性的益生菌类替代物。【前人研究进展】乳酸菌(L.beijerinck)是一类能将碳水化合物转化成大量乳酸的革兰氏阳性菌的统称,具有促进肠道中有益菌群增长、提高畜禽免疫力的功能[2]。谢童等[3]发现对肉鸡饲喂不同浓度的复合乳酸菌制剂均能提高肉鸡的免疫器官指数以及降低料重比。酵母菌(Saccharomyces)是一类真核细胞微生物,其在提高畜禽免疫力、生产性能方面具有良好的作用效果[4]。此外,酵母菌(Saccharomyces)富含多种营养物质、活性因子和消化酶,可显著提高肉鸡生长性能和屠宰性能,因而被广泛应用于肉鸡养殖[5]。光合菌(Photosynthetic bacteria)是一类能进行光合作用但不产生氧气的原核微生物,能够合成糖、氨基酸及维生素等物质,具有一定的营养价值[6]。早在20 世纪90 年代就有学者提出饲喂光合菌(P.bacteria)能够促进肉鸡生长、增强其免疫力[7]。研究表明,在畜禽养殖生产中,复合菌种益生菌的应用比仅含单一菌种益生菌的应用有更好的作用效果[8]。目前,复合益生菌在畜禽生产中可应用于饲料的发酵以提高饲料的适口性、营养利用率、畜禽生长性能和肉品质[9]。刘泽等[10]研究发现,Z 型鸭饲喂复合益生菌[含有解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)及地衣芽孢杆菌(Bacillus licheniformis)]发酵饲料能够促进营养物质消化吸收并降低养殖成本以提高经济效益。此外,雪峰乌骨鸡饲喂复合益生菌[含有酵母菌(Saccharomyces)、枯草芽孢杆菌(B.subtilis)、植物乳杆菌(Lactobacillus plantarum)及屎肠球菌(Enterococcus faecalis)]发酵饲料可提升日粮养分表观消化率和肉品质[11]。【本研究切入点】饲喂不同复合益生菌发酵处理的饲料对改善畜禽的生长性能、免疫功能及营养代谢水平的作用效果具有差异性[12]。因此,饲喂含有乳酸菌(L.beijerinck)、酵母菌(Saccharomyces)和光合菌(P.bacteria)的复合微生物菌剂发酵饲料对肉鸡机体生长、胴体品质及免疫功能的影响值得进一步探究。【拟解决的关键问题】本研究通过对肉鸡饲喂添加不同剂量复合微生物菌剂的发酵饲料,探究复合微生物发酵饲料对肉鸡生长性能、屠宰性能、免疫功能及营养代谢水平的影响,以期为复合微生物菌剂在家禽养殖中的应用提供实践指导及新思路。
1 材料与方法
1.1 试验材料
试验所用复合微生物菌剂(RBM 微生物菌剂)由江西瑞博特生物科技有限公司提供,其成分、比例及含量为:球形红假单胞菌(Rhodopseudomonas sphaeroides)、酿酒酵母菌(S.cerevisiaeHansen)及双歧双歧杆菌(Bifido bifidobacterium bifidum)按照1∶2∶1.8 的比例配制,总活菌数>2.0×107CFU/g。参考孙波等[13]的方法,将相应剂量的复合微生物菌剂加入到一定体积的水中并与饲料搅拌混匀使饲料湿度达到40%,后将其置于塑料桶中密封室温培养发酵24 h,发酵后的饲料进行烘干处理,所得发酵饲料即为复合微生物发酵饲料。预试期7 d,正试期60 d。以NRC(1994)肉鸡营养标准为参考配制基础饲粮,详见表1。
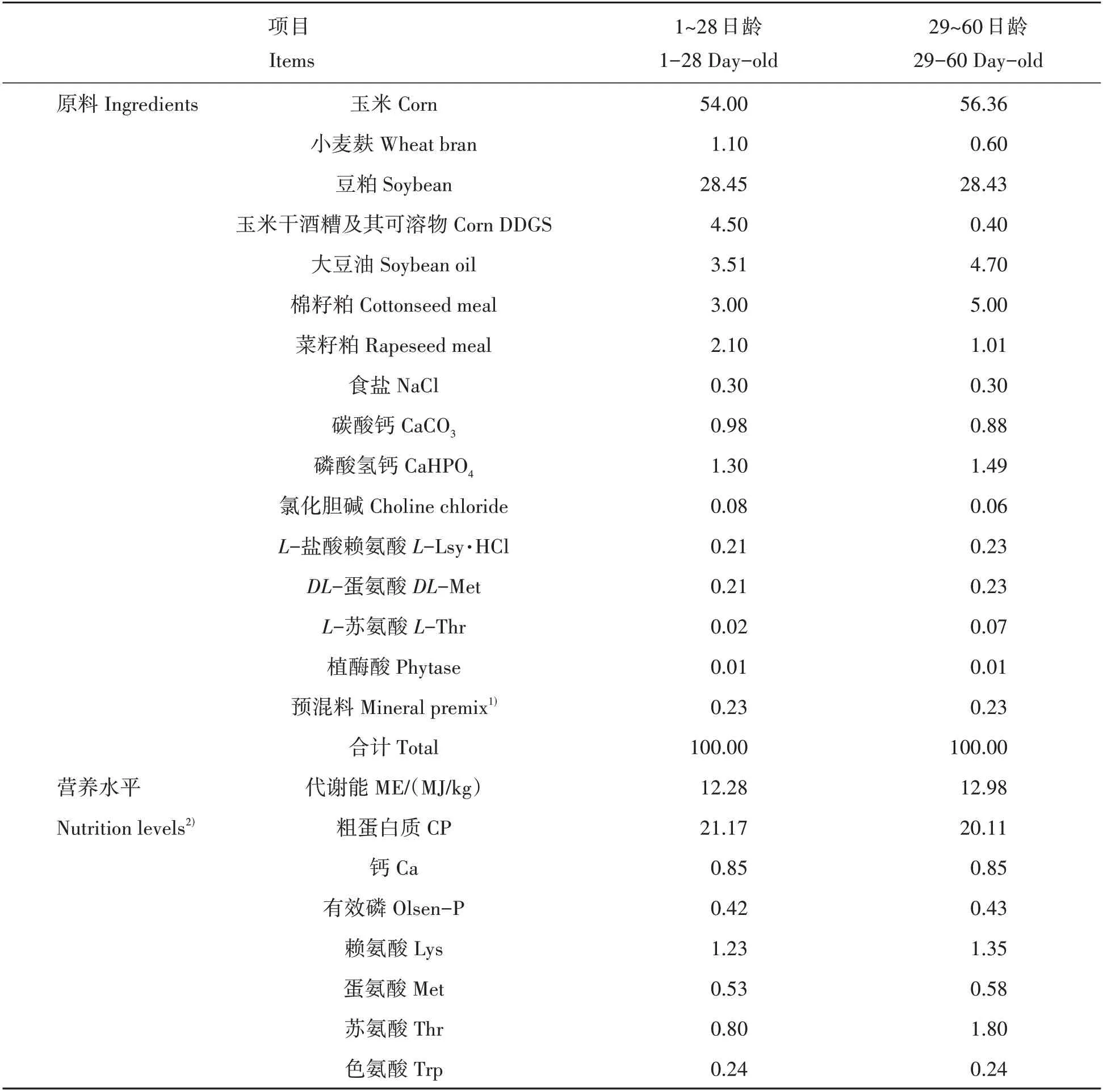
表1 基础饲粮配方及营养水平Tab.1 Basic diet formula and nutrition levels %
1.2 试验设计
试验将480 只1 日龄健康的爱拔益加(Arbor Acres,AA)肉鸡随机分成4 组,每组8 个重复,每个重复15 只。对照组饲喂基础饲粮,0.2%、0.3%、0.4%发酵组在每千克基础饲粮中分别添加2,3,4 g 的复合微生物菌剂进行发酵。
1.3 饲养管理
试验期间,所有鸡只在温度(28±7)℃和湿度(60±5)%适当的环境中饲养,严格控制12 h 光照周期,每7 d进行舍内消毒,并遵循肉鸡免疫程序[14],于1、7、14、28日龄分别接种鸡马立克疫苗、鸡新城疫疫苗、鸡法氏囊疫苗、鸡新城疫疫苗和鸡法氏囊疫苗进行免疫。
1.4 样品的采集与制备
饲养结束(60日龄),每组选取8只体质量相近且健康的鸡只进行称量、翅静脉采血。每只鸡采血10 mL于普通采血管中,4 ℃下3 000 r/min离心10 min制备血清,-80 ℃保存待测。随后,对鸡只进行处死、屠宰处理,并剖取屠体、胸腺、腿肌、胸肌、法氏囊及脾脏进行称量,测定胴体性状及免疫器官指数。
1.5 检测指标及方法
1.5.1 生长性能的测定 参照张敏等[15]的方法,计算试验期间肉鸡的平均日增重(Average daily gain,ADG)、平均日采食量(Average daily feed intake,ADFI)和料重比(Feed/Gain,F/G)。试验第1,15,30,45,60 天肉鸡以每个重复为单位,对鸡只进行空腹称量,计算ADG。试验期间,记录给料量和余料量,计算ADFI。通过所得ADG与ADFI计算F/G。计算公式如下:

1.5.2 免疫器官指数的测定 参照戴晋军等[16]的方法,对肉鸡进行屠宰后,剖取胸腺、脾脏及法氏囊,在去除脂肪组织并用滤纸吸去各器官上的血液后称量,并按下列公式计算免疫器官指数:
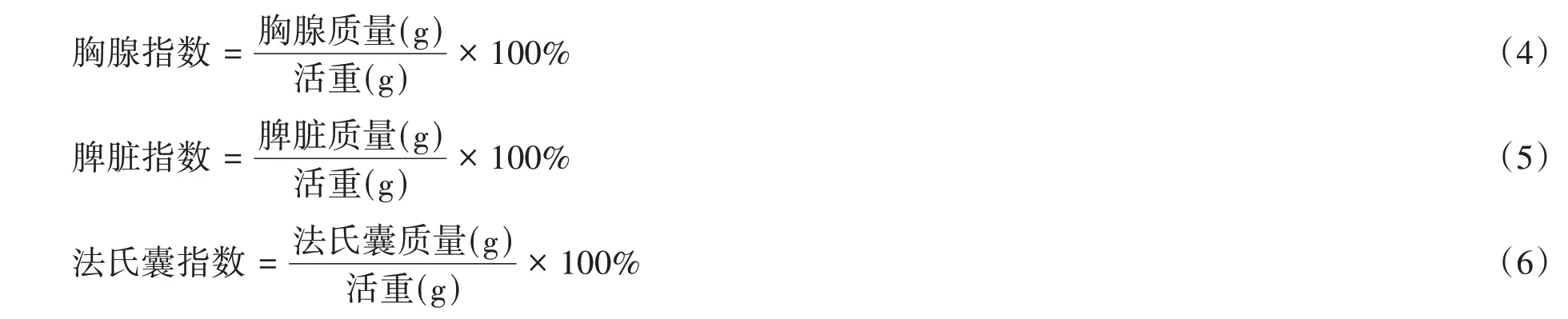
1.5.3 胴体性状和肉品质的测定 对肉鸡进行屠宰后,剖取其屠体并称取屠体重,计算屠体率。将屠体去除部分内脏后称量,计算半净膛率。屠体去除全部内脏后称量,并计算全净膛率。完整取下胸肌、腿肌并进行称量,计算胸肌率、腿肌率。测定方法参照《家禽生产性能名词术语和度量统计方法》(NY/T823—2020)。取左侧胸肌测定24 h 滴水损失,并计算24 h 滴水损失率,方法参照《畜禽肉质的测定》(NY/T1333—2007)。计算公式如下:

1.5.4 血清免疫球蛋白含量的测定 通过酶联免疫吸附实验(ELISA)测定血清中免疫球蛋白A(Immunoglobulin A,IgA)、免疫球蛋白M(Immunoglobulin M,IgM)的含量,试剂盒购自上海酶联生物科技有限公司,测定和计算方法按照说明书进行。
1.5.5 血清生化指标测定 使用全自动生化分析仪(日立7600)测定血清中总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、高密度脂蛋白(High density lipoprotein,HDL)、低密度脂蛋白(Low density lipoprotein,LDL)、尿素(Urea,UREA)、三酰甘油(Triacylglycerol,TG)、天冬氨酸氨基转移酶(Aspartate transaminase,AST)和胆固醇(Cholesterol,CHO)的水平。上述指标测定所需相应的试剂盒购自美康生物科技股份有限公司(货号分别为:MK102、MK103、MK203、MK207、MK106、MK201、MK002、MK202)。
1.6 数据处理
通过Excel 2016 对数据进行初步的分析,生长性能、屠宰性能及血清生化指标等数据通过“平均值±标准差”的形式来表示,并使用SPSS 22 软件对数据进行单因素方差分析(one-way ANOVA),根据Duncan’s法进行多重比较分析。通过Prism 8.0软件制作免疫功能相关指标的柱状图。P值用于判断差异显著性,P>0.05表示无显著差异,而P<0.05为显著差异,P<0.01为极显著差异。
2 结果与分析
2.1 发酵饲料对肉鸡生长性能的影响
由表2 可知,各组间肉鸡初始体质量无显著差异,而0.2%、0.3%、0.4%发酵组肉鸡的终末体质量与对照组相比分别显著提高11.8%、6.8%和5.9%(P<0.05)。在1~15 d 中,0.2%、0.3%、0.4%发酵组肉鸡的ADG 比对照组显著提高14.9%、7.9%和3.2%(P<0.05 或P<0.01),ADFI 与对照组相比无显著差异(P>0.05),F/G 较对照组显著降低12.8%、7.6%和3.8%。在16~30 d 中,0.2%、0.3%、0.4%发酵组肉鸡的ADG 与对照组相比显著升高(P<0.05),并分别提高18.6%、18.4%和21.6%,ADFI 较对照组则分别显著提高10.4%、9.5%和13.1%(P<0.05),F/G 与对照组相比显著降低6.5%、7.2%和7.2%(P<0.05)。在31~45 d 中,0.2%发酵组肉鸡的ADG 与对照组相比显著提高13.9%(P<0.05),F/G 较对照组显著降低8.8%(P<0.05)。在46~60 d 中,0.2%、0.3%、0.4%发酵组的ADG、ADFI 和F/G 较对照组均无显著变化(P>0.05)。在1~60 d 中,与对照组相比,0.2%、0.3%、0.4%发酵组的ADG 显著升高(P<0.01),并分别提高12.1%、7.0%和6.1%,ADFI 分别显著提高3.8%、2.3%和1.4%(P<0.05),而F/G 与对照组相比显著降低7.4%、5.2%和4.6%(P<0.05)。
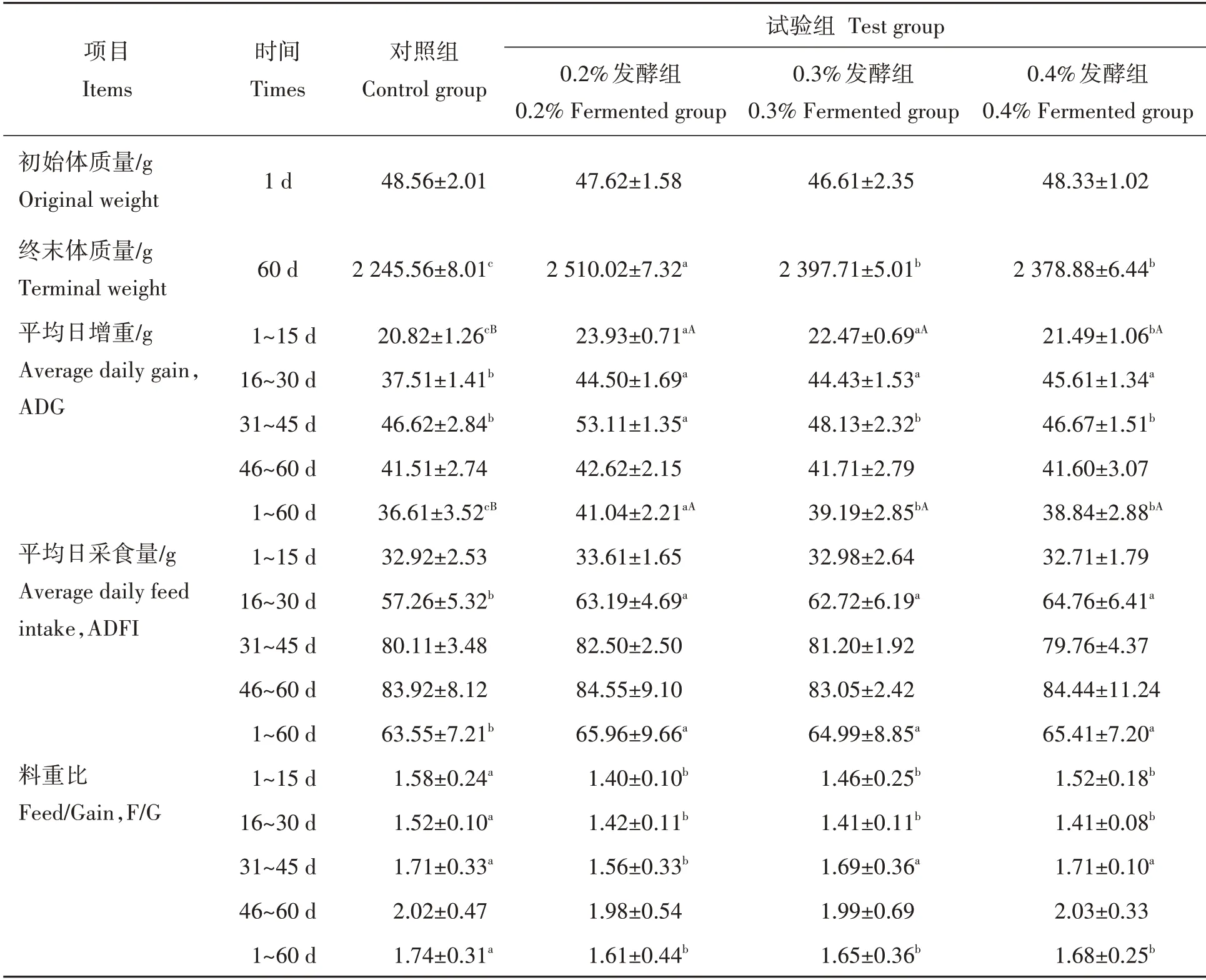
表2 发酵饲料对肉鸡生长性能的影响Tab.2 Effects of fermented diets on growth performance of broilers
2.2 发酵饲料对肉鸡屠宰性能及肉品质的影响
由表3 可知,与对照组相比,0.2%、0.3%、0.4%发酵组肉鸡的屠宰率、胸肌率、全净膛率、半净膛率和腿肌率显著升高(P<0.05 或P<0.01),而24 h 滴水损失率显著降低(P<0.05)。其中,0.2%、0.3%、0.4%发酵组肉鸡的屠宰率分别提高1.8%、2.5%和2.1%;全净膛率分别提高4.4%、4.4%和4.8%;半净膛率分别提高3.8%、3.7%和3.2%;胸肌率分别提高1.8%、1.7%和1.8%;腿肌率分别提高1.6%、1.5%和1.2%;滴水损失率分别降低3.1%、3.1%和3.3%。
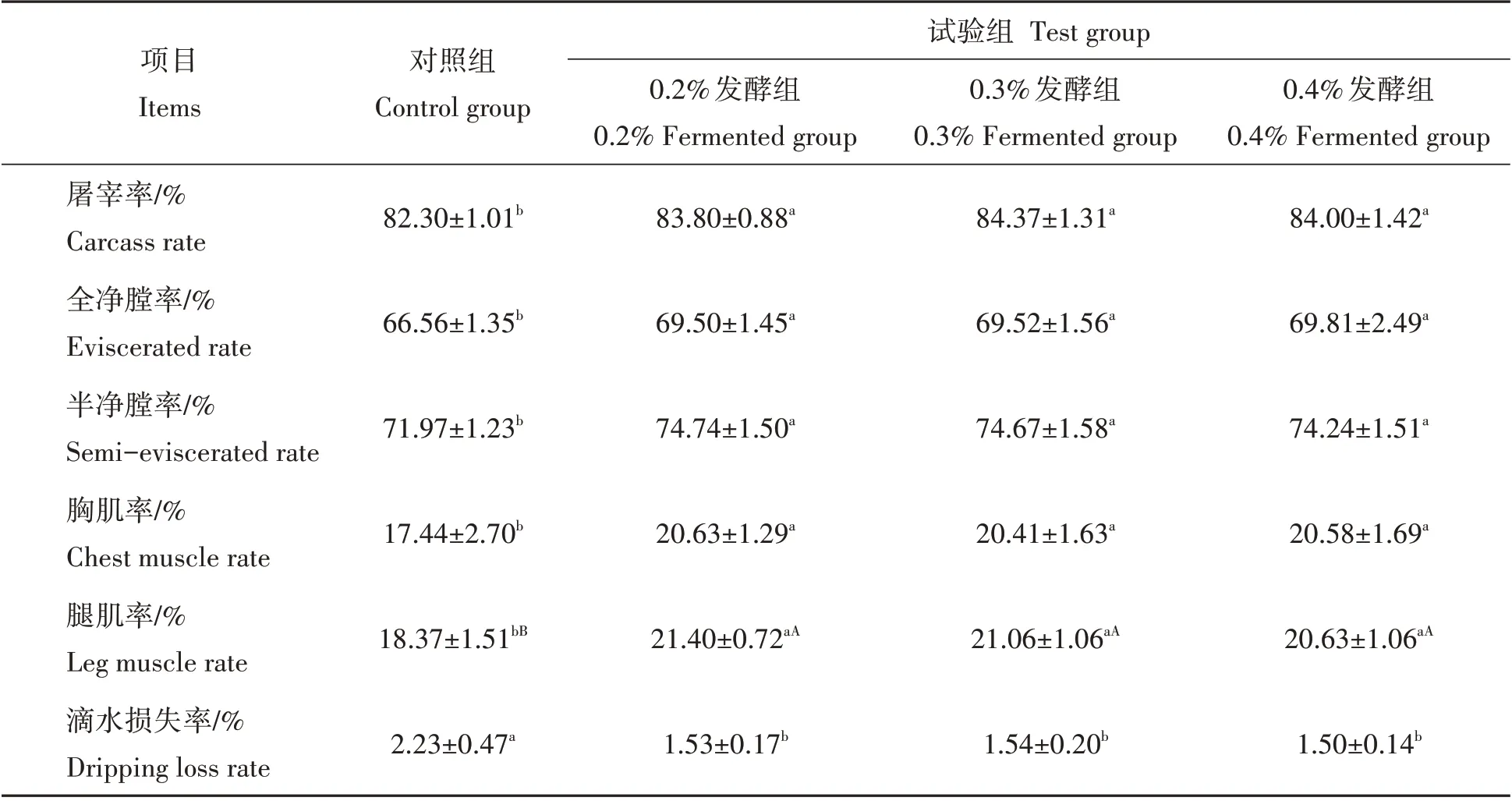
表3 发酵饲料对肉鸡屠宰性能及肉品质的影响Tab.3 Effects of fermented diets on slaughter performance and meat quality of broilers
2.3 发酵饲料对肉鸡免疫功能的影响
由图1 可知,0.2%、0.3%、0.4%发酵组的脾脏、胸腺和法氏囊指数较对照组显著升高(P<0.05 或P<0.01)。由图2 可知,与对照组相比,0.2%、0.3%、0.4%发酵组血清中IgA、IgM 水平均呈上升趋势,其中0.3%发酵组IgM水平显著升高(P<0.05)。
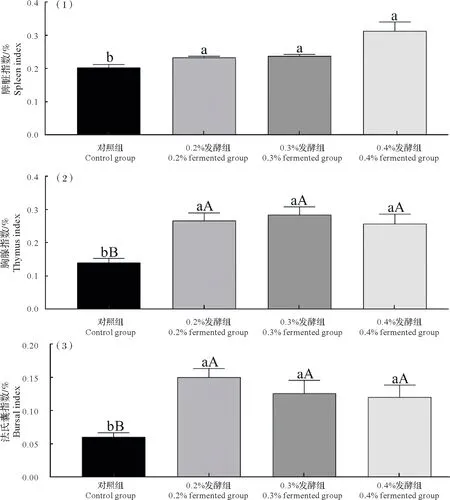
图1 发酵饲料对肉鸡免疫器官指数的影响Fig.1 Effect of fermented diets on immune organ indexes of broilers
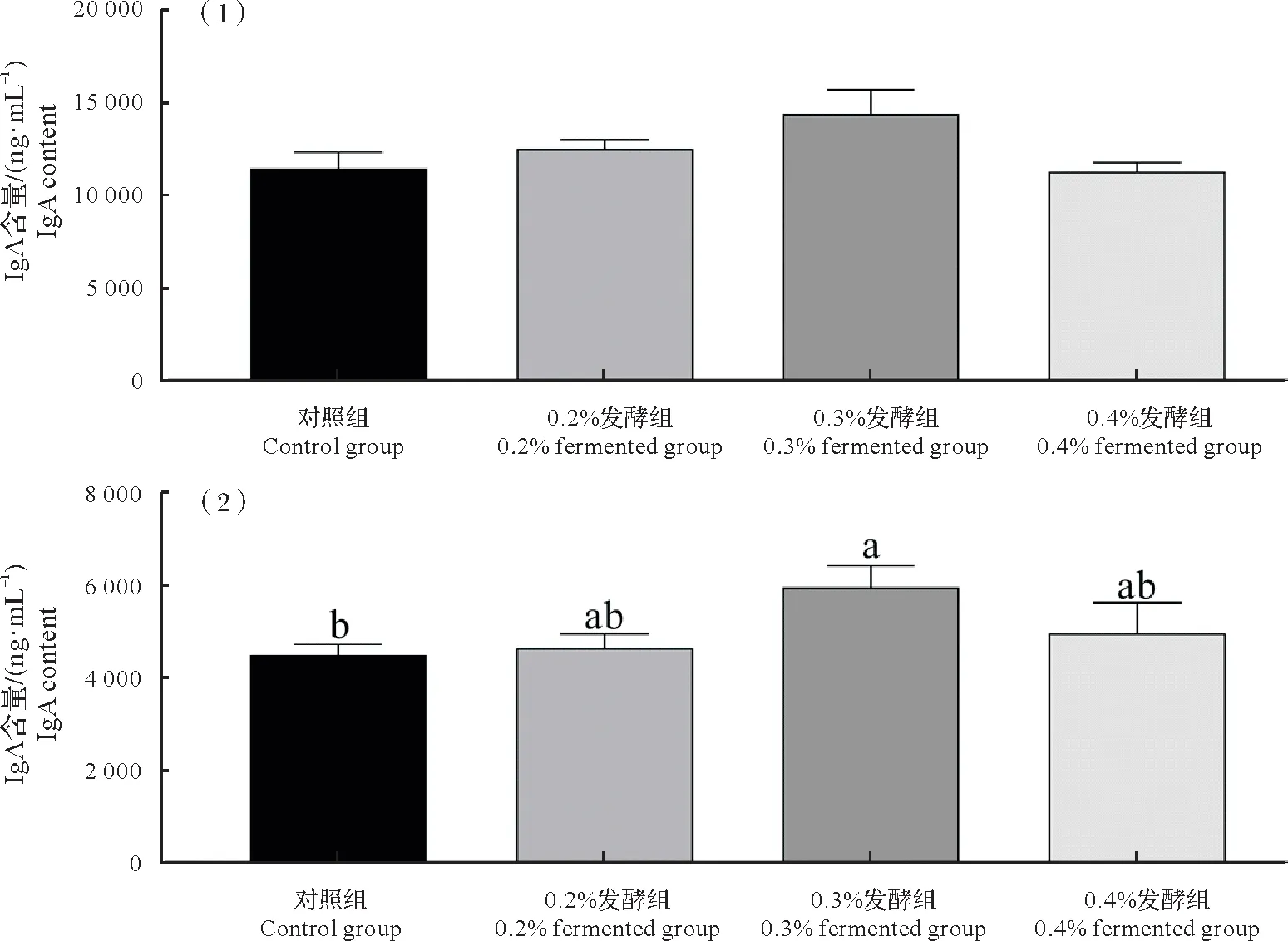
图2 发酵饲料对肉鸡血清免疫球蛋白水平的影响Fig.2 Effects of fermented diets on serum immunoglobulin level of broilers
2.4 发酵饲料对肉鸡血清生化指标的影响
由表4 可知,与对照组相比,0.2%、0.3%、0.4%发酵组血清中TP、HDL 和LDL 含量均显著升高(P<0.05 或P<0.01),ALB 和UREA 含量显著降低(P<0.05),而CHO、TG 及AST 含量则无显著变化(P>0.05)。
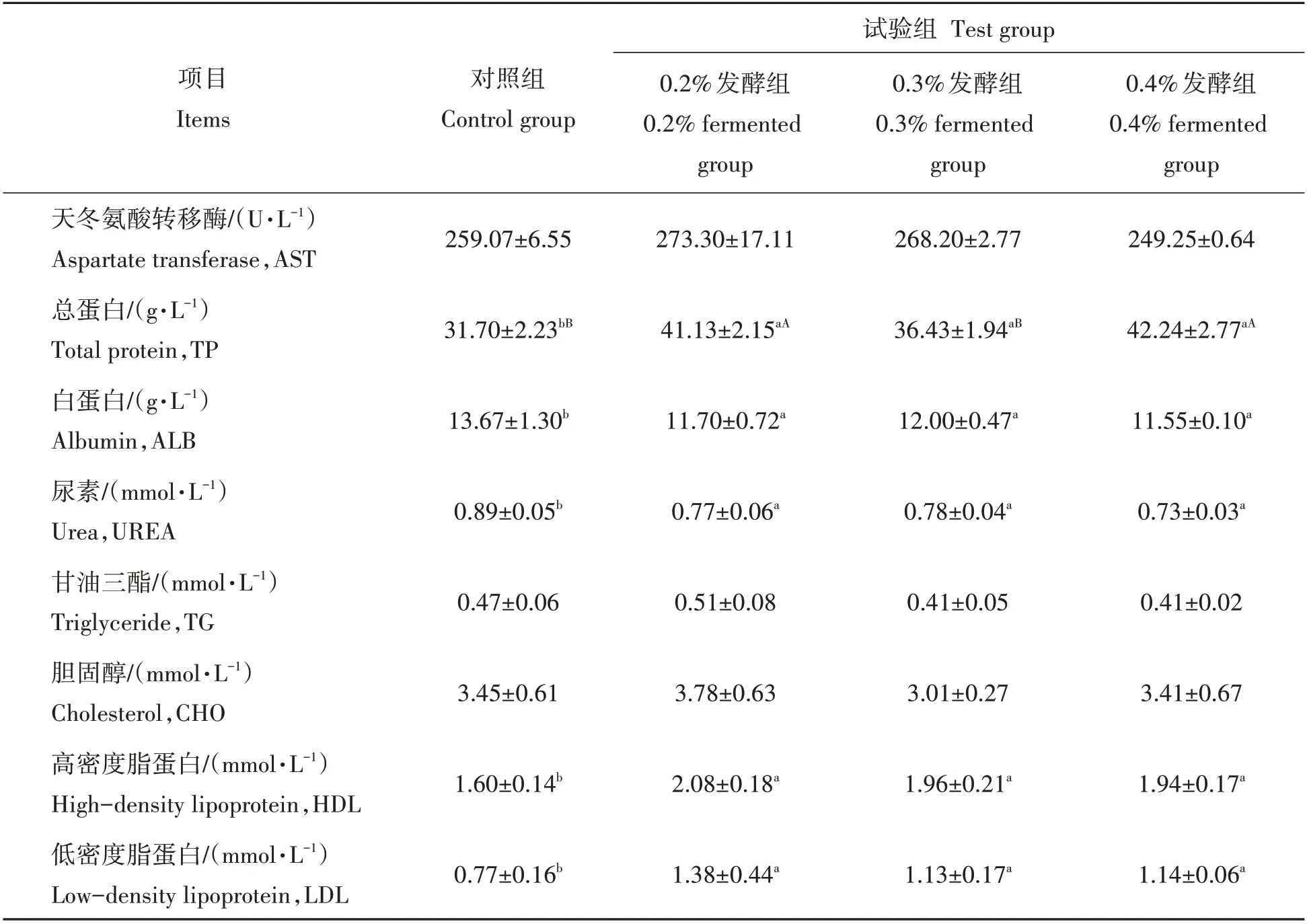
表4 发酵饲料对肉鸡血清生化指标的影响Tab.4 Effects of fermented diets on serum biochemical indices of broilers
3 讨 论
3.1 发酵饲料对肉鸡生长性能的影响
家禽的生长性能是在家禽养殖业中评判养殖效益的重要指标[17]。研究表明,益生菌可通过在机体胃肠道内定殖生长,以产生大量营养物质参与机体的生长代谢,从而促进机体生长发育[18]。与此同时,Lan等[19]研究表明,断奶仔猪饲喂复合益生菌有效提升仔猪的营养物质消化率从而促进仔猪生长。本研究结果表明,饲喂复合微生物发酵饲料能够提高肉鸡的ADG 水平,并降低F/G 的水平。其原因可能是饲料中的蛋白成分经发酵处理后被降解为小肽而易于消化吸收,以及益生菌能促进机体对营养物质的吸收[20]。此外,本研究结果发现,0.2%发酵组的ADG 水平高于0.3%、0.4%发酵组,说明饲喂经适宜浓度复合微生物菌剂发酵的饲料更有益于肉鸡生长,其原因可能与益生菌调控胃肠道微生态机制相关[21]。
3.2 发酵饲料对肉鸡屠宰性能及肉品质的影响
屠宰性能和肉品质是评价生产水平优劣的重要指标[22],其重要性不亚于营养价值和风味水平。研究表明,益生菌主要通过其自身代谢所产生的物质来调节肉鸡的免疫反应和肠道吸收,以达到改善肉鸡屠宰性能及肉品质的目的[23]。谢文惠[24]研究发现,在饲料中添加复合益生菌,且将含有抗菌肽枯草芽孢杆菌(B.subtilis)、酿酒酵母(S.cerevisiaeHansen)、嗜酸乳杆菌(Lactobacillus acidophilus)及乳双歧杆菌(Bifidobaterium lactis)的复合益生菌中嗜酸乳杆菌(L.acidophilus)的比例提高时,肉仔鸡的胸肌率明显得到提升。而本研究结果表明,饲喂复合微生物发酵饲料能够通过提高肉鸡的屠宰率、全净膛率、半净膛率、胸肌率、腿肌率,并降低滴水损失率,以改善肉鸡的屠宰性能及肉品质。该结果与孙波等[13]发现饲喂复合益生菌发酵饲料可改善肉鸡屠宰性能及肉品质的研究结论相似。然而,李渤南等[25]研究结果表明,饲喂由植物乳酸杆菌(L.plantarum)、短小芽孢杆菌(Bacillus pumilus)、酵母菌(Saccharomyces)等菌种组成的复合益生菌对改善肉鸡的屠宰性能无明显作用。因此,笔者认为复合益生菌在家禽养殖中饲料添加的应用效果可能与菌种的种类、含量及饲料工艺相关。
3.3 发酵饲料对肉鸡免疫功能的影响
家禽摄取益生菌后,益生菌能够通过调节肠道菌群结构以激发机体产生免疫因子,从而增强动物机体对病原的抵抗力[24]。禽类胸腺、脾脏和法氏囊的生长发育状态能够直接反映禽类的免疫机能状态。因而其质量和指数的变化可以大致反映鸡只免疫功能的强弱,并且常以此来判断鸡只机体的免疫功能水平[26]。本研究结果显示,肉鸡饲喂复合微生物发酵饲料可提升鸡只的免疫器官指数,说明饲喂复合微生物发酵饲料能够有效促进鸡只免疫器官发育以提高机体免疫力。据研究表明,乳酸菌(L.beijerinck)能刺激模式识别受体与免疫细胞的相互作用进而促进免疫功能的完善,并在促进免疫器官的发育中起到重要作用[27]。因此,笔者认为本试验结果中免疫器官指数升高可能与复合微生物菌剂中的乳酸菌(L.beijerinck)相关。
IgA、IgM 是机体内重要的免疫分子并参与免疫反应[28]。据研究报道,蛋鸭血清中的免疫球蛋白IgA、IgG 及IgM 的含量水平能通过饲喂复合益生菌得到有效提升[29]。本试验结果显示,饲喂复合微生物发酵饲料能够有效提升肉鸡血清中的IgA 和IgM 的含量水平。原因可能是益生菌在动物肠道中合成维生素、氨基酸等物质并作为抗原和营养物质以刺激、促进免疫器官的发育[30]。
3.4 发酵饲料对肉鸡血清生化指标的影响
血清生化指标能够在一定程度上反应机体营养物质代谢水平[31]。因此,监测动物机体血清生化水平在一定程度上能够反应动物的生产性能。TP 包括ALB 和球蛋白(Globulin,GLO),是机体各类营养物质的载体以及蛋白质的主要来源,可反映机体蛋白质代谢和免疫功能的水平[32]。本试验结果显示,0.2%、0.3%、0.4%发酵组的TP含量水平与对照组相比显著升高,表明饲喂复合微生物发酵饲料可提高肉鸡机体蛋白质水平。然而,ALB 含量水平降低的原因则可能与饲喂益生菌后肉鸡肝脏合成蛋白质的能力减弱相关[33]。CHO、TG、HDL 及LDL 作为脂质代谢相关指标,能够有效反应机体脂质代谢水平[34]。其中,HDL 作为CHO 从周围组织向肝组织转运的中间形成体,能够参与机体CHO 的代谢,起到维持体内CHO 正常水平的作用。本试验中,0.2%、0.3%、0.4%发酵组的CHO 含量较对照组无显著变化但HDL 含量升高,说明饲喂复合微生物发酵饲料可提高肉鸡机体CHO 代谢能力但不直接引起体内CHO 水平的变化。UREA 作为动物蛋白质代谢的终末产物,其含量在0.2%、0.3%、0.4%发酵组肉鸡血清中的水平与对照组相比较低。其原因可能为饲喂复合微生物发酵饲料可提高肉鸡机体内尿素的循环利用,以促进机体内蛋白质、多肽及其他含氮物质的合成[35]。因此,本研究表明饲喂复合微生物发酵饲料有助于促进肉鸡机体脂质代谢,并能减少机体蛋白质以代谢的方式流失。
4 结 论
饲喂复合微生物发酵饲料能够有效提升AA 肉鸡的生长性能、屠宰性能和机体免疫力并能改善AA肉鸡的血清生化指标,其中添加0.2%复合微生物菌剂的发酵饲料促生长效果最佳。
致谢:江西农业大学与江西瑞博特生物科技有限公司联合资助项目(9131207745)同时对本研究给予了资助,谨致谢意!

