真菌内生蜡样芽孢杆菌7-1Y的分离鉴定及其功能探索
谭利涛,成 胜,苏 杭,孙正祥,2*,周 燚,2*
(1.长江大学 农学院,湖北 荆州 434025;2.湖北省农林病虫害预警与调控工程技术研究中心,湖北 荆州 434025)
【研究意义】真菌内生细菌(endohyphal bacteria,EHB),是一类生活在真菌菌丝或孢子内的细菌,最早于1970年在丛枝菌根中被发现[1],并于1996年被证实真菌体内存在活的细菌[2]。在长期的进化演变过程中,细菌可以通过某种方式进入到真菌体内并与宿主真菌形成共生体,与宿主共同应答外界环境信号,以此来提高寄主真菌的生存适应能力[3-5]。这对研究微生物多样性以及开发新型生防资源具有重要启示。【前人研究进展】EHB 存在于多种真菌中,但EHB 在不同种类真菌体内的丰度上有差异,在同一科属的真菌中其种类和数量也各不相同[4-7]。EHB 能影响宿主真菌的生长发育与产孢,具体表现在影响真菌孢子的形成与萌发、菌丝生长、代谢产物、环境信号应答及生态位等方面[6,8-10]。其中最具代表性的是《Nature》报道了引起水稻致病的小孢根霉(Rhizopus microsporus),其主要毒素——根霉菌素,不是由真菌自身产生的而是由其内生细菌伯克霍尔德氏菌(Paraburkholderia rhizoxinica)产生的[11];当小孢根霉的内生细菌被脱除后,小孢根霉无致病性且无法正常产孢[12],并且在后续的研究中发现,根霉菌素的合成也离不开宿主真菌的调控,因为根霉菌素的前体物质2,3-环氧乙烷环的合成酶类是由宿主小孢根霉提供的[13]。一系列的发现对研究细菌在调节其宿主真菌的基础生物学中的作用具有里程碑的意义,但是细菌是如何发挥作用的还不清楚,目前仍有许多问题亟待解决。【本研究切入点】植物源内生菌种类数目繁多,分布范围广,是开发新生物农药的宝贵资源库,而有些EHB 能够与植物内生真菌形成共生关系影响宿主的功能,从植物内生真菌中分离出EHB对农业生产具有巨大应用价值。【拟解决的关键问题】课题组前期从盘龙参植株中共分离得到内生菌263 株,其中根系内生真菌共41 株[14]。笔者对41 株真菌总DNA进行16S rDNA 引物序列扩增及细菌高通量测序,筛选到了菌丝内含有多种内生细菌的茎点霉属真菌YZU172013。本文将以YZU172013为材料,分离鉴定其菌丝内生细菌,为后续挖掘YZU172013体内细菌的功能提供依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株及其它材料 盘龙参内生真菌YZU172013(Phomasp.)由长江大学农学院植物与微生物互作研究室保存;蜡样芽孢杆菌ATCC 14579(Bacillus cereus)受赠于华中农业大学微生物杀虫实验室;新鲜桑叶采自于长江大学太湖农场实验基地;各虫龄家蚕购自于市场。
1.1.2 供试试剂 生化试剂基因组DNA 快速抽提试剂盒(细菌)购自于OMEGA 公司;PCR 扩增试剂盒购自于擎科生物科技有限公司;STYO-9 Green-Fluorescent Nucleic Acid Stains 购自于Thermo Fisher 公司;6×Loading Buffer、DNA Marker-D等均购自于华大基因科技有限公司。
1.2 试验方法
1.2.1 盘龙参内生真菌YZU172013 内生细菌的检测 (1)内生细菌16S rDNA 的检测。根据CTAB 法提取盘龙参内生真菌YZU172013 的DNA,然后基于细菌的16S rDNA 序列设计特异引物(ER10:5'-GGCG GACGGGTGAGTAA-3';ER11:5'-ACTGCTGCCTCCCGTAG-3')[15],进行PCR 扩增,扩增后的PCR 产物进行电泳验证,同时送至华大基因科技有限公司进行检测。PCR反应体系和程序见表1。

表1 扩增16S rDNA及AHL基因的PCR程序Tab.1 PCR Procedure for amplifying 16S rDNA and AHL gene
(2)内生细菌DNA 的SYTO-9 染色。参考STYO-9 Green-Fluorescent Nucleic Acid Stains 说明书,将真菌YZU172013培养至产孢,用无菌水洗涤并收集孢子,然后将适量的孢子接入PDB 培养液,28 ℃震荡培养48 h,之后收集由孢子萌发形成的菌丝球,用8.5 g/L NaCl漂洗3次,加入100µL的8.5 g/L NaCl轻轻地悬浮菌体,再加入100µL 10µmol/L SYTO-9 绿色荧光核酸染色剂,混匀后在黑暗中孵育15~30 min,之后样品用ECLIPSE NiU显微镜(尼康,日本)进行荧光染色检测。
1.2.2 内生真菌YZU172013内生细菌的分离 参照Obasa 等[15]的方法,将真菌接种于PDB 中,在28 ℃下180 r/min 振荡培养72 h。收集菌丝体,菌丝体先用无菌水漂洗2 次,再用体积分数75%酒精表面消毒2 min,并用无菌水清洗5 次,取100µL 第5 次冲洗液涂布于LA 培养基上,并在30 ℃下培养过夜,以确定没有细菌污染;用0.5 mL无菌水将表面消毒的菌丝体重悬并使用无菌研钵研磨,随后将100µL的研磨混合物转接到5 mL LB 培养基中(含100µg/mL 的潮霉素),在28 ℃下150 r/min 富集培养4 h;随后涂布于LA培养基上,在28 ℃下培养并观察细菌菌落,挑取单菌落纯化细菌得到单一菌株。
1.2.3 菌株7-1Y 的鉴定 (1)形态学鉴定。采用平板稀释涂布法得到内生细菌在LA 平板上的单菌落,之后根据细菌单菌落的形态特征(颜色、大小、边缘等)初步鉴定;采用革兰氏染色来进一步判断细菌属性;采用扫描电子显微镜(scanning electron microscopy,SEM)观察菌体的微观形态[16]。(2)分子生物学鉴定。根据细菌基因组DNA 抽提试剂盒提取细菌DNA,利用细菌的16S rDNA 通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-TACGGCTACCTTGTTACGACTT-3')进行PCR 反应程序扩增(表1)。PCR产物经10 g/L琼脂糖凝胶电泳鉴定后,进行16S rDNA测序,测序结果在NCBI数据库中进行比对。经16S rDNA 测序初步判断菌株7-1Y 为蜡样芽孢杆菌后,再从NCBI 网站下载蜡样芽孢杆菌类群的特异基因序列——高丝氨酸环内酯酶基因(homoser-ine lactonese gene,AHLgene),基于primer 6 设计特异引物(AHL94:5'-ACTATCAGTTAAACGAAG-3';AHL625:5'-AGGTATGCCAGAAAGTGC-3'),按相关程序扩增目的片段(表1),测序后用MEGA软件(版本7.0)基于邻接法(neighbour-joining,NJ)构建系统发育树,确定其分类地位。
1.2.4 菌株7-1Y 的内生验证 利用细菌的16S rDNA 的特异引物ER10/ER11 及特异引物AHL94/AHL625(表1),同时进行宿主真菌及内生细菌DNA的PCR扩增,检测目的条带,同时PCR产物测序验证。
1.2.5 菌株7-1Y 的功能探索 (1)生理生化特征。参考《伯杰细菌鉴定手册》,在LA 培养基配方的基础上,分别加入10 g/L 羧甲基纤维素钠、5 g/L 可溶性淀粉及15 g/L 脱脂奶粉,依次制成纤维素降解培养基、淀粉水解培养基和蛋白降解培养基,然后用牛津杯制平板,接种7-1Y菌悬液,对菌株进行生理生化特征鉴定,除此之外还包括甘露醇产酸和抗药性等数项生理生化反应的测定[17]。(2)杀虫活性测定。采用注射法及喂饲法初步探究内生细菌7-1Y的杀虫活性[18],家蚕在实验室内用新鲜桑叶人工繁殖一代后备用;7-1Y培养至对数生长期后离心收集菌体,用无菌水漂洗3次,之后用8 g/L NaCl溶液配置成1×107CFU/mL的菌悬液,备用。喂饲实验中,将生长一致的新鲜桑叶浸泡在菌悬液中30 s,阴干后喂饲给家蚕,每12 h观察家蚕情况,统计死亡率,对照为8 g/L NaCl 溶液;注射试验中,从5 龄家蚕的节间膜部位注射1µL 的菌悬液至血淋巴中,每12 h观察家蚕情况,统计死亡率,对照为8 g/L NaCl溶液。
2 结果与分析
2.1 真菌YZU172013内生细菌的检测
2.1.1 菌丝内16S rDNA 的检测 由图1 可知,真 菌YZU172013 的DNA 经 过PCR 扩 增后,能扩到单一且明亮的条带,与目的条带大小基本一致(220 bp),初步说明真菌YZU172013 里面可能含有内生细菌;另外,PCR 产物的测序序列在NCBI 官网上进行Blast 比对后,与蜡样芽孢杆菌(Bacillus cereus)的匹配度达95.22%。
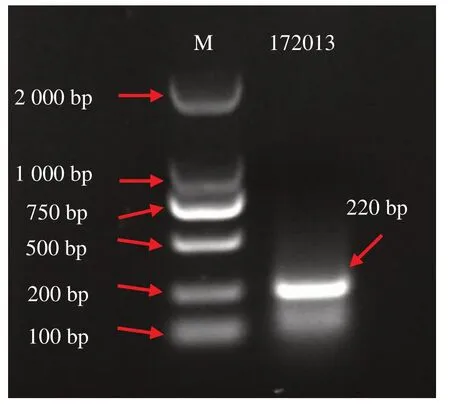
图1 基于ER10/ER11引物对172013中内生细菌16S rDNA的检测Fig.1 Existent detection of 16S rDNA of EHB in 172013 with ER Primers
2.1.2 菌丝SYTO-9 染色 SYTO-9 染色剂是一种绿色荧光活体染色剂,在结合细胞内核酸时可以显示出强烈的荧光,用于染色真核细胞以及G+/G-细菌中的RNA 和DNA。经SYTO-9染色剂染色后,能显著观察到内生真菌YZU172013 菌丝内的细胞核被染色(图2),同时也观察到了菌丝内还存在多个形似细菌DNA 的小点,与Hoffman 等[4]报道的结果一致,进一步证明菌丝内含有内生细菌。

图2 172013基于SYTO-9绿色荧光核酸染色剂的染色Fig.2 Stains of 172013 with SYTO-9 green-fluorescent nucleic acid stains
2.2 菌株7-1Y的分离与鉴定
2.2.1 分离与形态鉴定 真菌菌丝通过漂洗磨碎后得到研磨物,研磨物经富集一段时间后进行稀释涂布,3 d 后观察到形态相似的菌落,产生特殊的气味,挑取单菌落至LB 培养基,命名为7-1Y。菌落近圆形,大而平坦,表面光滑,不透明,边缘不规则呈波浪状,不产色素,前期浅白色,后期变为乳白色,菌落特征与蜡样芽孢杆菌模式菌株ATCC 14579 相似(图3)。革兰氏染色呈紫色,杆状;在扫描电镜观察下,菌体两端平齐呈短杆状,与Bacillus cereusU1s 5 相似[19],菌体大小为(1~1.5)µm×(0.3~0.5)µm,比普通蜡样芽孢杆菌小。

图3 7-1Y在不同条件下的形态特征Fig.3 Morphology characters of 7-1Y under various conditions
2.2.2 分子鉴定 由16S rDNA 序列构建的系统发育树(图4)显示,菌株7-1Y 与模式菌株Bacilus cereusATCC 14579(NR_114582.1)同源性最高,支持率达100%;而基于AHL基因序列的构建系统发育树(图5)表明,与Bacillus cereusSGAir0260(CP028009.1)的亲缘关系最近,同源性达95%。因此,结合形态学鉴定将菌株7-1Y鉴定为蜡样芽孢杆菌(Bacillus cereus)。
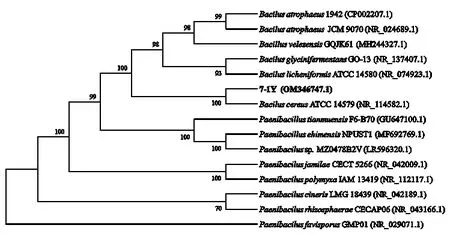
图4 7-1Y基于16S rDNA序列的系统发育树Fig.4 Phylogenetic tree of 7-1Y with 16S rDNA sequences

图5 7-1Y基于AHL基因序列的系统发育树Fig.5 Phylogenetic tree of 7-1Y with AHL gene sequences
2.3 细菌7-1Y的内生性验证
真菌YZU172013 和细菌7-1Y 用ER10/ER11 引物、AHL基因特异性引物扩增,结果表明两菌株均能扩出目的条带(图6),大小与预期一致,测序后结果准确可靠,证实了本文从真菌YZU172013菌丝内分离到细菌7-1Y。
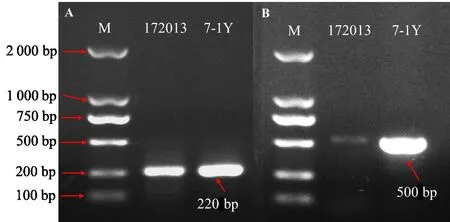
图6 7-1Y基于两对引物的内生验证Fig.6 Endogenous detection of 7-1Y based on two pairs of primers
2.4 菌株7-1Y的功能探索
2.4.1 生理生化特征 如表2 及图7 所示,菌株7-1Y 能在淀粉及纤维素培养基上可产生透明圈而在蛋白培养基及几丁质检测培养基,说明可产生淀粉水解酶、纤维素酶,但不产生胞外蛋白酶及几丁质酶;同时该菌有解磷能力,不能发生硝酸盐还原反应及甘露醇降解反应,无解钾能力;另外其对红霉素、氯霉素及庆大霉素均抗性不高,但对氨苄青霉素的抗性较高,在前3 个药剂的单独使用下(药剂质量浓度分别为30,30,50µg/mL),7-1Y 几乎不能生长,而当氨苄青霉素使用浓度为100µg/mL 时,7-1Y 长势良好,生长未受到抑制。
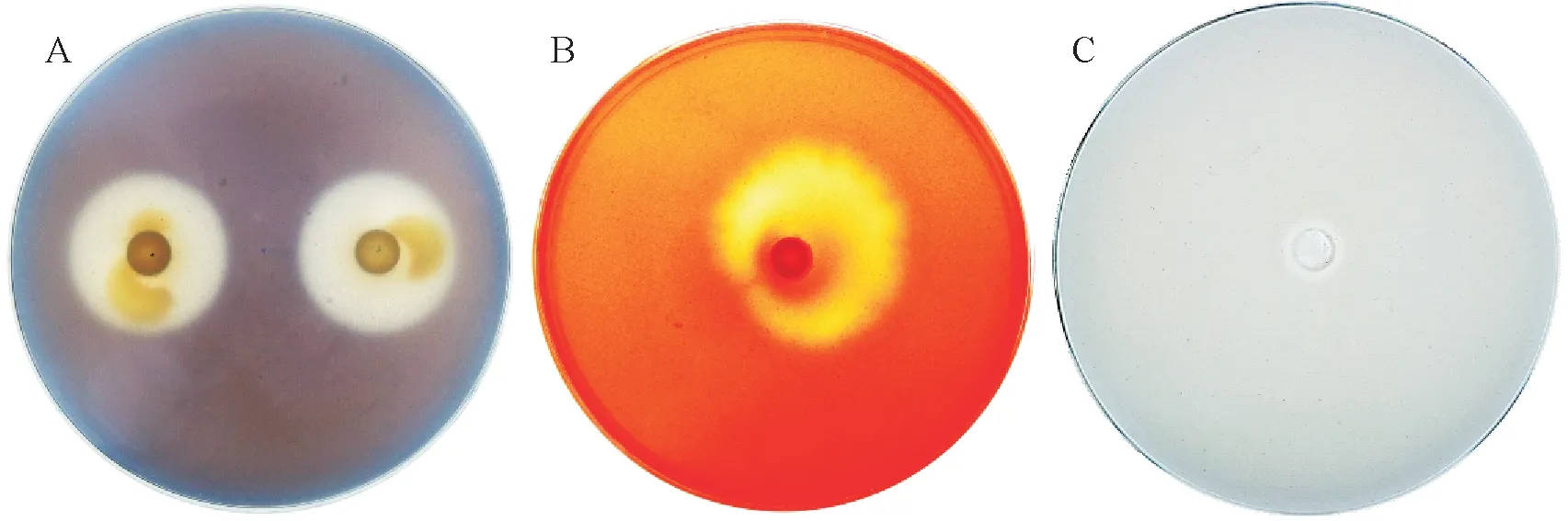
图7 7-1Y的生理生化特征Fig.7 Physiological and biochemical characteristics of 7-1Y solubilization

表2 7-1Y的各项生理生化测定Tab.2 Physiological and biochemical determination of 7-1Y
2.4.2 菌株7-1Y杀虫活性的检测 在喂饲试验中,在喂食过带有菌悬液的桑叶后,处理组家蚕较对照组家蚕活力稍微下降,粪便稀软,其它生长状况基本一致,72 h 及之后未出现致死情况,说明内生细菌7-1Y没有喂饲致死活性。而由图8可知,与8 g/L NaCl溶液对照相比,家蚕在接种菌悬液12 h之后,未死亡家蚕幼虫活性显著下降,进食量减少,而死虫则胸部及伤口发黑,症状严重的全身变黑,且死虫数占总虫数的2/3;在接种菌悬液24 h 之后,处理组家蚕全部死亡,全身变黑发软,与董歆报道结果相似[18],表明7-1Y具有一定的注射杀虫活性。

图8 7-1Y的注射杀虫活性Fig.8 Insecticidal activity of 7-1Y by injection
3 讨论与结论
兰科植物种类繁多,分布广泛,具有很高的药用和观赏价值[20],但兰科植物在自然界中很难独立存活,其生长发育与其菌根真菌密切相关[20-21]。兰科菌根真菌能协助萌发[22],抵御病原真菌及害虫的侵染[23],并协助宿主植物应对干旱及重金属污染等逆境胁迫[24-25],具有多样的生态功能及很强的生防潜力[14]。而真菌内生细菌(endohyphal bacteria,EHB)在真菌体内,能够协助宿主真菌生存[11,13,26],在真菌体外,即自由状态下,也能表现一定的生物学功能[27-28],说明EHB 同样也是潜在的生物资源,值得进一步探索开发。
真菌内生芽孢杆菌的报道并不少见[8,29],但蜡样芽孢杆菌类群中仅有苏云金芽孢杆菌(B.thuringiensis)、炭疽芽孢杆菌(B.anthracis)及蕈状芽孢杆菌(B.mycoides)[30]被报道为EHB。本文从盘龙参菌根真菌成功分离到一株内生细菌,并将该菌为鉴定蜡样芽孢杆菌(B.cereus),首次报道了真菌内生蜡样芽孢杆菌,丰富了EHB的多样性。蜡样芽孢杆菌广泛存在于自然界,能促进植物生长[31],诱导植物系统抗性[32],进行生物降解[33],抵御病虫害[34]等。本文初步探究了7-1Y的生物学功能,发现7-1Y具有水解淀粉及纤维素、解磷、硝酸盐还原等功能,具有很好的生防潜能和应用前景。另外本文还探索了7-1Y的杀虫活性,发现7-1Y不能通过喂饲方式直接杀虫,可能是由于7-1Y的代谢物在中肠没有作用靶标,不能造成中肠穿孔,菌体及其它代谢物无法进入到体液中发挥杀虫作用,但有可能作用于肠道微生物菌群,影响肠道代谢,引起家蚕代谢紊乱;而将7-1Y 注射至家蚕血淋巴中,短时间内能导致家蚕食欲减退,活力下降,能引起昆虫免疫应激反应,导致血细胞破裂从而引起昆虫死亡且虫体发黑变软,说明7-1Y具有注射杀虫活性,有望应用于害虫防治。
虽然本文已经分离到了一株YZU172013 体内的内生细菌,但仍有许多问题未解决。例如,作为盘龙参菌根真菌YZU172013 内生蜡样芽孢杆菌,7-1Y 是否影响真菌的生物学功能,影响YZU172013 与宿主植物之间的共生联系等。此外,不同真菌所含内生细菌的种类及数量各不相同,这可能是由于微量元素等营养因子及物理屏障引起的自我保护机制[4],也有人提出是由真菌自身通过产生活性成分如抗生素或活性氧等免疫防御而导致的[35]。在长期的进化过程中,内生细菌与宿主真菌相互适应有一定的共生双向选择性,真菌是如何容纳细菌而细菌又是怎样进入真菌的具体机制尚不清楚,有待深入研究[36]。笔者将探索内生细菌7-1Y 其在宿主真菌YZU172013 体内的分布状况与定殖机制,并研究7-1Y的代谢产物活性,为解析内生细菌7-1Y 与宿主真菌YZU172013 的共生关系做铺垫,为研究两者在功能上的联系打下基础。

