南城淮山脱毒苗培养及扦插繁种研究
王葡萄,孙静宇,单 楠,朱强龙,肖 遥,张宏玉,陈 欣,胡 锐,黄英金*,周庆红*
(1.江西农业大学 农学院,江西 南昌 330045;2.江西省薯芋生物学重点实验室,江西 南昌 330045)
【研究意义】山药(DioscoreaL.)为薯蓣科薯蓣属攀缘草本植物,其地下块茎营养丰富、药用价值高,是粮、菜、药兼用的特色经济作物[1]。江西是我国道地山药的主产区之一,出产的山药品质上乘,南城淮山是江西省传统名优地方山药品种,2011年获全国农产品地理标志,其产地南城县也是中国三大淮山生产地之一[2]。南城淮山光条和淮山饮片是“建昌帮”中药体系中的当家药材,产品远销东南亚及港台地区[3]。然而,由于南城淮山长期以地下块茎做种,植株病毒累积,造成山药种性不断退化、产量和品质逐年下降,块茎商品率低,严重影响了种植户的积极性[4]。另外南城淮山以可食用部位繁种,成本高,投入大,从而制约了南城淮山的种植规模和产业化发展。开展南城淮山脱毒苗培养及扦插繁种研究,构建其脱毒种薯繁殖技术体系,可为南城淮山种性恢复和健康种薯快繁、工厂化生产提供重要技术支撑。【前人研究进展】现已报道的侵染山药植株的病毒种类主要有山药坏死花叶病毒(yam necrotic mosaic virus YNMV)、山药温和花叶病毒(Yam mild mosaic virus YMMV)、日本山药花叶病毒(Japanese yam mosaic virus JYMV)、马铃薯Y 病毒(Potato virus Y PVY)、马铃薯卷叶病毒(Potato leaf roll virus PLRV)、黄瓜花叶病毒(Cucumber mosaic virus CMV)等[5-7],病毒一般通过粉蚧、蚜虫和机械损伤传播[8-9],感染病毒的山药植株叶片通常表现为脉间花叶、卷曲和发育不良等,从而导致山药块茎产量和品质的下降[10-11]。目前,防治植物病毒病最经济有效的途径是采用茎尖培养获得无病毒种苗。对山药植株茎尖进行离体培养,获得脱毒试管苗,利用脱毒苗繁殖健康种薯,是解决山药病毒病的根本方法之一[12]。
【本研究切入点】近年来,研究人员对铁棍山药、惠楼山药、佛手山药等地方山药品种开展了茎尖脱毒培养相关研究[13-16],表明不同地方品种茎尖脱毒培养条件和培养效果存在较大差异。此外,通过诱导愈伤组织分化产生丛生芽是实现试管苗增殖的常用方法,但一般培养周期长,且常常发生性状的遗传变异[17]。白玉娥等[18]、张映卿等[19]以腋芽为外植体进行微扦插研究,结果表明试管苗生长速度快,繁殖系数高,且遗传稳定性好;再者,扦插技术被广泛应用于作物的快速无性繁殖,近几年研究人员也在陆续探索山药的扦插繁种技术[20-21],为节省山药块茎生产用种开辟了一条新途径。【拟解决的关键问题】为解决南城种源带病毒导致种性退化,缺乏脱毒快繁技术体系等问题,本研究以江西名优特色山药品种南城淮山为研究对象,系统开展其茎尖脱毒培养、脱毒苗微扦插快繁、带叶茎节扦插繁种等研究,旨在为南城淮山脱毒健康种薯获得以及工厂化生产提供技术支撑。
1 材料和方法
1.1 供试材料
选取江西农业大学山药种质资源圃中南城淮山的健壮植株,取其茎蔓腋芽(图1a,图1b)为外植体。
1.2 方法
1.2.1 茎尖脱毒培养 将南城淮山藤蔓腋芽切下,自来水快速冲洗干净,置于超净工作台上,无菌水冲洗1 次,体积分数为75%乙醇浸泡30 s,无菌水洗3~4 次,质量分数为0.1% HgCl2消毒8 min 后,无菌水重复洗3~4 次,于解剖镜下将山药茎尖由外到内剥离至0.2~0.3 mm 大小,随后将剥离的茎尖(图1c)分别接种在添加有0.5 mg/L 6-BA+0.1 mg/L NAA、0.5 mg/L 6-BA+0.5 mg/L NAA、1.0 mg/L 6-BA+0.1 mg/L NAA、1.0 mg/L 6-BA+0.5 mg/L NAA 的MS 培养基上,每种培养基接种20 个,3 次重复,培养30 d 后统计茎尖的成活率与成苗率。
1.2.2 试管苗病毒检测与继代增殖 随机选取大田种植的南城淮山叶片与茎尖培养的试管苗叶片(90 d),利用RNA 提取试剂盒(北京宝日生物科技有限公司)提取RNA,参考TaKaRa 反转录试剂盒进行cDNA 合成。
参照前人报道[22-26]设计相关病毒检测引物(北京擎科生物技术有限公司合成)。PCR总体系为20µL:10µL 2X TSingKe Master mix,2µL cDNA,正向引物0.5µL,反向引物0.5µL,7µL dd H2O。95 ℃5 min;95 ℃30 s,56 ℃30 s,72 ℃30 s,35 个循环;72 ℃10 min,4 ℃保存。通过PCR 扩增得到的PCR 产物,经质量分数为1%琼脂糖凝胶电泳检测并拍照(表1)。
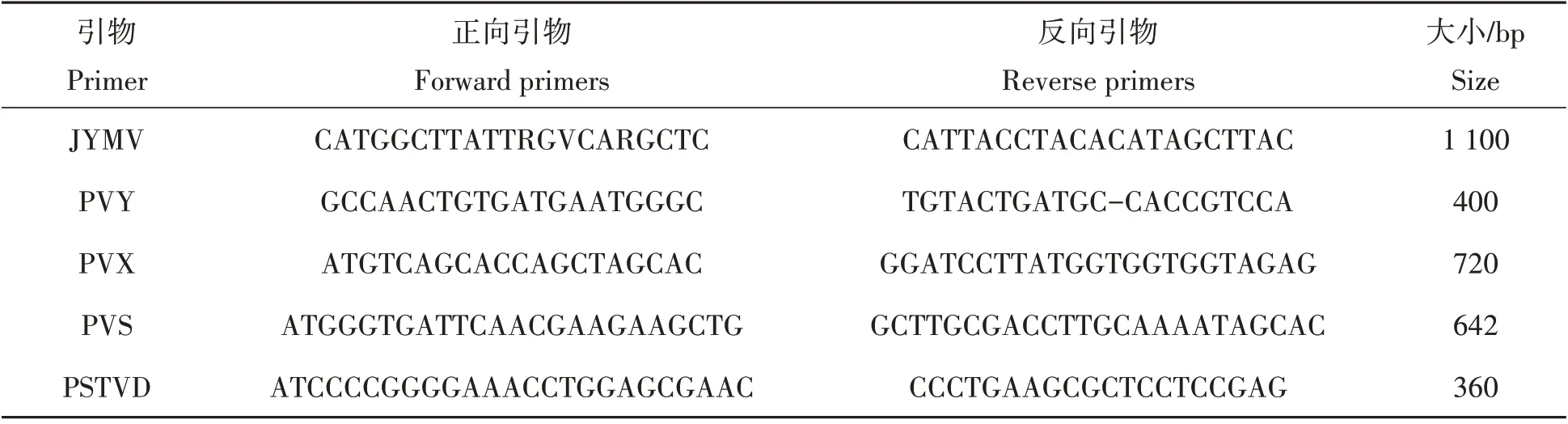
表1 山药病毒类型及引物Tab.1 Virus types and primers of yam
将检测后的脱毒苗接种在4 种添加不同浓度6-BA 和NAA(0.5 mg/L+0.1 mg/L、1.0 mg/L+0.5 mg/L、2.0 mg/L+0.1 mg/L、3.0 mg/L+0.3 mg/L)的MS培养基上,培养60 d后统计脱毒苗增殖系数。
1.2.3 试管苗微扦插快繁 取长至3~5 cm 高长势较好的试管苗,在超净工作台中将带腋芽茎段切下(图2b),分别接种在添加有0.5 mg/L 6-BA+0.5 mg/L NAA、1.0 mg/L 6-BA+0.1 mg/L NAA、1.0 mg/L 6-BA+0.5 mg/L NAA、2.0 mg/L 6-BA+0.2 mg/L NAA 的MS 培养基上,每种培养基接种20 个外植体,重复3 次,待腋芽萌发后长成完整植株,统计生根率;间隔30 d反复进行以上操作,进行规模快繁,每继代1次,调查增殖系数与生根率。此外,在此培养基中分别加入1.5 g/L 活性炭、0.01 g/L VC、0.15 g/L 聚乙烯吡咯烷酮(PVP),每个处理接种20个外植体,重复3次,培养15 d时统计试管苗褐化率。
1.2.4 试管苗移栽与扦插繁种 将微扦插培养的5 cm 高生根试管苗,移栽到基质配比为草炭∶珍珠岩∶蛭石=5∶1∶1 的营养钵中培养(图3a),浇足水分置于培养室中,给予弱光照,保持基质湿润,缓苗后正常管理。30 d后对健壮生长的南城淮山脱毒苗藤蔓(图3b),剪成单叶单节插穗(图3c),各插穗茎节处分别浸泡于0,50,100,150 mg/L NAA 溶液中1 h,后扦插于32 穴育苗盘基质中,基质配比为草炭∶珍珠岩∶蛭石=5∶1∶1,茎节处深入基质下1.5 cm深。每处理浓度扦插20株,每穴扦插1株,重复3次。扦插后及时浇透水,并搭棚遮荫,保持基质及棚内湿度,生根成活后去掉遮阳网,常规管理。扦插14 d时调查插穗生根率,45 d时调查插穗出苗率,120 d时统计新生脱毒薯块的横纵径及质量。
1.2.5 数据分析 采用Excel 2007和SPSS 17.0软件进行数据统计和显著性分析。
2 结果与分析
2.1 不同激素配比对南城淮山茎尖成活率的影响
由表2 可知,不同激素配比对南城淮山茎尖成活率的影响差异显著。南城淮山茎尖在1.0 mg/L 6-BA+0.1 mg/L NAA 的MS 培养基中成活率(85%)显著高于其他培养基,其成苗率也最高,为80%。此外,由图1d、图1e、图1f、图1g 和图1h 可以看出,接种的健康茎尖分生组织在10 d 左右开始转绿,30 d 后明显膨大,60 d时第1片叶长出并展平。
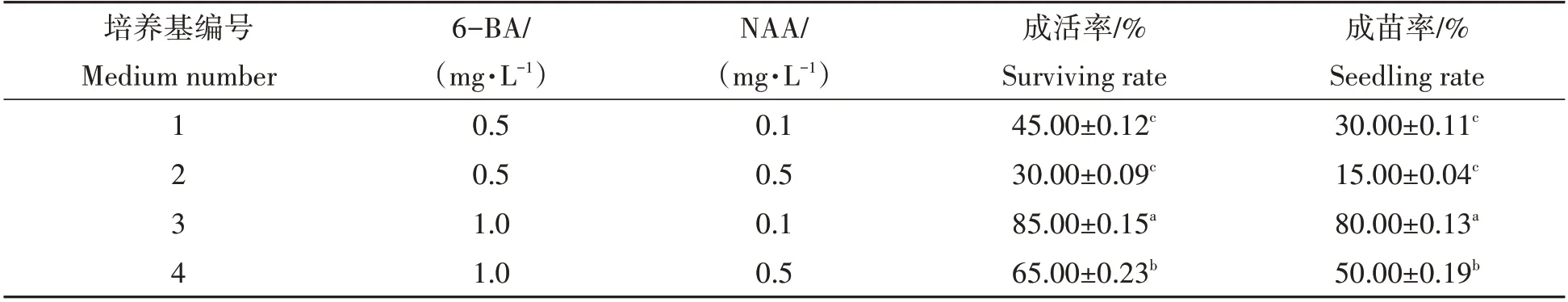
表2 不同浓度6-BA与NAA对茎尖成活的影响Tab.2 Effect of different concentrations of 6-BA and NAA on survival of stem tips

图1 南城淮山茎尖培养Fig.1 Culture of stem tip of Nancheng Huaishan
2.2 试管苗RT-PCR病毒检测
对茎尖培养的试管苗进行RT-PCR 病毒检测,结果(图2)表明,大田植株材料共检测到日本花叶病毒(JYMV)、马铃薯Y病毒(PVY)与马铃薯纺锤块茎类病毒(PSTVD)等3类病毒,其对应的病毒序列片段分别为1 100,581,360 bp,所有试管苗中均未扩增出JYMV、PVY 与PSTVD 病毒。此外,大田植株与试管苗叶片中均未检测到马铃薯S病毒(PVS)与马铃薯X病毒(PVX)。

图2 大田植株及试管苗叶片RT-PCR病毒检测Fig.2 Virus detection of leaves from field and in vitro plantlet by RT-PCR
2.3 不同激素配比对脱毒苗增殖的影响
将检测后的脱毒苗接种至4种增殖培养基上,生长60 d后统计增殖系数,结果见表3所示。由表3可知,4个不同浓度6-BA与NAA的组合均可诱导脱毒苗增殖和分化。其中,脱毒苗在1.0 mg/L 6-BA+0.5 mg/L NAA 培养基上的增殖系数达到4.5,显著高于其他培养基,是脱毒苗增殖的最佳激素配比。在3.0 mg/L 6-BA+0.3 mg/L NAA的MS培养基上的脱毒苗增殖系数最低,多数直接分化成苗,未发生增殖。
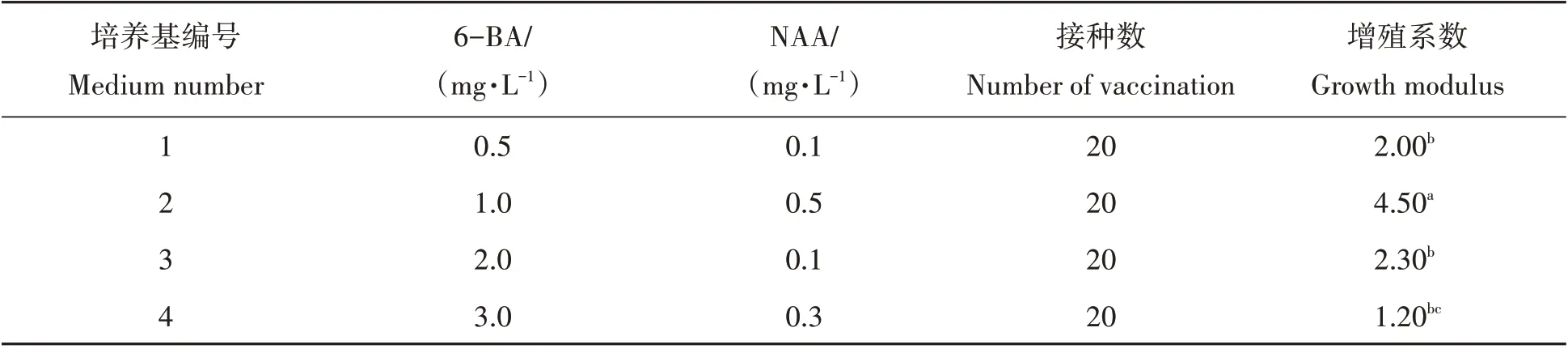
表3 不同浓度6-BA与NAA对脱毒苗增殖的影响Tab.3 Effect of different concentrations of 6-BA and NAA on proliferation of virus-free vaccine
2.4 不同激素配比对试管苗微扦插快繁的影响
由表4可以看出,在MS培养基中加入不同浓度的6-BA与NAA均能使脱毒苗茎段诱导出新芽,但诱导效果差异显著。将带腋芽的茎段接入2.0 mg/L 6-BA+0.2 mg/L NAA 的MS 培养基中,5~7 d 后侧芽萌动,出芽率为98.33%,诱导效果最佳,25 d侧芽长成健壮的脱毒试管苗,且生根率达到100%,增殖系数为5.93,茎段未见分化出愈伤组织(图3c,图3d)。在MS 培养基中添加1.0 mg/L 6-BA 与0.5 mg/L NAA 时,茎基部形成少量愈伤组织并很快褐化,茎段出芽率最低,为53.33%,增殖系数为1.60,未见有根生成。

图3 试管苗茎段微扦插成苗Fig.3 Seedling formation of test-tube stem by microcuttage

表4 不同浓度6-BA与NAA对试管苗茎段快繁与生根的影响Tab.4 Effect of different concentrations of 6-BA and NAA on stem rapid propagation and grow root of test tube seedling
2.5 抗褐化剂对试管苗生长的影响
如表5 所示,在前期筛选出的试管苗微扦插成苗最适的MS 培养基中分别加入不同浓度的活性炭(AC)、聚乙烯吡咯烷酮(PVP)与VC 等抗褐化剂,与空白对照相比,三者均能抑制试管苗的褐化。其中,培养基中添加1.5 g/L AC,其试管苗褐化率最低,为10.33%,显著低于PVP与VC处理,添加1.5 g/L PVP后试管苗的褐化率最高,达到68.33%。
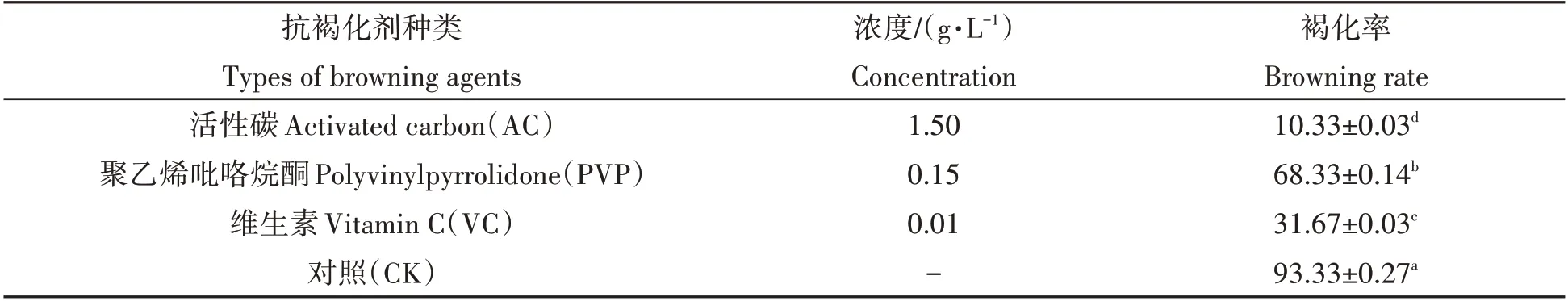
表5 不同抗褐化剂对试管苗褐化的影响Tab.5 Effect of different browning agent in media on browning rate of test tube seedling
2.6 不同NAA浓度对试管苗扦插成活率及脱毒种薯生长的影响
如表6和图4(d,e)所示,NAA 处理下试管苗扦插成活率及种薯生长情况显著优于清水处理。其中,100 mg/L NAA处理下插穗生根率为96.67%,且扦插培养获得的脱毒种薯平均纵、横径分别为22.52 cm和13.12 mm,平均质量为28.09 g,显著高于其他处理。50、100 mg/L NAA 处理下扦插苗成活率与种薯纵、横径与平均质量均没有显著差异,清水处理下扦插生根率最低,为81.67%,且脱毒种薯生长情况最差。100 mg/L NAA处理对试管苗扦插成活及脱毒种薯的生长有一定的促进作用。

图4 南城淮山脱毒苗移栽与扦插繁种Fig.4 Transplant and cuttage propagation tuber of virus-free seedling of Nancheng Huaishan

表6 不同浓度NAA对插穗成活率及脱毒种薯生长的影响Tab.6 Effect on surviving rate of scions and growth of virus-free seeds treated with different concentrations of NAA
3 结论与讨论
山药作为典型的无性繁殖作物,在长期营养繁殖过程中病毒逐年积累,导致其种性不断退化。近年来,研究人员通过茎尖培养、超低温疗法(Cryotherapy)、热处理、化学药剂处理、微型嫁接等方法进行植株病毒脱除[27-29]。其中热处理和化学药剂处理步骤繁多、技术难度高;微型嫁接程序复杂,费时费工,甚至可能存在嫁接不亲和的问题[27];超低温疗法存在脱除植株病毒不彻底、试管苗存活率和再生率降低等问题[30-31]。茎尖脱毒技术是剥取植物顶端无毒或带病率极低的分生组织(茎尖)进行组织培养[32],此技术已成功应用到多种栽培植物中[33]。刘星月等[34]利用茎尖脱毒技术成功脱除芋(Colocasia esculenta)的芋花叶病毒(DsMV),并获得脱毒芋。李会等[35]通过对半夏(Pinellia ternata)微茎尖脱毒培养,成功脱除半夏中的芋花叶病毒(DsMV)。本研究利用茎尖脱毒技术,研究不同质量浓度6-BA 与NAA 对茎尖诱导的影响,筛选出最佳茎尖诱导成苗培养基,高效脱除了南城淮山中的日本花叶病毒(JYMV)、马铃薯Y 病毒(PVY)与马铃薯纺锤块茎类病毒(PSTVD)。
酚类物质的种类与含量是导致组织培养过程中褐变的重要因素。由于山药富含酚酸、黄酮及花色苷类等酚类物质[36],导致其在组织培养过程中容易造成外植体褐变甚至死亡。前人研究表明,在培养基中添加适量的聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、维生素C(vitamin C,VC)和活性炭(active carbon,AC)等物质,能够有效减少褐化物的积累[37-38]。廖焕琴等[39]认为在MS培养基中添加1.0 g/L活性炭可有效抑制褐化。有研究发现0.5 g/L PVP可以抑制芍药(Paeonia lactifloraPall)褐化[40]。本研究结果显示,在MS 培养基中添加1.5 g/L AC 较可有效的抑制南城淮山组织培养过程中的褐化现象,其效果优于PVP和VC 的处理。活性炭可以吸附培基中的有害物质,包括琼脂中所含的杂质、外植体在培养过程中分泌的酚、醌类等对外植体自身有害的物质,同时又能吸附生长调节物质。
通常,山药茎尖脱毒培养是由茎尖诱导获得不定芽再进行增殖、分化、生根[13-14],而本研究中利用茎尖获得不定芽并增殖,诱导分化后,以南城淮山的单芽茎段为外植体,直接诱导腋芽萌发,获得大量继代苗,增殖系数达到5.93,可在较短的时间内实现大量繁殖种苗。此外试验结果还表明,南城淮山茎段在MS+6-BA 2.0 mg/L+NAA 0.2 mg/L 培养基上,可以实现试管苗增殖与生根诱导同步进行,继代繁殖周期20~30 d,生根诱导率达100%。既缩短培养时间,又降低了组培成本。采用微扦插技术大量繁殖试管苗,并伴有根的生成,对简化培养程序、降低快速繁殖成本具有重要作用。
山药规模种植通常以块茎切块为种,每公顷需种薯3 000 kg 以上,用种量大、成本高,且伤口容易感染病虫害。山药地上部茎蔓生长旺盛,通过藤蔓扦插结薯已有相关报道。如Oyetunji等[41]利用非洲白山药(Dioscorea rotundata)藤蔓扦插生产微型块茎,大大降低了山药种植成本。本研究在培育出南城淮山脱毒苗基础上,以脱毒苗带叶茎节为插穗,在100 mg/L NAA 处理下,培育出平均质量为28.09 g的微型块茎,可做为脱毒种薯用于田间生产,也便于长途运输,对加快优良山药品种提纯复壮和推广种植十分有利。本研究对南城淮山健康种薯的获得及快繁规模化生产可提供重要的技术支撑。
致谢:江西省现代农业产业技术体系建设专项(JXARS-19)同时对本研究给予了资助,谨致谢意!

