伴有CLIP1-ALK融合基因晚期肺鳞癌1例
袁月 王征 聂鑫 张萍 李琳
1 病例资料
患者,男性,4 4岁,2021年3月因咳嗽、咳痰、咯血以及活动后喘憋就诊于外院,行胸部计算机断层扫描(computed tomopraphy, CT)提示左肺占位,后行支气管镜下肺活检,病理结果回报:鳞癌,低分化。2021年4月14日行正电子发射计算机断层显像(positron emission tomography/CT, PET/CT):①左肺门软组织密度肿块,伴高代谢,符合肺癌表现;②左肺门、纵隔及左锁骨上区淋巴结多发转移;③左侧胸膜转移,伴大量胸腔积液;④胸骨及左侧前锯肌转移。个人史:吸烟10余年,平均10支/日。该病例报道已获得患者家属知情同意。患者入我院时咳嗽、咳痰及活动后喘憋症状明显,影响日常活动。完善肿瘤标志物检测:癌胚抗原(carcinoembryonic antigen, CEA)11.2 ng/mL,鳞状上皮细胞癌抗原(squamous cell carcinoma antigen, SCC-Ag)>70.0 ng/mL。予患者行胸腔引流管植入术后完善胸腔积液病理:(胸腔积液)找到癌细胞,考虑为低分化鳞癌;免疫组化结果:细胞角蛋白7(cytokeratin 7, CK7)(+++),细胞角蛋白20(cytokeratin 20, CK20)(-),甲状腺转录因子1(thyroid transcription factor-1, TTF-1)(-),天冬氨酸蛋白酶A(novel aspartase proteinase A, Napsin A)(-),CDX2(-),P40(++)(图1A),CK5/6(+++),P53(70%+特殊染色),CEA(极个别肿瘤细胞+),Ki67(40%+),glut1(+++),PAX8 (-),D-PAS(-),Syn(-),CgA(-),Ventana ALK(D5F3)(+)(图1B),ALK(对照):(-)。
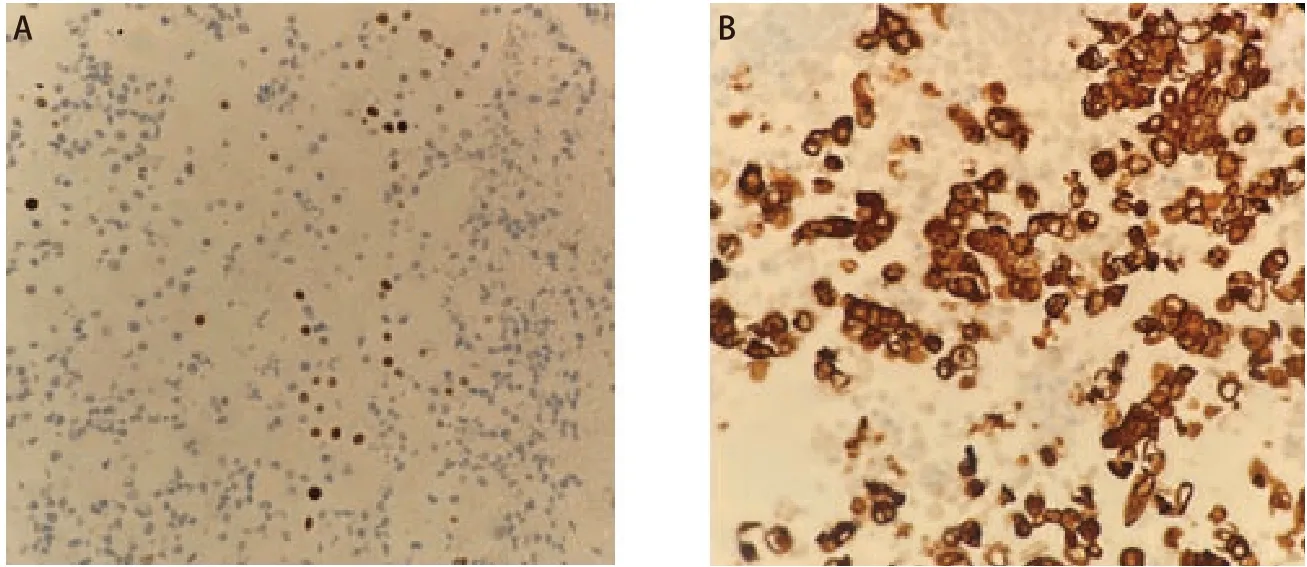
图1 患者胸腔积液细胞免疫组化染色结果。A:P40免疫组化染色结果(×400);B:Ventana ALK(D5F3)染色结果(×400)。Fig 1 Immunohistochemical staining results of pleural effusion cell block. A: P40 immunohistochemical staining results (×400); B: Ventana ALK (D5F3) immunohistochemical staining results (×400).
取胸腔积液进一步完善分子分型相关检测:首先完成肺癌常见9项驱动基因突变阻滞扩增系统(amplification refractory mutation system, ARMS)检测,结果显示EML4-ALK融合基因:阴性(试剂购于厦门艾德生物医药科技股份有限公司)。进一步完善ALK基因融合荧光原位杂交(fluorescencein situhybridization, FISH)结果:阳性(试剂购于武汉康录生物技术股份有限公司)(图2)。随后进行40基因NGS(RNA based-扩增子建库NGS,检测平台:Illumina Nextseq CN500):ALK(Fusion, SNV, InDel):未检出。为了明确该患者ALK融合伴侣情况,我们又进行了胸腔积液1021基因NGS(DNA based-靶向捕获建库NGS),结果显示CLIP1-ALK融合(融合功能区域:EX10:EX20),突变频率0.9%;肿瘤突变负荷(tumor mutational burden, TMB)0.63 Muts/Mb,MSS(检测平台:Illumina HiSeq 2000/2500)。程序性死亡配体1(programmed death ligand 1, PD-L1)免疫组织化学染色(22C3)结果:表达肿瘤细胞阳性比例分数(tumor proportion score, TPS)5%、综合阳性评分(combined positive score, CPS)5。
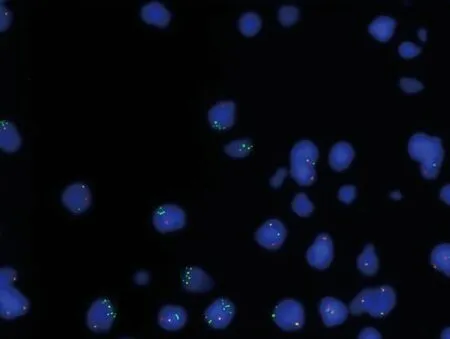
图2 患者胸腔积液ALK荧光原位杂交结果Fig 2 Results of ALK fluorescence in situ hybridization in pleural effusion. ALK: anaplastic lymphoma kinase.
结合临床症状及辅助检查结果,该患者诊断为晚期肺鳞癌I V期,A LK驱动基因阳性,体能状态评分(performance status, PS)2分,完善基线影像学评估(图3A)后于2021年5月5日起给予阿来替尼600 mg,bid,口服,作为一线治疗,患者用药10 d后咳嗽喘憋症状较前缓解,2021年7月14日复查胸部CT:左肺肿块范围较前缩小,左上肺较前复张(图3B),复查SCC-Ag 14.6 ng/mL,根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1评价疗效:病情稳定(stable disease, SD),同时患者喘憋症状明显改善,活动耐量较前增加,此时PS评分为1分,继续给予阿来替尼治疗。2021年9月患者受凉后出现呼吸道感染,临床症状再次加重,一般情况明显恶化,2021年9月15日CT示:左肺肿块明显增大,右肺转移瘤及纵隔各区淋巴结较前增大,胸腔积液及心包积液较前增多(图3C),复查SCC再次升高:SCC>70.0 ng/mL,RECIST 1.1评价疗效:疾病进展(progressive disease, PD)。2021年9月17日起采用恩沙替尼225 mg,qd,口服,患者咳嗽症状持续加重,积极对症处理无效,患者于2021年9月30日因PD去世。
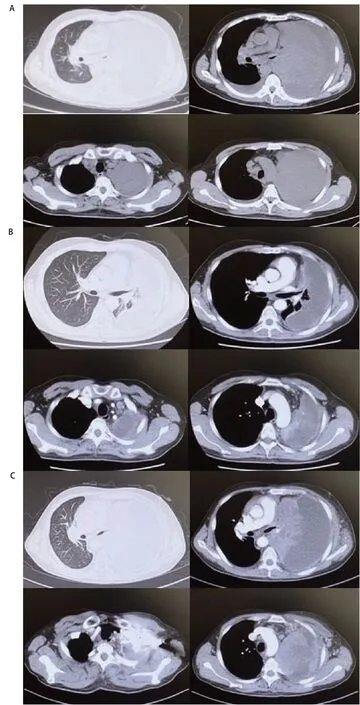
图3 胸部CT对比。A:患者基线影像学检查(2021年4月26日):可见左主支气管截断,左肺致密实变影(肿瘤病灶与肺不张分界不清),纵隔多发淋巴结肿大;B:2021年7月14日疗效评价:左肺肿块与左上肺分界不清,范围较前缩小,左上肺较前复张;纵隔及右侧肺门多发肿大淋巴结较前缩小;C:患者2021年9月15日疗效评价:左肺肿块,较前范围明显增大,伴左侧全肺不张,纵隔6区淋巴结较前明显增大。AFig 3 Chest CT contrast. A: Baseline imaging examination of patient (April 26, 2021): truncation of the left main bronchus, dense consolidation of the left lung (unclear boundary between tumor and atelectasis) and multiple mediastinal lymph gland can be seen; B: Effect evaluation on July 14, 2021: the boundary between the left lung mass and the left upper lung is unclear, the scope is narrower than before, and the left upper lung is more dilated than before; the mediastinum and the right hilum of the lung were multiple and the lymph nodes were smaller than before; C: Effect of evaluation on September 15, 2021: the left lung mass is significantly larger than before, accompanied by left total atelectasis, and para-aortic lymph nodes was significantly larger than before. CT: computed tomography.
2 讨论
本文报道了1例ALK阳性晚期肺鳞癌患者,免疫组织化学及FISH检测ALK阳性,NGS检测出CLIP1-ALK融合基因,一线使用阿来替尼有效,一线治疗无进展生存期(progression-free survival, PFS)为4.5个月。总生存期(overall survival, OS)为6.0个月。从病理分型角度来说,低分化肺鳞癌和肺腺癌组织通过常规光学显微镜较难区分,特别是在小活检和细胞学样本中,诊断依赖免疫组化生物标志物[4],本例患者免疫组化显示P40(++),CK5/6(+++),CK7(+++),ヰF-1(-),Napsin A(-),根据国际肺癌研究协会/美国胸科协会/欧洲呼吸协会(International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society, IASLC/ATS/ERS)分类标准考虑低分化鳞癌[5]。相比于肺腺癌,ALK融合基因在肺鳞癌中较为罕见,发生率为1%-2.5%[6,7]。ALK阳性肺鳞癌患者使用ALK抑制剂效果相较于肺腺癌患者较差。Meng等[8]回顾了单中心个案报道中共31例ALK阳性肺鳞癌患者,共有20例患者接受了ALK抑制剂作为一线或二线治疗,治疗的中位持续时间为(6.4±4.4)个月,远低于ALK抑制剂在ALK阳性肺腺癌中取得的疗效。Lewis等[9]回顾了6例具有EML4-ALK重排的肺鳞癌患者的治疗过程,使用ALK抑制剂作为一线或二线治疗的中位PFS为2.8(1.8-6.3)个月,OS为8.3(3.2-32.1)个月。本文中患者OS与既往文献[9]报道相近。
目前获2019年中国NSCLC ALK检测专家共识推荐用于ALK基因融合检测手段有FISH、实时荧光定量聚合酶链反应(real-time fluorescence polymerase chain reaction, RT-PCR)、免疫组织化学(immunohistochemistry, IHC)及NGS等方法[10]。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)NSCLC临床实践指南中推荐使用获美国食品药品监督管理局(Food and Drug Administration, FDA)批准的免疫组织化学Ventana-D5F3作为独立检验使用,无需FISH确认[11]。本例患者免疫组织化学及FISH检测阳性,但由于RT-PCR只能针对已知ALK融合基因类型、扩增子测序(amplicon-based NGS)方法局限于特定的常见位点,上述两种检测方法结果阴性,最终通过大panel NGS检出罕见融合伴侣,提示对于罕见融合基因类型来说,IHC Vatana-D5F3 ALK及NGS有其独特应用价值。
ALK基因的易位导致ALK融合蛋白的产生,这些融合蛋白发生二聚化以激活ALK下游信号通路,在血液肿瘤及实体瘤中发挥致癌驱动作用[12]。目前ALK阳性NSCLC中,EML4-ALK是主要融合变体,约占95%[13]。随着高通量测序技术及靶向RNA测序技术在ALK阳性NSCLC患者中的应用,越来越多的罕见融合伴侣被检测出来。截止2020年1月,已在NSCLC患者中发现至少90个不同的ALK融合蛋白[14]。ALK融合蛋白转录的起始是由伴侣基因的调控区驱动的,其亚细胞定位是由伴侣蛋白决定的;ALK融合体通过ALK伴侣蛋白发生二聚化及反式自磷酸化,从而激活ALK激酶结构域[12]。一些回顾性研究[15-17]提示携带不同EML4-ALK变体的患者使用ALK抑制剂疗效不同,已有体外实验[18]证明,ALK融合伴侣的不同可影响肿瘤细胞的细胞表型、生化特性及对ALK抑制剂的反应性。提示携带不同伴侣蛋白的ALK阳性NSCLC为一组异质性疾病。
本文中患者通过胸腔积液高通量测序检测出CLP1-ALK融合基因,含CAP-Gly结构域的细胞质连接蛋白-1(CAP-gly domain containing linker protein 1, CLIP1)是细胞骨架相关蛋白家族的成员,具有保守的富含甘氨酸的结构域,它与微管结合,在细胞内囊泡运输中发挥重要作用[19]。这一类型的ALK重排首次发现于Spitz肿瘤中,Yeh等[20]于2015年报道了具有CLIP1-ALK融合的Spitz肿瘤,融合断点位于CLIP1外显子13和ALK外显子20。2017年,Vendrell及其同事首次报道了NSCLC中的CLP1-ALK(C22:A20)融合基因,融合断点位于CLIP1外显子22和ALK外显子20,该例患者对克唑替尼治疗有反应[21]。2019年,Pinsolle等[22]报道了1例具有CLIP1-ALK融合且具有神经内分泌特征的NSCLC患者(71岁女性),融合断点位于CLIP1外显子12和ALK外显子20,该例患者在开启治疗之前因PD死亡。本文报道了1例接受ALK抑制剂治疗的CLP1-ALK融合患者,并且与之前文献报道中具有不同的融合断点,该患者使用ALK抑制剂治疗效果不佳,阿来替尼作为一线治疗PFS为4.5个月,对比ALEX研究(阿来替尼对比克唑替尼一线治疗III期临床研究)中阿来替尼治疗组PFS为34.8个月[23],提示CLP1-ALK融合基因NSCLC恶性程度高,对ALK抑制剂反应较差。
研究[24]显示,CLIP1-LTK融合是新的NSCLC驱动基因。白细胞酪氨酸激酶(leukocyte tyrosine kinase, LTK)和ALK构成受体酪氨酸激酶的ALK/LTK亚家族,它们连同其激活细胞因子ALKAL1和ALKAL2,参与调控神经发育、癌症和自身免疫性疾病,LTK及ALK各自的激酶结构域中具有近80%的同一性[25]。考虑到上述因素,Izumi等[24]在细胞实验中证实ALK抑制剂可抑制CLIP1-LTK激酶活性并诱导肿瘤细胞凋亡,劳拉替尼效果最好,其他ALK抑制剂(克唑替尼、色瑞替尼、阿来替尼、恩沙替尼、布加替尼)次之且效果相似,研究者在1例携带CLIP1-LTK融合基因的NSCLC患者(一线免疫单药联合化疗治疗后进展)中进行试验性劳拉替尼治疗,该患者表现出良好的临床反应,治疗5个月后肿瘤持续缩小。相比于该例CLIP1-LTK融合患者,本文中患者使用二代ALK抑制剂效果不佳,提示CLIP1-LTK融合和CLIP1-ALK融合不尽相同,劳拉替尼能否在CLIP1-ALK融合患者中收获较好疗效有待进一步研究证实。
本文报道了首例接受ALK抑制剂治疗的罕见CLIP1-ALK融合基因的晚期肺鳞癌患者,该例患者使用阿来替尼治疗有效但总体效果差,OS短。
- 中国肺癌杂志的其它文章
- 三代EGFR-TKI在EGFR突变NSCLC治疗中应用的专家共识(2022年版)
- 高流量湿化氧疗对单孔胸腔镜下肺叶切除术后患者的疗效分析
- Efficacy Differences of First-line EGFR-TKIs Alone vs in Combination with Chemotherapy in Advanced Lung Adenocarcinoma Patients with Sensitive EGFR Mutation and Concomitant Non-EGFR Genetic Alterations
- CDH1、FANCB和APC基因多态性与中国人群肺癌易感性的关系

