氮素水平对潮土氨氧化微生物和硝化作用的影响
陈照明,王 强,*,李燕丽,张金萍,3,冯 江,刘 涛,俞巧钢,马军伟
(1.浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021; 2.长江大学 农学院,湖北 荆州 434023; 3.浙江农林大学 环境与资源学院,浙江 杭州 311300)
硝化作用是土壤中重要的氮素转化过程之一,可以将铵态氮转化为硝态氮。硝化作用不仅会影响土壤氮素的生物有效性,同时还与农业面源污染、温室气体排放相关联。例如,硝态氮在土壤中具有较高的移动性,易通过淋溶而造成损失,还会污染地下水。氨氧化是硝化作用的第一步,也是其限速步骤。氨氧化作用主要由氨氧化细菌(ammonia-oxidizing bacteria,AOB)和氨氧化古菌(ammonia-oxidizing archaea,AOA)参与完成。此外,新近发现的全程氨氧化微生物可同时执行氨氧化与亚硝酸盐氧化过程,也是土壤硝化作用的重要参与者。研究表明,多种因素能够影响土壤硝化作用,如土壤pH、湿度、温度、土壤类型和施肥管理等。
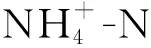

1 材料与方法
1.1 供试土壤与氮肥
供试土壤采自江苏省泰州市姜堰区(32°31′N,120°9′E),土壤类型为潮土。采样地属于亚热带季风气候,年均降水量991.7 mm,年平均气温14.5 ℃。于水稻收获后,采集0~20 cm的耕层土壤,挑去作物残渣和石块后,放置于室内自然风干,过2 mm的筛,备用。经测定,耕层土壤的基本理化性质如下:有机质含量22.60 g·kg,全氮含量1.64 g·kg,有效磷含量16.63 mg·kg,速效钾含量85.40 mg·kg,pH值8.57。
供试氮肥分别为尿素(N含量46.7%)和硫酸铵(N含量21.2%),均为分析纯试剂。
1.2 试验设置与样品采集

1.3 土壤pH值和无机氮含量测定
采用pHSJ-6L型pH计(上海仪电科学仪器股份有限公司)测定土壤pH值(浸提液的水土体积质量比为2.5∶1)。

1.4 土壤总DNA提取和定量PCR
称取0.5 g(干重)土样,用FastDNA SPIN kit for DNA试剂盒(MP Biomedicals,美国),按照说明书上的方法提取土壤总DNA,用NanoDrop One微量紫外可见分光光度计(Thermo Scientific,美国)测定提取得到的总DNA的浓度和纯度。将提取的土壤总DNA保存在-20 ℃冰箱里,备用。
采用CFX96 Optical Real-Time Detection System(Bio-Rad Laboratories,美国)进行实时荧光定量PCR(qRT-PCR)检测。用于氨氧化细菌qRT-PCR的引物分别为amoA-1F(GCGGGTTTCTACTGGTGGT)和amoA-2R(CCCCTTCGGGAAAGCCTTCTTC),用于氨氧化古菌qPCR的引物分别为crenamoA23f(ATGGTCTGGCTWAGACG)和crenamoA616r(GCCATCCATCTGTATGTCCA)。qRT-PCR反应体系为20 μL:10 μL SYBR Premix Ex(Takara Biotechnology,日本),各0.3 μL的正向和反向引物,1 μL的模板,8.4 μL灭菌水。阴性对照以灭菌水作为模板。每个样品重复3次。
1.5 数据统计与分析
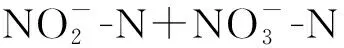
2 结果与分析
2.1 土壤pH的动态变化
添加氮肥显著(<0.05)降低了土壤pH值,且土壤pH值随氮素水平的升高而降低(图1)。但对于N0处理,培养过程中,土壤pH值基本保持稳定(8.50~8.54)。
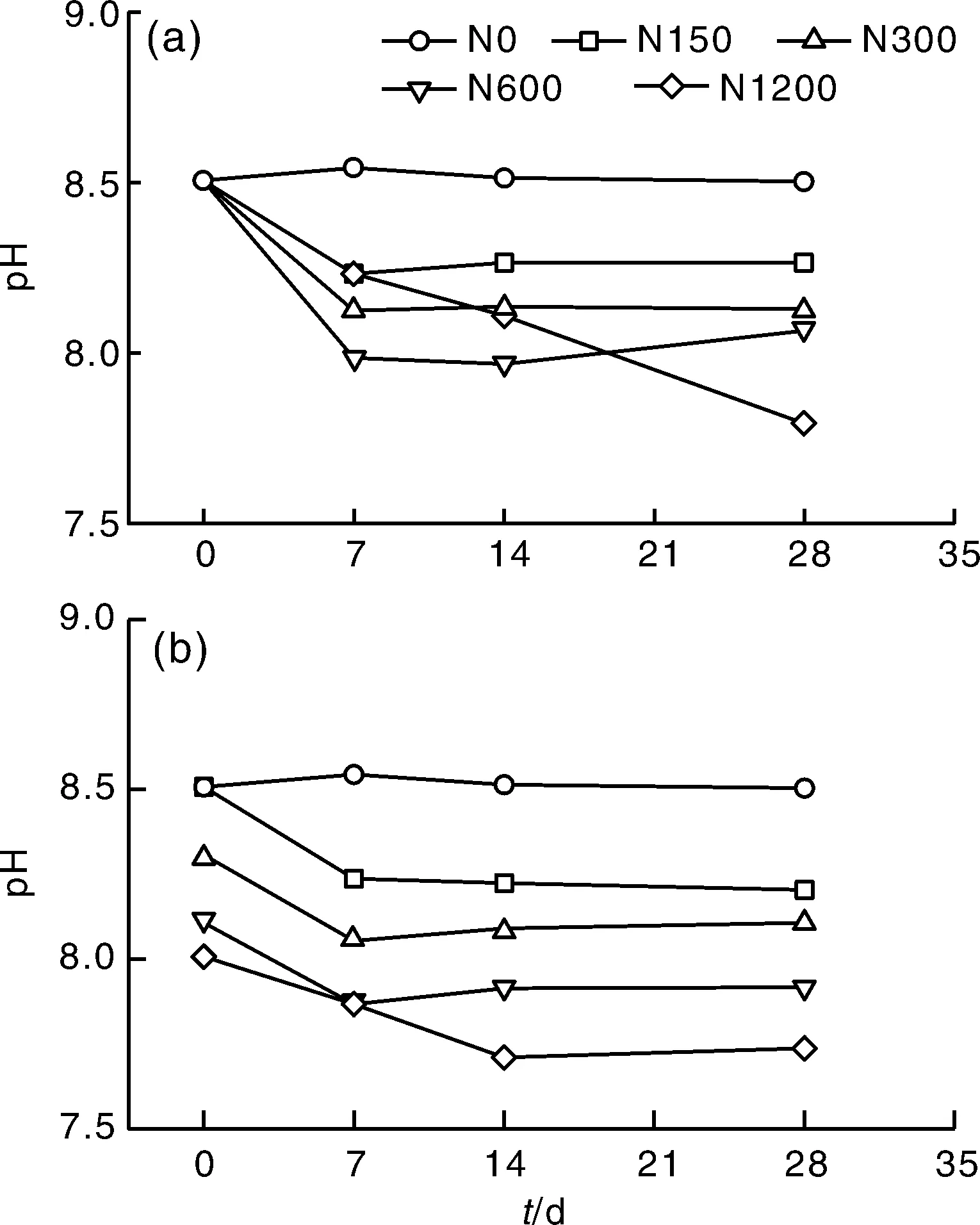
图1 不同尿素(a)或硫酸铵(b)浓度下土壤pH值的变化Fig.1 Dynamic of soil pH under addition of different amounts of urea (a) or ammonium sulfate (b)
尿素施入土壤后,土壤pH值下降,其中N150、N300和N600处理的土壤pH值在第7天就已经降到最低值,7 d以后,这3个处理的土壤pH值趋于稳定;然而,N1200处理的土壤pH值随培养时间延长持续降低。
硫酸铵施入土壤后,土壤pH值快速下降,且随氮素水平的升高而降低。除N1200处理外,其余施氮处理的土壤pH值均在第7天时达到最小值,之后基本保持平稳;而N1200处理在第14天时土壤pH值才降到最低值。
至培养结束时,无论是施用尿素还是硫酸铵,不同氮水平处理的土壤pH值均表现为N0>N150>N300>N600>N1200。
2.2 土壤和含量的动态变化
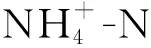
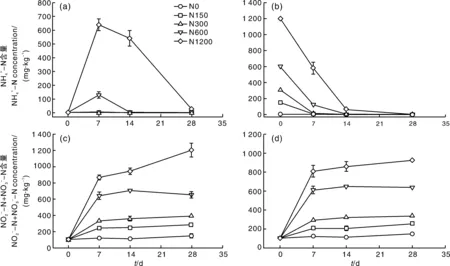
图2 尿素(a, c)或硫酸铵(b, d)处理下土壤和含量(c, d)的变化Fig.2 Dynamics of contents (c, d) in soils under urea (a, c) or ammonium sulfate (b, d) treatments
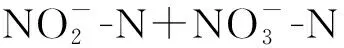
2.3 氨氧化细菌和氨氧化古菌amoA基因拷贝数的动态变化
在培养过程中,N0处理的AOA基因拷贝数从4.32×10g增加到6.71×10g(图3)。与N0处理相比,添加尿素或者硫酸铵并没有显著促进氨氧化古菌的数量增长,尿素处理的AOA基因拷贝数为3.07×10~6.35×10g;而硫酸铵处理的AOA基因拷贝数为4.17×10~7.18×10g(图3)。
图3 尿素(a、c)或硫酸铵(b、d)处理下土壤氨氧化古菌(a、b)和氨氧化细菌(c、d)amoA基因拷贝数的变化Fig.3 Dynamics of amoA gene copies of ammonia oxidizing archaea (AOA) (a, b) and ammonia oxidizing bacteria (AOB) (c, d) in soils under urea (a, c) or ammonium sulfate (b, d) treatments
在培养过程中,N0处理的AOB基因拷贝数变化不大(5.07×10~6.60×10g)。但是,施用氮肥促进了AOB数量的增长。添加尿素培养7、14、28 d后,AOB基因的拷贝数分别比培养开始时增加了3.5~20.1、2.03~15.2、2.93~17.0倍。添加硫酸铵后,N150、N300、N600、N1200处理的AOB基因拷贝数从初始的5.07×10分别增加到11.2×10、25.1×10、38.6×10、88.6×10g。总的来看,无论是添加尿素还是硫酸铵,在同一时间点,AOB基因拷贝数均随着氮水平的升高而增加,但相同氮水平下尿素处理的要高于硫酸铵处理。
2.4 土壤含量与AOB和AOA amoA基因拷贝数的相关关系


图4 尿素(a、b)或硫酸铵(c、d)处理下土壤含量与氨氧化古菌(a、c)和氨氧化细菌(b、d)amoA基因拷贝数的相关关系Fig.4 Relationship of soil content with amoA gene copies of ammonia oxidizing archaea (AOA) (a, c) and ammonia oxidizing bacteria (AOB) (b, d) in soils under urea (a, b) or ammonium sulfate (c, d) treatments
2.5 土壤平均净硝化速率
与N0处理(净硝化速率1.61 mg·kg·d,以N计,下同)相比,施用尿素或硫酸铵均可显著(<0.05)增加土壤净硝化速率(图5)。添加尿素后,N150、N300、N600和N1200处理的平均净硝化速率分别为6.49、10.30、19.65、39.28 mg·kg·d,分别是N0处理的4.0、6.4、12.2和24.4倍。添加硫酸铵后,N150~N1200处理的平均净硝化速率分别为5.39、8.28、15.54、29.31 mg·kg·d,分别是N0处理的3.3、5.1、9.6和18.2倍。
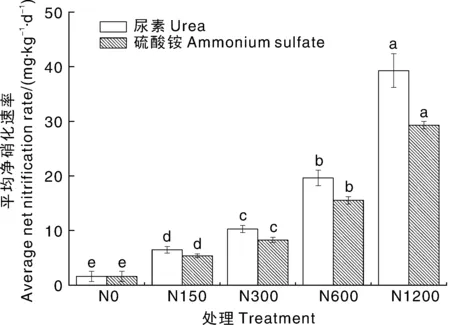
柱上无相同字母的表示同一肥料下不同处理间差异显著(P<0.05)。Bars marked without the same letters indicated significant difference at P <0.05 under addition of either urea or ammonium sulfate.图5 不同尿素或硫酸铵浓度对潮土平均净硝化速率的影响Fig.5 Effects of different amounts of urea or ammonium sulfate on average net nitrification rate of fluvo-aquic soil
3 讨论
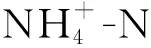
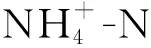
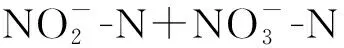
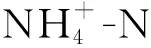
本研究表明,不管是施用尿素还是硫酸铵,均是AOB而不是AOA在潮土硝化作用中起主导作用。AOB基因拷贝数和平均净硝化速率均随氮素水平提高而增加,且高氮(1 200 mg·kg)对潮土的硝化作用没有显著抑制作用。施用尿素较硫酸铵可通过提高AOB丰度,从而提高潮土的平均净硝化速率。今后,还需进一步加强对氮肥集中施用下氮素损失相关机理的研究,以期提出更加集约高效的农田氮素管理方式。

