幽门螺杆菌在宿主间传播途径模型的初步研究
岑朝,杜秋颖,吴雪铭,苏建伟,覃小珊,张文燕,鲁礼静,廖阳, 梁玉美▲
(1.右江民族医学院附属医院消化内科,广西百色 533000; 2.右江民族医学院研究生学院,广西百色 533000)
幽门螺杆菌(Helicobacter pylori,Hp)感染动物模型国内外已进行了大量研究,但其在宿主间的直接传播模型目前尚少有报道,许多研究认为,幽门螺杆菌传播主要有口-口传播和粪-口传播途径,甚至有提出飞沫传播的假设,但目前仍缺乏有力的直接证据。本研究模拟幽门螺杆菌在宿主间的传播过程建立研究模型,为进一步揭示幽门螺杆菌感染途径的研究打下基础。
1 对象与方法
本研究经医院伦理委员会审核通过,采用队列研究方法,以采集含有Hp感染患者的胃黏膜、胃液、口腔含漱液、粪便标本,随之污染到自然环境的食物中,再分别在4 h、24 h、72 h、1 W、2 W等5个时间节点,分别灌喂SPF级小鼠2次,再适应性喂养4 W后处死,通过胃黏膜组织切片检测Hp的感染状况及其炎症程度,探索在食物环境中随时间推移Hp是否还具备传染及繁殖能力;为掌握Hp传播规律提供直接证据。
从上消化道症状就诊的当地居民病例中筛选志愿者,由接受培训的医护人员进行面对面问卷调查,采集筛查对象的个人基本信息、生活方式、有无消化道病史、服药史及肿瘤家族史等信息,并进行体格检查。入围标准:①年龄≥18岁;②1个月内未使用抗菌药物和抑酸、制酸药;③无心、脑、肺、肝、肾等重要脏器疾病的患者;④如正在服用抗凝血药物,须停药一周后检查出凝血功能正常者;⑤患者按诊疗路径行血清Hp抗体测定和C-尿素酶试验,两项试验阳性者,确定为Hp现症感染;⑥排除有胃镜检查禁忌证者。符合以上条件者纳入研究对象,签署实验知情同意书、胃镜检查知情同意书。
内镜检查前志愿者须禁食、禁水8 h以上。电子胃镜严格清洗消毒、使用一次性无菌吸引管道和无菌标本采集袋,避免污染。在电子胃镜下以一次性无菌活检钳取患者的胃窦小弯2块,胃窦大弯1块,胃角2块,胃体大弯1块,胃体小弯1块,胃底1块,共采取8块黏膜组织。 取胃小弯、胃角各1块活检标本以10%福尔马林固定送病理学检查,HE或WS染色,记录炎症和Hp感染程度。余下6块(胃窦大小弯各1、胃体大小弯各1、胃角1、胃底1块)黏膜组织研磨:将胃黏膜放入经高压灭菌的研磨管中,加入5颗3 mm研磨磁珠,500 μL高压灭菌生理盐水作为研磨缓冲液,用mini-beadbeater16磁珠研磨仪进行研磨成混悬液,行快速Hp PCR检测,阴性者剔除,将余下混悬液加入等量新鲜培养液中,置于4 ℃环境中备用做动物试验。
清晨空腹行胃镜检查时胃腔内胃液全部吸净收集到专用收集袋中4 ℃保存,取以上混悬液行快速Hp PCR检测,阴性者剔除;剩余的标本加入等量新鲜培养液进入下一步动物试验。
禁食8 h,清晨未漱口及饮水,使用0.9%氯化钠溶液100 mL含漱并将含漱液吐入100 mL盐水瓶中,4 ℃环境储存并即送至实验室;快速Hp PCR检测,阴性者剔除,剩余的加入等量新鲜培养液进入下一步动物试验。
收集病人的新鲜粪便(每人30~50 g),置入一无菌塑料袋中称重;按重量体积比用预平衡的布氏肉汤配制25%的粪便悬液,用塑料袋封口机封口,粪便挤碎摇匀制成浆样悬液;37 ℃,7000 r/min离心10分钟,倒去上层液体,吸取含有粪便细菌的中间乳状层,快速Hp PCR检测,阴性者剔除;剩余的加入等量新鲜培养液进入下一步动物试验。
以Hp阴性志愿者的胃黏膜、胃液、口腔含漱液、粪便标本,同法处理,PCR检测各标本均为阴性者为对照。
(1)SPF级C57BL/6小鼠从长沙市天勤生物技术有限公司购买,雄性,体重18~22 g,平均体重20 g,周龄8 W。先适应性喂养1 W,再将所有实验小鼠断食、水12 h;饲料由右江民族医学院动物实验中心提供,统一配制的蒸馏水。选择其中1例Hp感染者胃黏膜、胃液、粪便、含漱液标本PCR检测阳性者接上述制备好实验标本,与鲜牛奶1∶1混匀后,食物于20 ℃~25 ℃室温下放置4 h、24 h、72 h、1 W、2 W,每组15只实验小鼠分别取以上标本0.5~1.0 mL/只灌喂,共2次,每次间隔1 h,继续断食、水4 h;之后正常进食,继续喂养4 W。同时取Hp阴性组的1例志愿者胃黏膜、胃液、粪便经PCR筛查均阴性的标本混合、污染处理的鲜牛奶,分别放置4 h、2 W后同样方法各灌喂实验小鼠,每组10只小鼠。剔除实验过程中死亡的实验小鼠,最后将完成实验的小鼠处死进行解剖取全胃做病理学检测。(2)对实验小鼠的胃黏膜组织病理学检查。取实验小鼠胃纵切进行病理切片HE染色(鉴别困难时Warthin-Starry染色),行Hp检测及病理炎症程度半定量检测;病理分级标准参照文献,感染分级:Hp感染,高倍镜检,切片中未发现Hp为阴性;多个视野仅发现稀疏分布的Hp,为轻度感染;几乎每个视野都可发现散在分布的Hp,为中度感染;视野中有较多的Hp,为重度感染。
采用SPSS 23.0 统计软件处理数据。计数资料用例(%)表示,两两组间比较采用四格表χ检验,<40或存在理论频数<1,则采用Fisher精确概率法;多个组间比较采用行×列表χ检验,存在理论频数<1或理论频数在1和5之间的格子数超过所有格子总数1/5,则采用Fisher精确概率法。检验水准:α=0.05,双侧检验。
2 结 果
本研究招募志愿者,行C呼气试验及胃黏膜组织病理学HE染色,2项阳性确定为Hp感染者(A组),2项均为阴性为非Hp感染组(B组),仅1项阳性剔除,最后符合纳入研究26例,A组12 例,B组14例。入组患者年龄范围在37岁至84岁之间。两组志愿者分别采集胃黏膜、胃液、含漱液、粪便标本采用PCR检测进行Hp筛查,结果如表1:A组采集的标本PCR检测Hp阳性率由高到低依次为胃黏膜、粪便、胃液,提示以上3种标本有Hp存在,胃黏膜、粪便标本与对照组相比差异有统计学意义(<0.01),但胃液标本差异无统计学意义(>0.05);口腔含漱液标本PCR检测均阴性,提示没有Hp DNA物质存在,故唾液标本不再进入下一环节动物实验;B组所有各标本PCR检测均阴性。
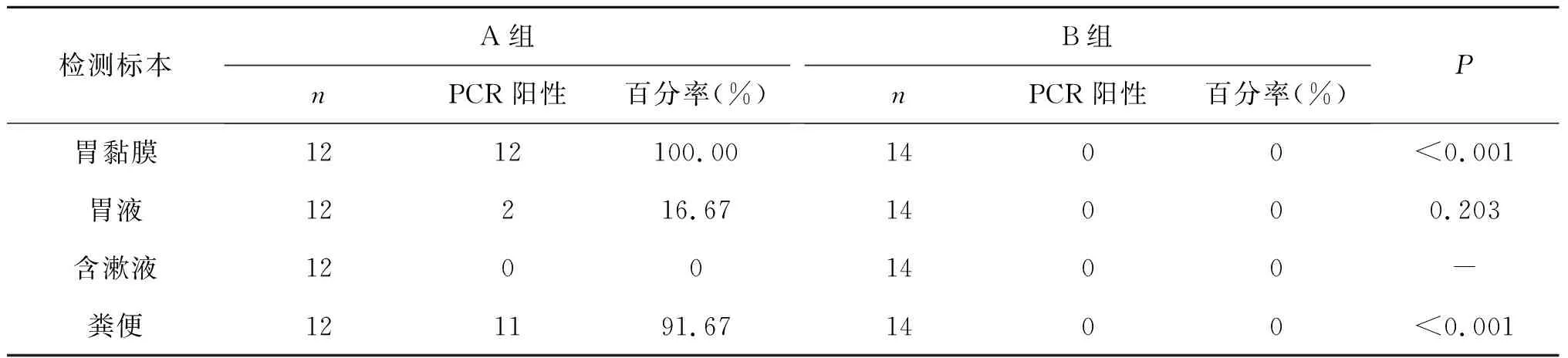
表1 患者标本PCR Hp筛查试验结果
自幽门螺杆菌感染患者胃黏膜标本各时间点均有Hp感染到实验小鼠,概率为14.29%~38.46%,各时间点感染概率差异无统计学意义(=0.682);胃液标本虽然只有2例PCR检测阳性(存在Hp),但取其阳性标本用于污染食物后亦能经过食物传染给实验小鼠,各时间点感染概率差异无统计学意义(=0.658);粪便标本有7.69%~18.18%可经过食物传染给实验小鼠,各时间点差异无统计学意义(=1.000);对照组(以4 h和2 W两个时间点实验)无一例感染Hp。各组小鼠Hp传染的概率见表2。

表2 不同标本及不同时间节点Hp传染的概率

续表2
合计各时间点的各类标本中Hp传染概率结果见表3。胃黏膜、粪便、胃液来源的Hp传染概率依次递减,三者间比较差异有统计学意义(χ=6.721,=0.035);两两比较,胃黏膜与粪便标本传染概率比较差异无统计学意义,而胃黏膜与胃液来源比较差异有统计学意义,粪便与胃液来源比较差异无统计学意义。
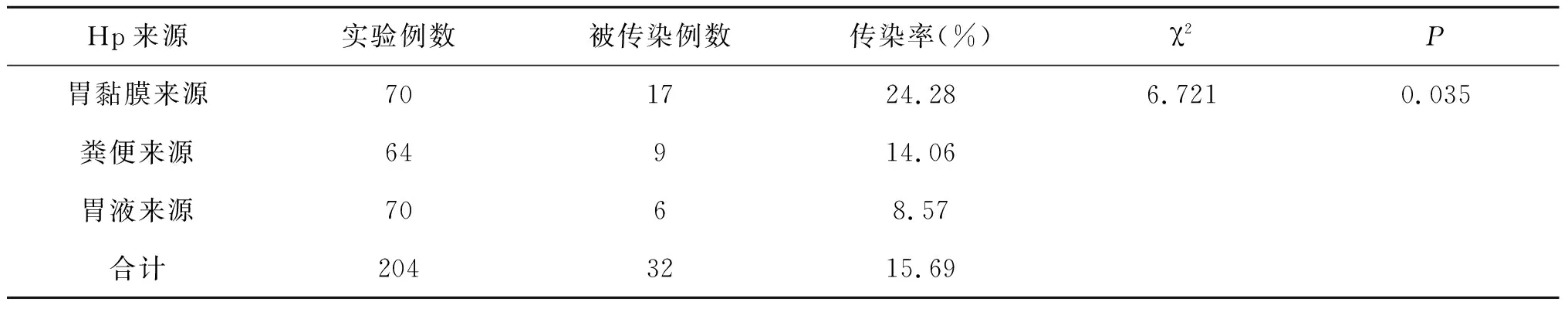
表3 各标本来源Hp污染食物后传染性比较
3 讨 论
幽门螺杆菌已被确定为慢性胃炎、消化性溃疡的重要致病菌,是胃癌癌前病变(萎缩性胃炎、肠上皮化生、胃黏膜上皮内瘤变)的重要病因,与胃腺癌、黏膜相关淋巴瘤(MALT)的发生、发展密切相关,1994年,Hp已被世界卫生组织国际癌症研究机构(IARC)列为Ⅰ类致癌原;2015年《幽门螺杆菌胃炎京都全球共识》的指出Hp胃炎是一种传染性疾病,存在人传染人现象。业已证明,幽门螺杆菌一旦感染后将在胃黏膜表面及其小凹中定植,形成难以自我清除的慢性感染,是胃肠道及肠道外幽门螺杆菌感染相关疾病的致病因子。本研究证明了随粪便排出体外的Hp在湿润食物中2 W内可以生存并成功感染动物胃黏膜及胃小凹表面。
众所周知,在个体之间传播或传染的病原微生物,通过阻断传播途径,是最有效的防治措施,降低Hp人群感染率也不例外。但由于幽门螺杆菌确切传播途径目前仍知之甚少,尚难以在阻断传播的关键环节上精准施策,导致一些措施可行性差,如家庭成员间如何阻断传播,不可能简单将家庭成员隔离。Hp传播可能与不同人种、民族、年龄、地域环境、饮食习惯、生活习俗以及不同的社会活动接触方式等诸多因素有关。全球有很多关于Hp感染率的横断面研究,在众多研究进行年龄分组分析大致得出一个结论:从新生儿期开始感染率随年龄增长而逐渐递增,40~50岁时达到高峰,随后逐渐下降,且发展中国家感染患病率随年龄增长迅速增加,而在发达国家,Hp感染在儿童时期较低,随着年龄的增长而缓慢增加。广西百色市的一项研究发现,在321名壮族学龄前儿童中HpSA检测阳性者83例(25.9%),3岁、4岁、5岁、6岁的阳性率分别为15.79%、20.27%、26.43%、34.95%,而在该地区成人的感染率约为42.09%,在成人的各年龄组中感染率无差异,可见阻断幽门螺杆菌感染的关键时期为儿童时期;只有掌握其传播的主要途径规律,才能精准干预。本研究发现,胃黏膜、胃液及粪便标本在体外2 W内不同时间点均可经食物传播途径传播Hp,三者差异无统计学意义;胃黏膜中的Hp传播总的概率(24.48%)高于粪便标本(14.06%),但两者差异无统计学意义;粪便来源的Hp感染率似乎高于胃液来源者,但差异也无统计学意义,提示粪便内Hp的传染性与胃黏膜的Hp相当,而空腹中抽取的胃液内的Hp可能受胃酸的作用后传染性下降。而口腔含漱液中,Hp筛查无DNA物质存在,提示经唾液传播可能十分罕见,有待增加实验例数进一步证实;对照组阴性标本中无一例被传染,进一步证实上述实验标本中含有可致病Hp的食物摄入,可经口传染到下一宿主的胃黏膜定植感染。 综合上述,推测Hp可在胃内随着胃液、食物混合,可耐受各种消化酶的作用,经肠道随粪便排出,成为公众日常宿主间传染的最主要途径。同时,Hp从胃黏膜到体外过程,传染能力可能有所递减。
口-口传播方式曾被认为是发达地区家庭内传播的重要途径。许多研究假设胃液中的Hp可能通过呕吐、胃食管反流进入口腔并滞留在口腔唾液、牙龈、牙斑上,然后通过唾液传播。有研究发现Hp可以在唾液中培养出来,牙齿的牙菌斑、口腔、食道、扁桃体组织中也可以培养出来,这也就支持人类传播可能通过口-口途径进行的观点, KIVI等对39个家庭104名对象进行调查提示,除了母子/女、兄弟姐妹间直接传播,配偶间可能通过共用生活用具、接吻传播。SGAMBATO等研究结果显示,幽门螺杆菌感染的性伴侣中幽门螺杆菌感染率为74.5%,而对照组幽门螺杆菌感染率为32.3%。FURUTA等对日本五个家庭的所有成员包括父母和孩子共19个Hp菌株的全基因测序研究,检测核苷酸替换情况以显示可能存在的传播途径,发现每个家庭均存在全基因测序完全相同或多位点序列分型(MLST)中多位点序列非常相似的菌株,说明Hp通过接触感染,其中4个家庭中的子女感染菌株来自其母亲或父亲,但值得注意的是,其中1个家庭的Hp感染菌株并非来自他们的父母,而是来自家庭外并且在3个子女中为同一菌株,进一步证实Hp感染是在家庭成员中的密切接触而感染,但感染源不一定是来自父母,也可能是来自同一环境感染如水源、食物等,也可能是其中一个感染后传播给其他兄弟姐妹。虽然许多研究间接支持口-口传播途径,但当前研究缺少充分的直接证据,共同生活及密切接触同样增加粪-口途径的传播。本研究通过PCR检测,在胃液中发现Hp存在(16.67%),但无论是Hp阳性还是阴性者,其唾液中均未检测到Hp遗传物质存在,提示口-口传播罕见,作为主要途径的假说仍存在争议。
随着研究的不断深入,粪-口传播方式被认为是发展中国家的主要传播途径,早期LAPORTE等在法国开展一项队列研究发现,福利院中青少年腹泻期间可发生Hp传播。PCR检测同一患者粪便和胃黏膜分离菌株的cagA基因和空泡毒素信号序列s1a基因(vacA s1a)一致,在人末段结肠和直肠的分泌物中均可培养得到Hp。这为粪-口传播提供了生物学依据。本研究可以显示,被胃黏膜、粪便以及胃液来源Hp直接污染的食物,在体外放置14天内,均可使实验小鼠感染,也支持粪-口传播为主要传播途径的观点。
污染的饮用水、食物摄入的行为,可能是Hp传播途径的主要环节。根据幽门螺杆菌的流行病学特征,如在封闭的家庭和生活群体中存在较高的感染率,除了直接传播外,这种细菌还可能通过一个共同的来源间接传播,例如通过食用同一桌的同一种食物等。有研究证实了幽门螺杆菌在水、牛奶、即食食品、蔬菜、巴氏灭菌苹果和橙汁、绞碎的牛肉和干发酵香肠中存活,其存活方式仍有待研究,例如蔬菜尽管有表面暴露在氧气和干燥环境中及大量天然菌群的存在等不利条件,但Hp能形成生物膜而继续存活下来,流行病学发现Hp感染在卫生条件较差的地理区域更普遍,更易被细菌污染食物。因此,Hp也被认为是一种食源性致病菌。
病原菌导致传染病发生的基础是病原菌成功定植传染,与菌株类型、黏附能力、体外环境生存能力、感染人体细菌数量、靶器官微环境、宿主免疫等因素有关, Hp的传染也应遵循这一规律。Hp是一种螺旋状、微需氧的革兰阴性菌,细菌具有鞭毛结构,全球约有50%的人员胃内可测出Hp的定植,然而只有约15%的感染者出现临床症状。不同菌型的Hp可能存在不同的传染能力及致病作用,目前认为具有细胞毒素相关基因致病岛(CagPAI)相关基因表达的菌株具有更强的传播能力及致病性,Hp与胃黏膜上皮细胞黏附后,细胞毒素相关基因A(CagA)表达的CagA蛋白和其他毒力因子通过4型分泌系统(T4SS)注射至细胞内,导致宿主胃黏膜上皮细胞一系列的病理活动,使胃黏膜上皮细胞的紧密连接和细胞的极性功能紊乱,从而有效地定植并发生炎症反应。胃微环境对Hp定植能否成功也有明显关系,肠道微生物群和宿主反应之间的交互作用构成人体胃内稳态,其机制可能与肠道微生物群与宿主胃肠道抗菌肽(AMPs)之间的协作关系,抑制入侵的微生物定植。在Hp感染的个体中,肠道微生物可能会转移,以促进胃炎症和相关疾病发生,AMPs在对Hp的先天免疫反应中具有重要意义,并与复杂的微生物群共同参与保守进化。氧化三甲胺(TMAO)是一种与饮食相关的微生物代谢物,与炎症和代谢性疾病有关,WU等研究显示,体外实验TMAO不仅增加了Hp生长代谢相关基因的表达和脲酶活性,而且增加了毒力因子的产生;动物实验提示TMAO的摄入,增加了Hp感染小鼠的炎症标志物的产生,并降低了肠道菌群的丰富度和多样性;提示TMAO可能通过增加幽门螺杆菌的生存能力和毒力来加重幽门螺杆菌诱导的炎症,并可能与Hp感染小鼠的肠道微生物群相关。HUANG等研究表明,丁酸(SB)是一种与饮食有关的微生物代谢产物,与炎症、代谢综合征和其他疾病有关,体外实验表明,SB不仅能抑制幽门螺杆菌的生长,还能降低CagA和VacA的mRNA表达。摄入SB可减少幽门螺杆菌感染小鼠毒力因子的产生,通过降低Toll样受体(Toll-like receptor,TLRs)的表达抑制IκBα/NF-κB通路,并减少TNF-α和IL-8的产生。这2项研究显示饮食衍生的代谢产物如TMAO和SB对Hp感染及其诱导的疾病发展产生促进或抑制的影响,即胃内微环境可对Hp的定植及致病作用的影响。
关于宿主免疫反应对Hp感染的影响机制也未完全清楚。其中Hp感染的免疫因子的关系研究较多,包括白细胞介素类(IL)、TNF-α、干扰素-γ(IFN-γ)、高敏C反应蛋白、血管内皮生长因子(VEGF)等,DEWAYANI等发现IL-23在Hp感染患者中的表达,与中性粒细胞和单核细胞浸润程度呈正相关,且IL-23与IL-21、IL-17一起直接或间接地在炎症部位形成中起作用。Hp感染患者胃上皮细胞中IL-10作为抗炎细胞因子的基因表达水平与CagA基因型有关,且Hp CagA基因型与胃炎患者胃上皮细胞IL-10基因表达增加之间呈正相关。YU等研究发现,Hp感染儿童IL-8、IL-18和IFN-γ的表达水平显著高于非Hp感染儿童。此外,还有研究表明,慢性胃炎患者血清hs-CRP水平升高。TEMESGEN等研究发现,幽门螺杆菌感染的消化不良患者的高密度脂蛋白(HDL)降低和hs-CRP水平升高可能增加动脉粥样硬化、内皮功能障碍和其他心血管疾病的风险,可能是由于Hp含有各种毒力因子,如CagA和VacA。CagA是一种由幽门螺杆菌产生的高毒力因子,在Hp诱导的炎症中具有更大的作用,引起胃和胃外低度全身炎症。
本研究尚未覆盖Hp传播的全程,在动物实验中仅以1例感染者的菌株进行建模,未对菌株类型进行筛选、比较,同时研究的规模有限,但仍然可以得出明确的结论, Hp感染者的Hp可以适应肠道环境随粪便排出体外,再污染食物或水源,实现人与动物之间的传播。可以推测粪-口传播可能是人与人之间Hp传播最常见、最基本的途径。
综上所述,幽门螺杆菌感染主要途径可能以粪-口传播为主,口-口传播可能只是偶然事件。粪-口传播途径的主要环节可能是:体内(胃黏膜→食物→肠道→粪便)→体外(污染食物或饮用水→进食)→下一宿主胃黏膜。下一步需要增加动物模型实验规模,并综合运用Hp分离培养、全基因测序分型及溯源、胃黏膜微环境、宿主免疫应答等结合的系统研究,积累更多的证据链加以证实。

