基于网络药理学研究牛膝-补骨脂治疗绝经后骨质疏松症的作用机制
周大标 吴冰心 汪松林 吴 钒 李志钢
(1. 湖北中医药大学, 湖北 武汉 430065; 2. 湖北省中西医结合医院 骨科, 湖北 武汉 430015; 3. 南京中医药大学 附属苏州市中医院 骨科, 江苏 苏州 215009)
绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)是女性最常见的骨骼疾病,以骨量减少、骨组织微结构退化导致骨脆性增加为特点。由于绝经后女性卵巢功能衰退导致雌激素分泌不足,后者对破骨细胞的抑制作用减弱,致使骨吸收大于骨形成,使骨骼出现骨丢失的病理变化[1]。PMOP在古代医籍并无病名记载,中医如今将其归纳为“骨痿”“骨枯”等范畴。《素问·上古天真论》曰:女子七七,任脉虚,天癸竭,地道不通,因此认为“肾虚精亏”是女性PMOP发生的主要病机,肾主骨生髓,肾虚则精血化生无源,精枯髓减则导致骨骼脆性增加,痿弱难用,故而引发PMOP[2]。
PMOP与其他慢性疾病一样,需要长期个体化治疗。服用抗骨质疏松西药需要联合或序贯治疗,存在副作用大、有药物假期以及停药后骨量会迅速下降等问题[1]。因此,亟待探索更有效的药物及治疗思路。近年研究表明,中医中药治疗PMOP效果显著,其价格适中、不良反应小并且可整体调节[3]。
网络药理学可识别和筛选出有效活性成分及作用于疾病的潜在作用靶点,并构建相互作用网络,为中医药治疗疾病提供崭新理念和研究途径。牛膝、补骨脂具有补肾阳、滋肾阴、填精髓功效。现代药理研究表明,两药具有抗肿瘤、抗骨质疏松、抗氧化、抗炎、减少骨量丢失等多种药理作用[4-5]。两药药性温和、不良反应小,常用于肝肾亏虚型PMOP的治疗。牛膝-补骨脂药对成分复杂,其作用机理仍不完全清楚,本研究基于网络药理学分析牛膝-补骨脂的活性成分、作用靶点及其可能的作用机制,以期为临床应用提供理论依据。
1 资料与方法
1.1 数据库与统计学软件
中药系统药理学数据库TCMSP、TCMID及Swiss Target Prediction,人类孟德尔遗传数据库OMIM数据库(https://omim.org/),基因组数据库Genecards,药物靶标数据库(therapeutic target database, TTD),蛋白相互作用String数据库。应用的软件包括Venny 2.1,Cytoscape 3.8.2,R 4.0.5软件等[6]。
1.2 方法
1.2.1 “牛膝-补骨脂”药对主要活性成分及靶点筛选
在TCMSP及TCMID数据库中检索“牛膝,补骨脂”成分,口服利用度(oral bioavailability, OB)≥30% 和类药性(drug like ness, DL)≥0.18 表示化合物能被较好吸收循环并具有更好的药理特性,以此为筛选条件从TCMSP获取有效成分对应的靶点。
1.2.2 PMOP相关靶点获取
以“postmenopausal osteoporosis”为检索词,在GeneCards、OMIM、TTD数据库中检索得到PMOP相关靶点,对搜集到的疾病靶点处理、去重后得到PMOP的相关靶点。
1.2.3 “牛膝-补骨脂”药对与PMOP共同靶点的筛选
运用Venny 2.1软件将1.2.1获得的“药物-靶点”与1.2.2获得的“疾病-靶点”进行映射,绘制Venny图并得到“牛膝-补骨脂”药对治疗PMOP的交集潜在作用靶点。
1.2.4 “中药-成分-靶点-疾病”网络构建及分析
标识1.2.3步骤获取的靶点集导入Cytoscape 3.8.2软件构建“药材-成分-靶点-疾病”网络图。使用Network Analyzer功能对牛膝、补骨脂的活性成分进行分析,筛选出核心成分并对其进行分析。
1.2.5 靶点蛋白与蛋白相互作用网络分析
将1.2.4中获取的药物-疾病潜在化学成分的共同靶点蛋白上传至在线STRING数据库,物种选择“Homo sapiens”获取蛋白互作信息,设置最低相互作用阈值0.4并构建蛋白相互作用(protein-protein interaction,PPI)网络图。
1.2.6 GO生物功能与KEGG通路富集分析
基于R软件获取“牛膝-补骨脂”中药治疗PMOP的关键靶点,以Pvalue<0.05,Qvalue<0.05进行GO(gene ontology)与KEGG(Kyoto encyclopedia of genes and genomes)分析,探讨“牛膝-补骨脂”药对治疗PMOP的相关生物过程及信号通路,并将结果以条形图和气泡图形式呈现。
1.2.7 分子对接实验
将牛膝、补骨脂中筛选出来的关键活性成分作为配体,核心蛋白靶点作为受体进行分子对接实验并将其可视化处理。
2 结果
2.1 “牛膝-补骨脂”药对主要活性成分、靶点预测以及PMOP作用靶点
通过TCMSP、TCMID数据库获取中药牛膝、补骨脂化合物及靶点,并对牛膝、补骨脂的有效成分进行筛选,共得到潜在活性成分53个(见表1)。

表1 中药-成分-靶标基本信息统计表
使用Swiss Target Prediction筛选出648个药物靶点;以“postmenopausal osteoporosis”为关键词,分别在OMIM、Genecards、TTD数据库进行检索,对搜集到的PMOP靶点去重处理后共获得靶点700个。
2.2 “牛膝-补骨脂”药对与PMOP共同靶点的筛选
使用Venny 2.1软件输入筛选得到的648个药物靶点和700个疾病靶点,绘制交集韦恩图获得药物-疾病共同靶点135个(见图1)。
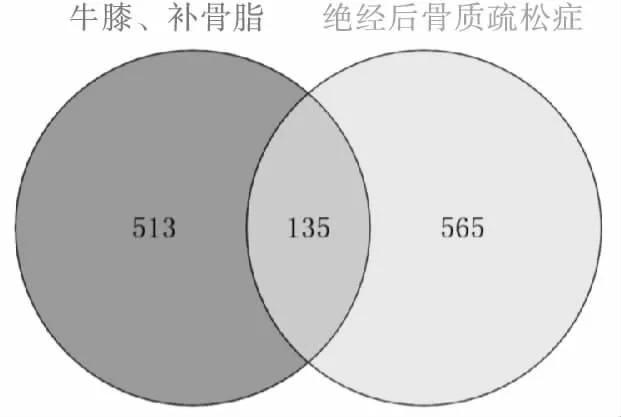
图1 牛膝-补骨脂与PMOP靶点韦恩图
2.3 构建“药物-活性成分-PMOP-作用靶点”网络
将牛膝-补骨脂筛选出的53个潜在活性成分与135个药物-疾病共同靶点输入Cytoscape 3.8.2软件中,绘制出“药物-成分-靶点-疾病”相互作用的网络图(见图2)。使用Network Analyzer对网络图进行核心成分拓扑分析,Degree值越大说明该成分越重要。Degree值靠前的活性成分,主要有脱皮甾酮、黄芩素、补骨脂查尔酮、山奈酚、槲皮素等。

注:橙色代表药物,紫色代表牛膝-补骨脂中的52种活性成分(1个靶点无交集,予删除),绿色代表135个共同靶点,红色代表疾病;PMOP:绝经后骨质疏松症; Psoralea Corylifolia: 补骨脂; Achyranthes Bidentata:牛膝
2.4 蛋白互作网络构建及核心靶点分析
将135个交集靶点利用STRING软件构建PPI网络图(见图3A),邻接节点数目越多表示该基因在PPI中处于核心位置并起关键作用。将PPI网络导入Cystoscap 3.8.2中,通过Network Analyzer进行拓扑分析,筛选核心靶点,前30个靶点使用R 4.0.5绘制条形图(见图3B)。结果显示,蛋白激酶(AKT)、肿瘤坏死因子(TNF)、雌激素受体(ER)、应激活化蛋白激酶(JUN)等涉及代谢、增殖、细胞存活可能是“牛膝-补骨脂”药对治疗PMOP的核心靶点基因。
2.5 “牛膝-补骨脂”药对治疗PMOP的KEGG通路分析
经R语言运行135个共同靶点后得到143条KEGG通路,排列前20的结果以KEGG功能富集条形图(见图4)呈现。富集结果显示,主要与化学致癌作用受体激活、糖尿病中的AGE-RAGE信号通路、癌症中的蛋白多糖、脂质和动脉粥样硬化等涉及代谢、炎症、免疫、抗氧化的多个方面相关。

图4 “牛膝-补骨脂”药对治疗PMOP的KEGG富集分析
2.6 “牛膝-补骨脂”药对治疗PMOP的GO富集分析
将135个共同靶点经R语言运行后GO分析选取生物学过程、细胞组分及分子功能3部分,具体结果见气泡图(见图5)。气泡大小、颜色分别代表基因个数与P值,气泡越大基因个数越多,颜色越红P值越小。GO结果显示,富集的2 064条生物学过程通路中,主要涉及类固醇代谢、平滑肌细胞增殖、腺体发育、衰老及营养物质代谢调节通路等;富集的46条细胞组分表达过程中,主要涉及膜区、脂筏、膜微区、质膜外侧、内质网腔体及转录调节器复合体等;富集的120个与分子功能相关的过程中,主要涉及核受体活性、转录因子活性、类固醇集合及血色素结合等。
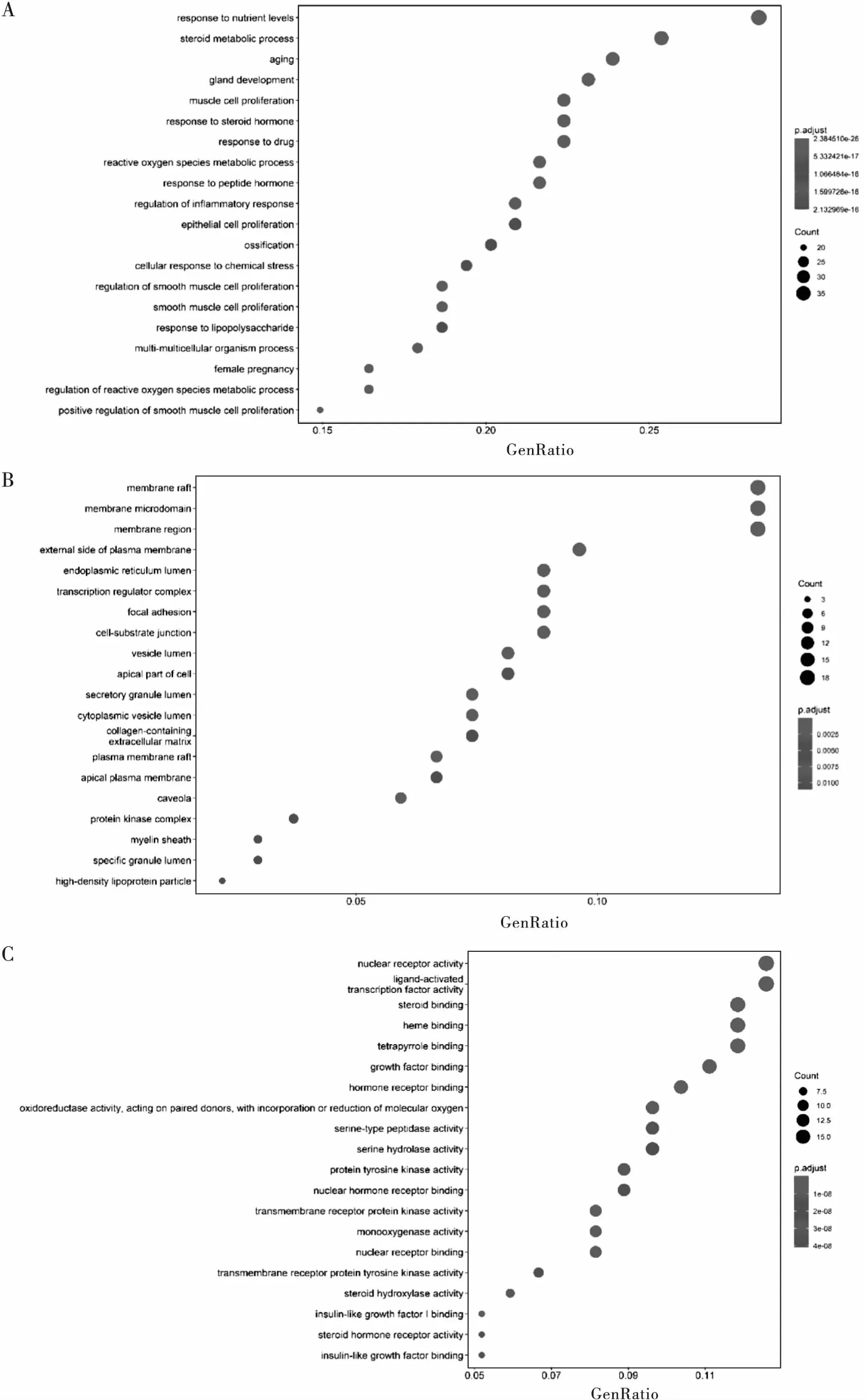
A:生物学过程富集气泡图; B:细胞组分富集气泡图; C:分子功能富集气泡图
2.7 关键靶点的分子对接验证
采用AutoDock Vina软件将牛膝、补骨脂主要成分与TNF、AKT1、ESR1、JUN进行分子对接,结合能越小,成分与靶点蛋白结合越好。TNF与山奈酚结合能为-34.3 kJ/mol(见图6A)、AKT1与β-脱皮甾酮为-32.5 kJ/mol(见图6B)、ESR1与黄芩素为-31.4 kJ/mol(见图6C),JUN与槲皮素为-22.7 kJ/mol(见图6D)。

注:A:TNF与山奈酚;B:AKT1与β-脱皮甾酮;C:ESR1与黄芩素;D:JUN与槲皮素
3 讨论
既往研究显示,牛膝和补骨脂两药配合使用,增强药效,可在多层面、多途径及多靶点上发挥益精填髓、补肾强骨之功效[7]。网络药理学可整体、系统地分析药物治疗疾病的机制。基于网络药理学方法,研究发现牛膝、补骨脂治疗PMOP的活性成分有β-脱皮甾酮(beta-ecdysterone)、黄芩素(baicalein)、补骨脂查尔酮(bavachalcone)、山奈酚(kaempferol)、槲皮素(quercetin)。其中β-蜕皮甾酮具有促进蛋白质合成、抗疲劳、促增殖、调节免疫的作用。β-蜕皮甾酮通过干扰破骨细胞的活性来抑制骨吸收,诱导间充质干细胞的成骨分化,减少其凋亡,并通过内质网相关的信号通路减轻骨质疏松症的发展[8]。黄芩素通过破坏Wnt/β-catenin通路,降低破骨细胞的骨吸收活性并抑制破骨细胞分化,进而促进破骨细胞凋亡和自由基清除作用[9]。山奈酚通过调节雌激素受体,抑制脂肪生成和氧化应激,从而调节破骨细胞自噬和成骨细胞凋亡[10]。槲皮素通过抗氧化、抗炎,抑制破骨细胞生成的同时促进成骨[11]。补骨脂查尔酮具有延缓衰老的作用,通过干扰细胞外调节蛋白激酶(ERK)和AKt通路抑制前体细胞向破骨细胞分化[12]。
通过PPI网络构建以及拓扑分析后,我们认为AKT1、TNF、ESR1及JUN等可能是“牛膝-补骨脂”药对治疗PMOP的核心靶点基因。ERK调节细胞增殖和分化,活化PI3K磷酸化下游信号蛋白可减少破骨细胞自噬。肿瘤坏死因子的增加可促进Rankl表达,影响骨质流失并在骨骼重建中发挥重要作用[13]。雌激素受体是一种关键的调节激素。软骨细胞中的雌二醇通过靶向激活ESR1,抑制细胞外信号调节激酶(Erk2)的磷酸化活化,从而增加自噬通量并调节细胞增殖和分化,减少软骨细胞凋亡[14]。应激活化蛋白激酶直接与特定的靶DNA序列相互作用,调节基因表达,通过激活c-Fos/c-Jun通路促进Rankl介导的破骨细胞形成和骨吸收,并诱导去卵巢小鼠的骨质流失[15]。
GO与KEGG通路富集分析结果显示,本研究主要涉及化学致癌作用受体激活、糖尿病AGE-RAGE信号通路、癌症蛋白多糖、脂质和动脉粥样硬化等通路。化学致癌作用-受体激活通路主要发挥抗肿瘤活性、改善葡萄糖代谢、减少围绝经期和绝经后潮热,以及调节抗氧化作用[16]。糖尿病AGE-RAGE信号通路具有增加成骨的功能。AGEs不仅通过上调RANKL诱导破骨细胞生成,还可通过抑制细胞生长、促进细胞凋亡和下调分化来影响成骨细胞[17]。癌症中的蛋白多糖存在于基底膜和细胞外基质中,充当基质支架、生长因子库和组织屏障[18]。脂质和动脉粥样硬化通路可诱导炎症细胞因子、肿瘤坏死因子-α和白细胞介素-1的产生增加,加上衰老诱导氧化应激,更年期性激素产生减少,导致核因子κB配体受体激活剂水平增加,这可能参与骨质流失和血管钙化,导致钙从骨骼转移到血管壁[19]。
综上所述,本研究基于网络药理学发现牛膝-补骨脂治疗PMOP的主要活性成分有脱皮甾酮、黄芩素、补骨脂查耳酮、山奈酚及槲皮素等。这些成分有可能是通过多种信号通路和多个途径作用于蛋白激酶、肿瘤坏死因子、雌激素受体及应激活化蛋白激酶等多个核心靶点基因,发挥抗炎、抗衰老及抗氧化的作用,同时抑制破骨细胞活性,促进成骨细胞分化,从而达到骨代谢的动态平衡。通过网络药理学方法,建立可视化网络,从多角度分析“牛膝-补骨脂”治疗PMOP的药理机制,为其临床应用提供了更多的理论支撑。但本研究也显示了很多未知的分子通路及作用机制,因此需要更进一步的实验研究来探讨牛膝-补骨脂治疗PMOP的其它作用机制。

