不同溶剂对皂荚皂素提取及性能影响的比较研究
庞天鸿,蒋建新,张锋伦,马世宏,陈殿松,朱莉伟*
(1.北京林业大学材料科学与技术学院国家林业和草原局木本香料(华东)工程研究中心,北京 100083;2.南京野生植物综合利用研究所,江苏 南京 211111;3.广州德谷个人护理用品有限公司,广东 广州 510880)
在我国,皂荚(Gleditsia sinensisLam.)的种植区域非常广泛,约占总面积的50%,大多数分布于黄河以南的地区[1]。皂荚中含有丰富的皂素,是一种天然的表面活性剂。皂素的提取工艺主要包括有机溶剂提取和水提取,或者两者以一定的比例混合以获得不同极性的溶剂进行提取[2-3]。三萜皂素是皂荚中的主要活性物质,由于其良好的生物活性,如抗炎、抗菌和抗氧化等多种功能,在过去的几年里一直被学者深入研究[4-5]。随着石油资源的不断消耗和环境问题的日趋严重,合成表面活性剂的生产成本越来越昂贵。大量合成表面活性剂的使用对环境造成了严重的污染,对人体健康也产生了不可忽视的负面影响。因此,表面活性剂必须朝着天然、绿色和可再生的方向发展[6],而皂荚皂素正是一种具有巨大潜力的生物表面活性剂。目前对于不同溶剂提取粗皂素中所含成分的差异研究较少,因此本研究以皂荚果皮为原料,选用水、80%乙醇、无水乙醇三种溶剂分别提取三次,分析测定粗皂素得率和粗皂素中的化学成分,并对其表面活性进行了比较研究。
1 材料与方法
1.1 原料、试剂和仪器
皂荚果皮,干燥、粉粹、过60目筛,存放于自封袋中备用。无水乙醇、盐酸、硼酸、浓硫酸、氢氧化钠、硫酸钾、硫酸铜、没食子酸、福林酚、碳酸钠、碳酸钙,均为分析纯试剂;乙腈和甲酸为色谱纯;纤维二糖、葡萄糖、木糖、鼠李糖、阿拉伯糖、甘露糖为标准品(Sigma公司);绿原酸、槲皮素、儿茶素、根皮苷、根皮素、表儿茶素为标准品(Macklin公司)。
R203型旋转蒸发仪(上海申生科技有限公司);ALPHA-T型红外光谱仪(德国Bruker公司);SCIWNTZ-18N型冷冻干燥机(宁波新芝生物科技股份有限公司);SKO-08S2型红外智能消化炉(上海沛欧分析仪器有限公司);SKD-100型自动凯氏定氮仪(上海沛欧分析仪器有限公司);2151型罗氏泡沫仪;Agilent 1260型高效液相色谱(美国Agilent公司);UV-6100A型紫外可见分光光度计(上海比朗仪器有限公司);YSQ-LS型全自动灭菌锅(上海博讯医疗生物仪器股份有限公司);BZY-101型自动表面张力仪(上海方瑞有限公司)等。
1.2 原料水分的测定
采用GB5009.3—2016《食品中水分的测定》[7]测定皂荚果皮水分含量为(7.49±0.07)%。
1.3 粗皂素的提取
分别选用三种试剂(水,80%乙醇,无水乙醇)提取三次,提取条件如表1所示。水提取液采用冷冻干燥,80%乙醇和无水乙醇提取液经旋蒸浓缩后真空干燥。所有粗皂素提取物干燥后,装入自封袋,放入干燥器中保存备用。粗皂素得率根据下式进行计算:


表1 不同次数提取皂素的条件Tab.1 Conditions for extraction of saponin in different times
式中:Y-粗皂素得率,%;m1-粗皂素质量,g;m2-原料质量,g。
1.4 化学成分测定
1.4.1 蛋白质
根据国家标准GB5009.5—2016《食品中蛋白质的测定》[8],采用凯氏定氮法测定蛋白质含量。蛋白质含量根据下式进行计算:

式中:Y-蛋白质含量,%;V1-试液消耗盐酸标准滴定液的体积,mL;V2-试液空白消耗盐酸标准滴定液的体积,mL;c-盐酸标准滴定溶液浓度,mol/L;m1-粗皂素质量,g;F-氮换算为蛋白质的系数,本试样为6.25。
1.4.2 黄酮
根据标准仁果类水果中类黄酮的测定(NY/T2741—2015),采用高效液相色谱法(High performance liquid chromatogroply,HPLC)测定粗皂素中黄酮的含量,绿原酸、槲皮素、儿茶素、根皮苷、根皮素、表儿茶素为6种标准品。
HPLC分析条件为:色谱柱为C18-PLUS柱(4.6 mm×250 mm),流动相A为0.1%甲酸,流动相B为0.1%甲酸:乙腈(50:50,v/v),洗脱梯度为:0~45 min,23%~50%B;45~65 min,50%~80%B;65~68 min,80%~100%B;68~73 min,100%B;73~76 min,100~23%B;76~80 min,23%B。流速为1 mL/min,柱温为40℃,进样量为10μL,检测器为DAD,检测波长为280 nm(原花青素)、330 nm(酚酸)、360 nm(黄酮醇及其糖苷)。
1.4.3 总多酚
根据植物提取物及其制品中总多酚含量的测定(T/AHFIA005—2018),采用福林酚分光光度法测定粗皂素中总多酚的含量。
分别移取9.4 mg/L没食子酸标准溶液1.0、2.0、3.0、4.0、5.0、6.0 mL于10 mL容量瓶中,加入1 mL福林酚试剂,摇匀,加入2.5 mL 15%碳酸钠溶液,加水定容摇匀,放入40℃水浴锅中恒温60 min,冷却至室温。配 制 成 浓 度 为0.94、1.88、2.82、3.76、4.70、5.64 mg/L的标准溶液,在778 nm测量其吸光度值。以浓度为横坐标,吸光度为纵坐标进行线性回归,回归方程为:Y=0.01358X-0.013(R2=0.996)。吸取1.0 mL待测液于10 mL容量瓶中,按相同方法测定其吸光度值,根据标准曲线计算待测液中总多酚的浓度。
1.4.4 皂素组成
采用稀酸水解法,准确称量0.300 0 g粗皂素加入86.73 mL 4%的硫酸溶液,121°C水解1 h,冷却至室温,中和,采用高效液相色谱法测定水解后粗皂素中单糖的含量C单糖,对剩余固体残渣进行干燥得出皂苷元含量C皂苷元。另外再取粗皂素配成水溶液,采用高效液相色谱法测定粗皂素中游离糖的含量C游离糖,将粗皂素中的游离糖统称为游离碳水化合物。

HPLC分析条件为:HPX-87P柱(300 mm×7.8 mm),流动相为水,流速为0.6 mL/min,柱温为75℃,进样量为5μL,检测器为ELSD。
1.5 表面张力的测定
称取0.2 g粗皂素,采用去离子水溶解,定容于50 mL容量瓶中,得到4 g/L的溶液并逐级稀释至2、1、0.5、0.25、0.125、0.062 5、0.031 25 g/L。将不同浓度梯度的粗皂素溶液,放入30℃水浴锅中恒温30 min,测量其表面张力,取三次的平均值。以表面张力作为纵坐标,浓度的对数lgC作为横坐标,绘制表面张力折线图,根据其拐点得出相对应的临界胶束浓度(Critical micelle concentration,CMC)。
1.6 泡沫高度的测定
根据国家标准GB/T13173—2021《表面活性剂 洗涤剂试验方法》[9],采用Ross-Miles法测定泡沫高度。
1.7 红外光谱
分别将不同溶剂第一次提取粗皂素与溴化钾以1:100比例混和均匀,研磨后压制成片。采用傅立叶变换红外光谱仪,在400~400 0 cm-1区间扫描。
2 结果与讨论
2.1 粗皂素得率
由表2可知,不同溶剂三次提取粗皂素得率随着提取次数逐渐降低,总得率依次为水>80%乙醇>无水乙醇,水提粗皂素总得率达到(51.45±1.26)%,而且第一次提取后粗皂素得率均可以达到总得率的84%以上,经过两次提取后粗皂素得率均超过总得率的95%,因此以第一次和第二次提取的皂素作为组成和性质分析的对象。根据原料利用和能量消耗两方面考虑,提取两次较为合适。水和80%乙醇提取粗皂素得率高于无水乙醇,其原因为水和80%乙醇为强极性萃取溶剂,根据相似相溶的原理将皂荚果皮中极性物质更多的提取出来。对于粗皂素的提取,水是可以接触到的“最绿色的溶剂”,它廉价易得、无毒、不易燃、对环境友好,单纯从粗皂素得率来看,水优于有机溶剂[10-11]。

表2 不同提取次数和不同溶剂提取粗皂素的得率Tab.2 The yield of crude saponin extracted with different extraction times and different solvents
2.2 粗皂素化学组成
2.2.1 蛋白质、黄酮、总多酚和游离碳水化合物
从表3中可以看出,水提取粗皂素中所含的蛋白质含量最高,80%乙醇和无水乙醇提取粗皂素中蛋白质含量依次降低。蛋白质分为水溶性蛋白和醇溶性蛋白,表明皂荚果皮中含的蛋白质大部分为水溶性蛋白,小部分为醇溶性蛋白。随着提取次数的增多,蛋白质的含量大幅度降低,含量均低于1%,说明蛋白质被大部分提取出来。在提取过程中,含有皂素的提取液会对蛋白质产生增溶作用,使其易于溶解[12-13]。

表3 不同提取次数和不同溶剂提取粗皂素中的蛋白质、总多酚和游离碳水化合物含量Tab.3 The contents of protein,total polyphenols and free carbohydraten in crude saponin were extracted with different extraction times and solvents
高效液相色谱测定不同溶剂提取粗皂素中黄酮类化合物与6种黄酮标准品对比结果发现:三种溶剂提取粗皂素不含绿原酸、根皮苷和根皮素;水和80%乙醇提取粗皂素中含有槲皮素,而无水乙醇提取粗皂素不含槲皮素;三种溶剂提取粗皂素中都含有表儿茶素。由于所测黄酮类化合物含量极低,没有进一步进行准确定量。
从表3中可知,不同溶剂提取粗皂素中总多酚含量依次为80%乙醇≈水>无水乙醇,且总多酚含量随着提取次数增加而增加。多酚类化合物的极性介于水和无水乙醇之间,一般采用无水乙醇、甲醇等有机溶剂进行提取,由于有机溶剂的极性较小,通常加入水来调节极性以获得更高的得率[14]。因此,80%乙醇提取的粗皂素总多酚含量是无水乙醇提取的2倍左右,多酚类化合物具有与蛋白质、多糖、酶和金属离子反应的活性,并具有抗氧化和抑菌的特性[15-17]。如图1所示,无水乙醇提取粗皂素呈黄色,颜色最浅;水提取粗皂素呈黄褐色;80%乙醇提取粗皂素颜色较深,呈现黑褐色。尽管多酚类化合物在皂素中的含量不高,但会对皂素的颜色造成影响,而且单宁等多酚类化合物易被多酚氧化酶和空气氧化成醌类化合物,使皂素颜色加深[18-19]。因此,多酚类化合物和色素类物质的脱除对皂素的纯化和脱色具有重要意义。

图1 不同溶剂提取的粗皂素照片Fig.1 Photos of crude saponin extracted by different solvents
如表3所示,三种溶剂提取粗皂素中的游离碳水化合物含量比较接近,由8.5%左右的纤维二糖和4%~6%葡萄糖组成,因为纤维二糖和葡萄糖极性较大,且小分子糖的溶解度较高。在粗皂素的提取过程中,含有皂素的提取液有利于纤维二糖和葡萄糖的增溶,溶解度进一步提升。第二次提取粗皂素中葡萄糖含量较第一次有所提高,纤维二糖含量基本保持一致,表明皂荚果皮中含有大量的游离碳水化合物。
将不同溶剂提取粗皂素中蛋白质、总多酚和游离碳水化合物含量相加对比可得,水提取和80%乙醇提取粗皂素总含量在18%~20%之间,无水乙醇提取粗皂素总含量为16%左右,说明无水乙醇提取粗皂素中所含杂质最少。
2.2.2 皂素组成
皂素是由一种疏水性三萜或甾体苷元(皂苷元),通过醚或酯糖苷键连接到一个或多个亲水性糖部分[20]。皂素的水解是将皂素转化为皂苷元的过程,这取决于水解方法和条件,酸水解是水解皂素的首选方法[21]。皂树(Quillaja)皂素主要由三萜双糖苷组成,其糖链由葡萄糖、半乳糖、木糖、鼠李糖、阿拉伯糖和葡萄糖醛酸组成,位于三萜苷元的C-3和C-28位[12]。如表4所示,三种溶剂提取粗皂素中的单糖都是由葡萄糖、木糖、鼠李糖和阿拉伯糖组成,木糖占主要,其次是葡萄糖,种类与皂树皂素相似。4种单糖的质量浓度大小为:木糖>葡萄糖>鼠李糖>阿拉伯糖,摩尔比约为2.54:1.31:1.21:1.00,皂素上连接糖的种类和数量需进一步通过单体分离并进行核磁共振和质谱综合分析。不同溶剂第一次提取粗皂素中木糖含量为11%~14%,木糖含量大小依次为无水乙醇>80%乙醇>水,其他三种单糖含量基本一致。不同溶剂第二次提取粗皂素中不含有鼠李糖,且其他单糖含量有所下降,其原因可能为提取出来的多酚类物质会提供一种酸性环境以及长时间的高温浸提,促进了糖苷键的断裂。皂苷元含量逐渐增加,表明粗皂素纯度逐渐上升。

表4 不同提取次数和不同溶剂提取粗皂素中的皂素组成Tab.4 The saponin composition of crude saponin was extracted with different extraction times and different solvents
本文将粗皂素进行酸水解之后的糖类减去粗皂素的游离糖类,与皂苷元含量相加得出的皂素含量。粗皂素得率与皂素含量相乘可以得出皂素提取率,发现三种溶剂的皂素第一次提取率比较接近,约为22.5%。由此得出这三种溶剂对皂素的溶出效果接近,而对于杂质的溶出有差别,不同溶剂提取粗皂素中皂素含量依次为无水乙醇>80%乙醇>水,无水乙醇提取粗皂素中皂素含量最高为(58.57±1.55)%。
2.3 表面张力
如图2所示,不同溶剂提取粗皂素的CMC在0.5~1 g/L之间,其达到CMC的表面张力的大小为无水乙醇<80%乙醇<水,无水乙醇提取粗皂素最低表面张力为33.0 mN/m,具有更好降低水溶液表面张力的能力。水作为极性溶剂,可以溶解水溶性的一些物质如无机盐等,无机盐类物质会使表面张力升高。乙醇溶解度界于极性与非极性溶剂之间,既能溶解极性的一些物质如皂素、多酚等,又能溶解非极性的一些物质如树脂、挥发油等,少量脂肪也可被溶出。皂素水溶液中含有油脂类化合物,会对其界面性质产生影响,油脂类物质会在皂素分子之间的渗透,进而降低其表面张力[22]。无水乙醇提取粗皂素具有良好的降低水溶液表面张力的能力,其原因可能是其纯度高,能够在界面形成更均匀致密的表面膜,又与一些油脂类化合物形成了混合吸附层,对其表面活性产生了促进作用。
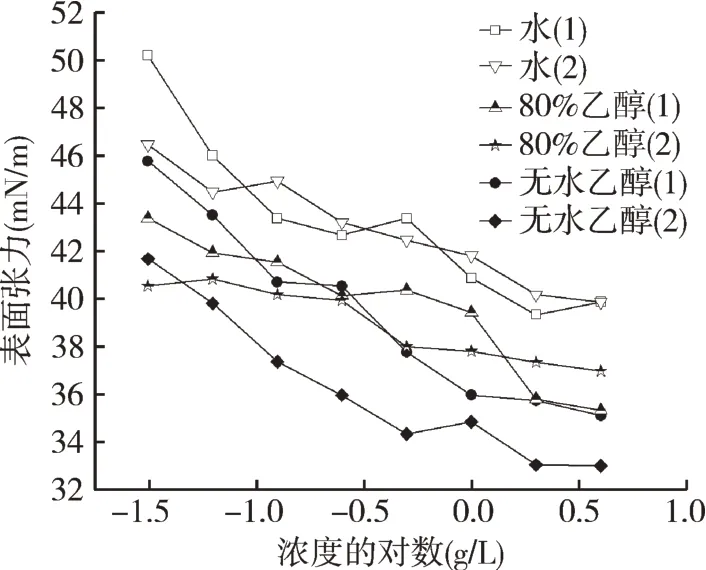
图2 提取次数和不同溶剂对粗皂素水溶液表面张力影响Fig.2 Effect of extraction times and different solvents on surface tension of crude saponin aqueous solution
2.4 泡沫高度
不同溶剂第一次提取粗皂素的泡沫高度见表5。从实验过程中发现,水提取粗皂素起泡性优异,水提取粗皂素水溶液(2.5 g/L)的泡沫高度达到43 mm,而80%乙醇和无水乙醇提取粗皂素水溶液的泡沫高度分别为15 mm和10 mm,三种溶剂中水提取粗皂素的发泡能力是最好的,但泡沫稳定性不佳。粗皂素中的蛋白质、糖类等可能对发泡能力有一定的影响。发泡能力和泡沫稳定性是泡沫最重要的性质,在达到CMC之前,表面粘弹性对泡沫稳定性有很大的改善作用,达到CMC后,胶束性能主要影响泡沫的寿命[23-25]。皂素与一些阴离子表面活性剂进行复配,可以同时增强表面粘弹性和胶束性能来增强泡沫稳定性,还可以对皂素进行改性,改变其胶束的界面性质,从而提高泡沫性能。

表5 不同溶剂第一次提取粗皂素的泡沫高度Tab.5 Foam height of crude saponin first extracted by different solvents
2.5 红外光谱
不同溶剂第一次提取粗皂素的红外光谱如图3所示,其中3 414 cm-1为皂苷元和糖链上羟基(O-H)的伸缩振动吸收峰;2 927 cm-1为亚甲基上烷基(CH)的伸缩振动吸收峰;2 861 cm-1为羧基(C-H)的伸缩振动吸收峰;1 721 cm-1为羧基(H-C=O)的伸缩振动峰,1 614 cm-1为α,β位上不饱和羰基(O-C=O)的伸缩振动峰,1 255 cm-1为羧基(C-OH)的伸缩振动峰,1 062 cm-1为碳水化合物(C-OH)的伸缩振动峰,不同溶剂第一次提取粗皂素与文献中皂素的伸缩振动峰相一致[26-28]。从图3中可以看出随着乙醇浓度的增加,1 721 cm-1和2 861 cm-1两个皂苷元的特征峰峰的吸收强度增强,表明皂素含量增加,与表4中的皂素含量相一致[29-30]。

图3 不同溶剂第一次提取粗皂素的红外光谱Fig.3 FTIR spectrum of extracting crude saponin with different solvents for the first time
3 讨论
不同溶剂提取粗皂素得率随着提取次数逐渐降低,经过两次提取后粗皂素得率可以达到总得率的95%以上。无水乙醇第一次提取得到的粗皂素纯度最高为(58.57±1.55)%。从粗皂素的纯度、表面张力以及工业化生产的综合角度来看,采用无水乙醇为溶剂进行两次提取是比较理想的提取工艺。
对不同溶剂提取粗皂素进行酸水解和高效液相色谱分析表明,皂荚皂素上的糖基主要由葡萄糖、木糖、阿拉伯糖和鼠李糖组成,4种单糖的质量浓度大小为:木糖>葡萄糖>鼠李糖>阿拉伯糖,摩尔比约为2.54:1.31:1.21:1.00。
粗皂素杂质主要由蛋白质、总多酚和游离碳水化合物组成,水和80%乙醇提取粗皂素杂质含量在18%~20%之间,无水乙醇提取粗皂素杂质含量为16%左右,说明无水乙醇提取粗皂素中所含杂质最少。不同溶剂提取粗皂素水溶液的CMC为0.5~1 g/L,其到达CMC的表面张力大小为无水乙醇<80%乙醇<水,无水乙醇提取粗皂素表面张力最低为33.0 mN/m,具有更好降低水溶液表面张力的能力。

