布洛芬对稀有鮈鲫早期生命阶段的急慢性毒性效应❋
谢 丹,王明丽,王秀海❋❋,胡 泓,李正炎,赵晓明,沈佳峰
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.山东省青岛生态环境监测中心,山东 青岛 266003)
药品的使用在治疗疾病、提高人类平均寿命的同时也可能给生态环境造成压力。中国作为世界上最大的药品和个人护理品(Pharmaceuticals and Personal Care Products,PPCPs)生产国和消费国,对PPCPs的使用非常广泛,其代谢产物进入水环境后,会给水生生物的生存带来威胁。布洛芬(Ibuprofen,IBU)为非甾体类抗炎药(Nonsteroidal anti-inflammatory drugs,NSAIDs),是一种不溶于水的白色结晶性粉末,其化学性质稳定、不易被降解,被广泛应用于镇痛、解热以及抗炎等临床治疗中。对非甾体类抗炎药使用情况的调查结果表明,IBU在全球被普遍使用,欧洲国家布洛芬和双氯芬酸的使用率最高[1],亚洲国家布洛芬、双氯芬酸、萘普生和乙酰水杨酸的使用率较高[2],且IBU已列为中国优先控制的药物[3]。布洛芬被摄入人体后,经肝、肾代谢,大部分随尿液及废水处理厂等的大量排放进入自然环境,加剧了水环境的污染程度。
随着IBU的广泛使用,水体中IBU含量已呈上升趋势。环境调查监测发现,英国、德国河流地表水IBU含量范围为0.008~2.38 μg/L;污水处理厂进水中IBU含量高于河流,英国和瑞士污水处理厂进水中IBU的平均含量分别为20.7和3.12 μg/L[4-5]。在47个国家的地表水、地下水、饮用水和污水处理厂进出水等各类水体的6 950个样品中检测到IBU,平均浓度为0.108 μg/L,其中西欧地区的最高检测浓度为303 μg/L[6]。对中国长江中、下游以及流域内四大淡水湖(洞庭、鄱阳、太和巢湖)范围内31个站点的检测中,仅在长江下游上海地区附近的2个河口站点检测到 IBU,这可能是由于上海及周边区域的废水排放导致IBU在河口区域富集,其平均和最高浓度分别为11.3和99.3 ng/L[7]。在华北黄河、海河、辽河所有地表水中(共37个站点)均检测到IBU,且在人口高密度地区、河流下游及汇合处检测频率较高,检测浓度范围为2.4~416 ng/L[8]。
由于IBU具有较高的生物活性,水生生物通过蓄积作用导致组织浓度增加,进而产生急、慢性毒性效应[9-10]。美国环保署也认为这类药物可能对生物繁殖存在风险,尤其对生物生命早期阶段更加敏感[11]。已有多项研究表明IBU对水生生物具有急性毒性效应,且其难降解的特性可能会对水生生物产生潜在的慢性毒性效应,特别是对富有经济价值的物种。调查显示,IBU会对鱼类等高营养级生物产生慢性毒性作用,具有较高的生态风险,且水生生物对药物中化合物的敏感性顺序为藻类 > 水蚤 > 鱼类[12]。
对布洛芬毒性效应的研究在国外最先开始,其中淡水物种占多数。生态毒理学研究表明,鱼类长期暴露在低浓度的IBU中,代谢酶等受到影响,从而引起肾脏毒性、免疫抑制作用等[13]。IBU还可作用于中枢神经系统[14],会对菲律宾蛤仔(Ruditapesphilippinarum)的基因转录产生影响,导致神经损伤,进而产生氧化应激反应[15]。此外IBU还可抑制小球藻(Chlorellavulgaris)生长[16]。商品化的IBU[17]和双氯芬酸[18]药物均可在鲤鱼(Cyprinuscarpio)的肝脏、皮肤和鳃等组织中富集,诱导其氧化应激[19]。IBU对斑马鱼(Daniorevio)不同组织的慢性毒性效应研究也得出了同样的结果,证实了其在鳃和肝脏中的富集程度最高[20]。长期的IBU暴露会延长鱼类产卵时间,可能会对鱼类受精、繁殖产生影响[21]。Gutiérrez-Noya等发现IBU在环境浓度下能够对鲤鱼产生胚胎毒性和致畸作用[6]。较高浓度的IBU对斑马鱼胚胎发育、孵化率及仔鱼的存活和行为活动等产生显著影响[22]。Li等在研究化合物药品萘普生对斑马鱼胚胎和仔鱼的急性毒性时,产生了孵化抑制、心率变缓和形态异常等中毒反应[23]。有研究得出IBU的致畸指数(TI)值为2.82,因而证实其为潜在致畸物质[24]。目前IBU对水生生物毒性效应研究相对较少,且局限于组织器官和基因组学等方面的研究,缺乏对水生生物宏观毒性效应的研究;而IBU的环境检测浓度通常在μg/L级别,不足以对稀有鮈鲫产生宏观毒性作用,难以评估IBU对水环境的生态风险。因此急需开展IBU宏观毒性效应研究,探究IBU的毒性作用大小,评估其对水生生物的潜在危害,为中国IBU水质基准的制定和生态风险评估提供参考依据。
本实验选用中国本土稀有鮈鲫(Gobiocyprisrarus)作为受试物种。稀有鮈鲫具有饲养方便、体型小、繁殖速度快、产卵量大等优势,可实现人工控温全年产卵,且胚胎透明易观察[25]。研究表明,稀有鮈鲫与国际标准化受试物种斑马鱼对同一污染物的敏感性相近,毒性结果具有良好的重现性[26],且胚胎对药物的敏感性高于仔鱼[20]。本实验参照文献[27]中的NO.236、NO.210、NO.212和文献[28],开展布洛芬对稀有鮈鲫的急、慢性毒性实验,从受精卵开始进行暴露,涵盖了生物早期生命阶段。
1 材料与方法
1.1 实验材料
本实验所用布洛芬(IBU,C13H18O2,纯度≥98%)产自上海麦克林生化科技有限公司。药品于实验当天用曝气除氯后的自来水配制成120 mg/L母液,以甲醇为助溶剂,在磁力搅拌器上搅拌溶解2 h。母液每3 d配置一次,实验时将母液加入曝气除氯后的自来水,依次稀释到所需质量浓度制成暴露溶液,暴露溶液中甲醇助溶剂终浓度最高为0.5%。上述所用试剂均为分析纯。
1.2 受试生物
稀有鮈鲫亲鱼购自中国科学院水生生物研究所(武汉)。以不高于1 g/L的密度暂养于本实验室30 cm×18 cm×20 cm(长×宽×高)的玻璃缸内(雌雄分开)。加热棒控温,温度保持在(25±1)℃,采用循环过滤装置,每5~6 d换2/3水(曝气除氯48 h并用紫外灯照射杀菌的自来水)。光照周期14 h∶10 h(昼∶夜),自然日光灯照射。保持恒定条件驯养7 d以上,每天换水前、后测定缸内溶液的溶解氧、pH、温度等参数,保持溶解氧含量大于饱和浓度的60%,pH在7.5~8.5之间。每日10:00和16:00按时饲喂红虫,每次喂食量以15~30 min吃完为准。
1.3 实验方法
1.3.1 鱼卵的收集 实验开始前一天下午将亲鱼分别置于产卵网中,用网隔离以防止亲鱼吞食鱼卵。用加热棒控温,并将水温从25 ℃缓慢升高1 ℃,稀有鮈鲫产卵一般在晚20:00左右,产卵后8 h内收集,将几个产卵网中的卵混合并随机选择用于实验。稀有鮈鲫卵直径为1.5 mm左右,采用内径4 mm的一次性移液管进行卵的转移,转移过程中避免受精卵接触空气。通过体视显微镜下观察来选择分裂期间无明显不规则或绒毛膜损伤的原肠期卵。
1.3.2 暴露实验 将正常的受精卵与未受精卵分离(记录受精率),将正常发育的卵转移至用恒温水浴锅(26±1)℃预热的标准24孔板中(每块板设20个暴露组,4个空白组。每孔1个卵,共24个卵),并在暴露实验前3 h内填充2 mL/孔的布洛芬溶液。胚胎孵化前每12 h更换90%的暴露液,孵化后每24 h更换一次暴露液,并及时剔除死亡的胚胎。每24 h记录一次观察结果,直到测试结束。在更新暴露液前后分别测量pH值,保持溶解氧浓度大于饱和度的80%,温度(26±1)℃。根据预实验结果,急性毒性试验共设置55、65.45、77.88、92.68、110.3 mg/L 5个IBU浓度梯度实验组,外加0.5%甲醇溶剂对照组和空白对照组。急性毒性实验测试周期为96 h。
慢性实验方法同急性实验,待仔鱼卵黄囊吸收完全,可以游动时,转移至结晶皿中进行后续暴露实验。每个结晶皿20条仔鱼,250 mL暴露液。每个浓度组设置3个平行,每24 h更换一次暴露液,每天喂食丰年虾虫卵一次。持续观察仔鱼行为特征并记录,及时捞出死亡的仔鱼(死亡标志为身体发白,不游动,用玻璃棒触动无反应)。慢性毒性实验设置5、8、12.8、20.48、32.77、52.43 mg/L 6个浓度梯度实验组,外加0.5%甲醇溶剂对照组和空白对照组。慢性毒性实验测试周期为21 d。
在更换暴露液之前对所有不同浓度的暴露液进行取样,用0.22 μm聚丙烯膜抽滤,采用高效液相色谱仪分析其浓度。
1.3.3 显微镜观察 对受试胚胎进行每天至少1次的显微镜观察:①48 h起记录所有暴露组和对照组的孵化率及孵化时间;②在24、48、72和96 h后记录尾巴未脱落的数量;③在24、48、72和96 h后记录凝结的胚胎数量;④在24、48、72和96 h后记录缺乏体节形成的胚胎数量(24 h后未形成体节可能是由于发育延迟所致。最迟在48 h后,应开始形成体节。如果没有,则认为胚胎已经死亡);⑤在48、72和96 h后记录无心跳(不规则心跳不记录为无心跳);⑥记录孵化后仔鱼的成活率;⑦记录其他畸形症状,如心包水肿、卵黄囊肿、脊柱和尾巴弯曲等。其中②~⑤为死亡标志[29]。
1.3.4 统计处理 急性实验:运用SPSS Statistics 25.0对稀有鮈鲫胚胎的孵化率、死亡率、畸形率和异常率进行概率回归分析,以浓度和各毒性效应终点的异常胚胎数目进行概率分析和卡方检验(p>0.15即存在显著性差异),确定其95%置信区间,估算96 h时布洛芬对稀有鮈鲫胚胎的急性毒性效应值,即半数效应或半数致死浓度(ECx或LCx)。
慢性实验:运用SPSS Statistics 25.0对稀有鮈鲫早期生命阶段的孵化率、死亡率、畸形率、异常率、全长、干质量和湿质量进行显著性检验。对3组平行比较均值,进行单因素ANOVA方差分析,运用Dunnett′s Test(1-Side,p<0.05)进行多重比较显著性检验,估算布洛芬对稀有鮈鲫早期生命阶段的孵化率、死亡率、畸形率、异常率、全长、干质量和湿质量的慢性毒性值无,即可见效应浓度(NOEC)和最低可见效应浓度(LOEC)。
2 结果与讨论
2.1 急性实验
2.1.1 结果分析 经卡方检验,各暴露组稀有鮈鲫胚胎的孵化率、死亡率、畸形率、异常率较空白对照组均存在显著性差异(p>0.15)。随IBU浓度的升高,稀有鮈鲫胚胎的孵化率持续降低,死亡率、畸形率和异常率均不断增高。高浓度组(≥77.88 mg/L)在24 h后已出现凝结死亡、畸形等中毒反应。最低浓度暴露组(55 mg/L)在48 h后出现畸形现象,60 h时出现凝结死亡现象,暴露过程中孵化率未受到影响,96 h时的孵化率为100%(见表1)。而浓度为65.45 mg/L时,稀有鮈鲫胚胎的孵化过程受到显著影响,孵化率随暴露浓度的升高逐渐降低;浓度为110.3 mg/L时,胚胎在96 h后均未孵化,数据拟合得出孵化率的96 h LC10为112.7 mg/L(见表2)。
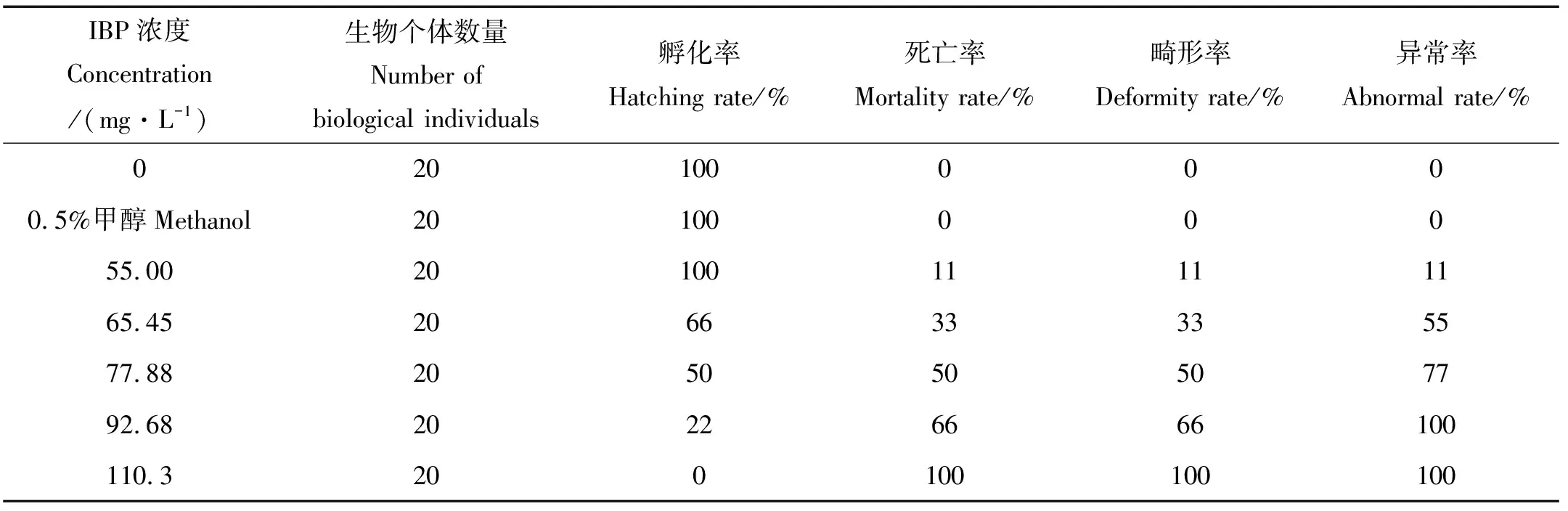
表1 布洛芬对稀有鮈鲫胚胎孵化率、死亡率、畸形率和异常率的影响

表2 布洛芬对稀有鮈鲫胚胎的急性毒性效应值
对于65.45 mg/L暴露组,24 h时出现尾部畸形状态,48 h时出现凝结死亡、脊柱弯曲和卵黄囊肿等中毒现象;77.88和92.68 mg/L暴露组于24 h时即出现凝结死亡现象;110.3 mg/L浓度下,96 h时所有受试胚胎全部死亡,并均伴随畸形。说明在此暴露浓度范围内,稀有鮈鲫胚胎的毒性效应与暴露浓度成正相关。数据拟合得出LC50和畸形率的EC50均为77.73 mg/L;在92.68 mg/L 暴露组中,96 h后所有受试胚胎均出现异常,采用SPSS进行数据拟合得出异常率的EC50为66.7 mg/L。表3列出了IBU 12 和24 h的实测浓度(更换暴露液前的旧溶液),回收率均在90%~100%之间,在名义浓度的±20%范围内,说明IBU具有良好的稳定性,可用配置的暴露液浓度作为最终浓度来计算毒性效应值。实验中空白对照和溶剂对照组的胚胎总存活率、孵化率均为100%,符合胚胎急性毒性实验要求。
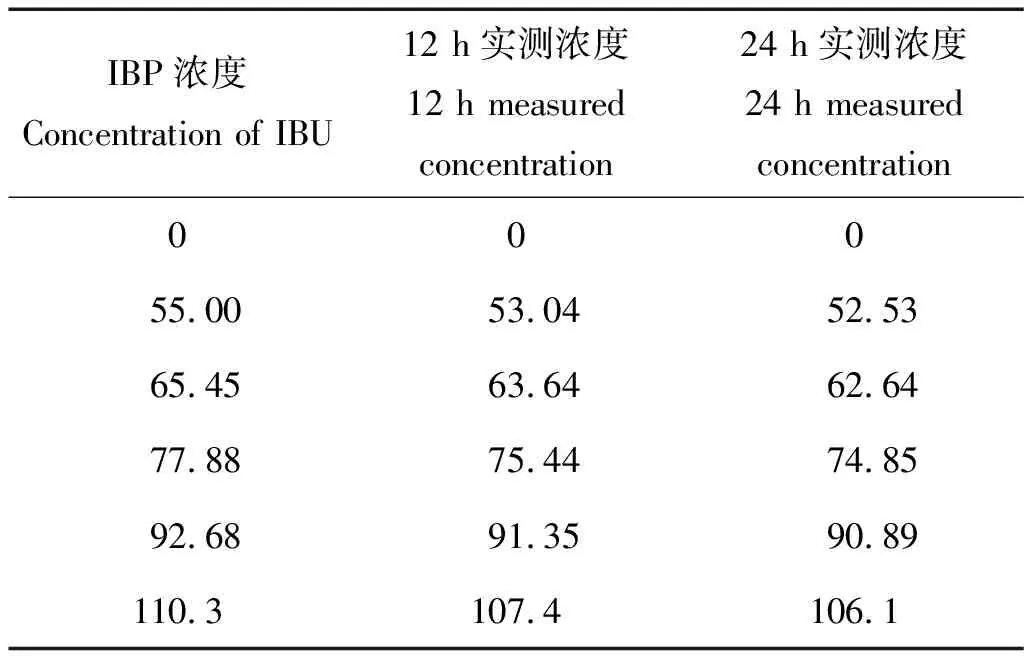
表3 各实验组中布洛芬的实测浓度
IBU对稀有鮈鲫胚胎的急性毒性作用主要表现在出膜时间延迟、孵化率降低、胚胎凝结死亡、尾巴未分离、缺乏体节形成、心脏凝结无心跳、心包水肿、卵黄囊肿、脊柱和尾巴弯曲、发育迟缓、出膜后体形小以及胸鳍、尾鳍和口部等组织发育异常等(见图1)。其中心包水肿最为普遍,且在急性实验期间,各暴露组所有胚胎在96 h后均产生了不同程度的异常现象。急性实验过程中观察到胚胎存在心跳抽动的未计入死亡数。IBU对胚胎死亡的96 h半数致死浓度在10~100 mg/L范围内(见表2),参照水生生物急性毒性分级为B级,属于低毒类化学品。
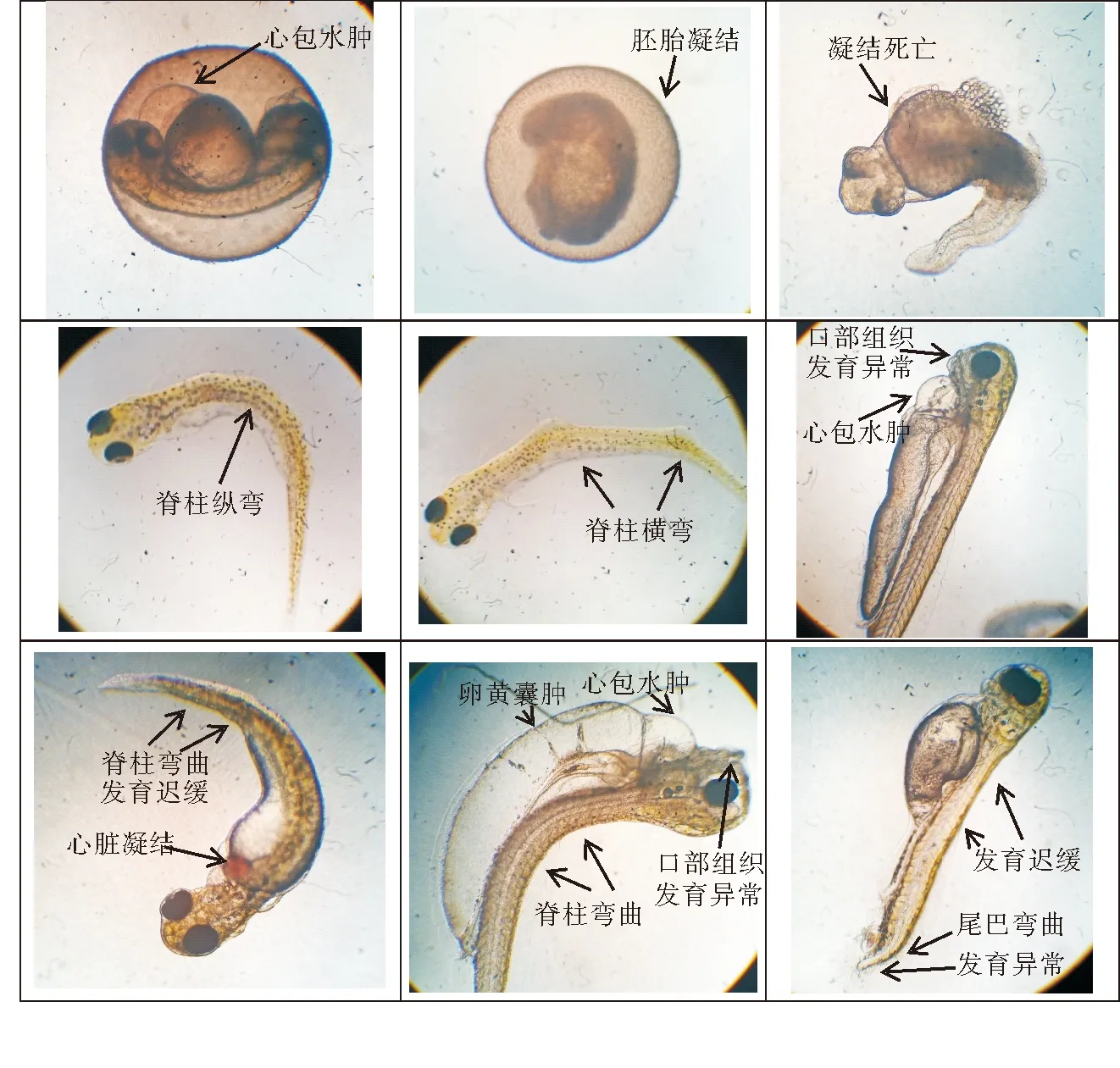
(心包水肿 Pericardial edema;胚胎凝结 Embryo coagulation;凝结死亡 Condensation death;脊柱纵弯 Spine vertical bend;脊柱横弯 Spine bending;口部组织发育异常 Dysplasia of oral tissue;脊柱弯曲 Spinal curvature;发育迟缓 Developmental retardation;心脏凝结 Cardiac coagulation;卵黄囊肿 Yolk cyst;尾巴弯曲。)
2.2 慢性实验
2.2.1 结果分析 布洛芬对稀有鮈鲫慢性毒性实验结果见表4、5。慢性实验中IBU各暴露组对稀有鮈鲫胚胎的孵化率无明显影响,孵化率均为100%,当浓度大于32.77 mg/L时,出膜时间出现延迟。

表4 布洛芬对稀有鮈鲫孵化率、死亡率、畸形率、异常率、全长和干、湿质量的影响
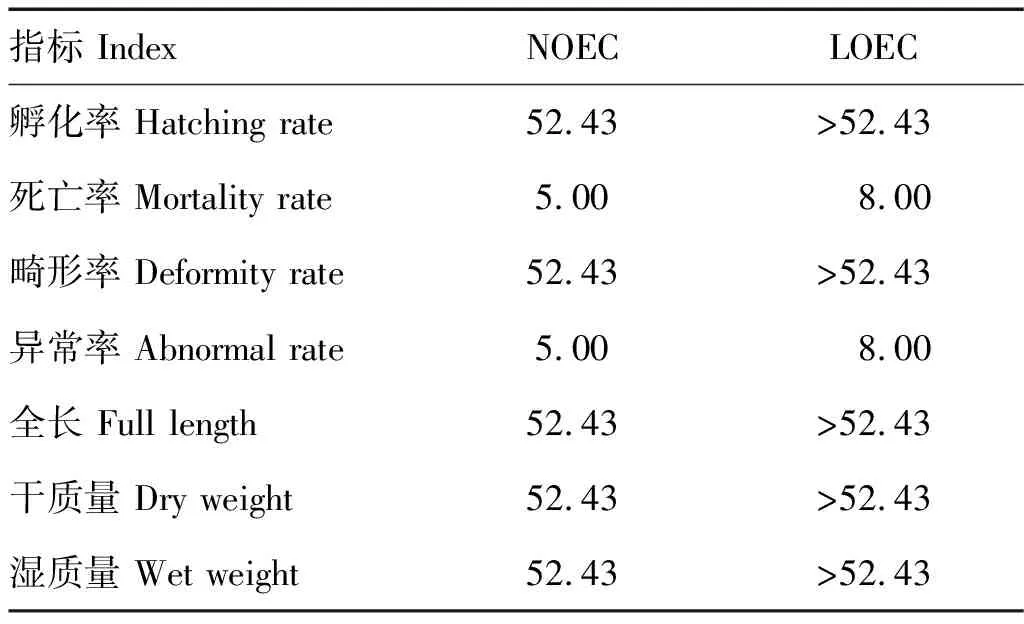
表5 布洛芬对稀有鮈鲫的慢性毒性效应值
5 mg/L暴露组死亡数量较对照组无显著差异(p>0.05)。当IBU浓度达到8 mg/L时,毒性作用显著增强,稀有鮈鲫的死亡数和异常数较其他暴露组明显增加。暴露第7天观察到异常稀有鮈鲫仔鱼心包处凝结发红,且伴随游动不协调现象。一旦出现游动不协调或不游动及不进食等异常现象的仔鱼,在1~2 d后均死亡。运用SPSS进行数据拟合得出死亡率的NOEC为5 mg/L,LOEC为8 mg/L。
从异常率来看,IBU浓度达到8 mg/L时,稀有鮈鲫异常数目相比空白对照和5 mg/L浓度组存在明显差异,异常率的NOEC和LOEC分别为5和8 mg/L。对稀有鮈鲫的全长和干、湿质量数据的检验分析结果显示IBU浓度在0到52.43 mg/L范围内无显著性差异,表明此浓度范围内IBU对稀有鮈鲫的全长和干、湿质量无明显毒性作用,其毒性效应值NOEC均为52.43 mg/L,LOEC均大于52.43 mg/L。分别在7 和14 d对各浓度组取样,测定24 h的IBU实际浓度(更换暴露液前的旧溶液),结果显示回收率均在110%~120%之间,保持在名义浓度的-20%~20%之内,因此可用配置的暴露液浓度作为最终浓度来计算毒性效应值。
IBU对稀有鮈鲫早期生命阶段的毒性作用主要表现在胚胎的凝结死亡、心包水肿、卵黄囊肿等和仔鱼的存活、发育迟缓、组织发育异常、脊弯、尾弯以及行为异常等(见图1)[30]。其中行为异常发生率最高,主要表现有不游动或游动不敏捷、不协调,鱼体侧翻、沉在缸底,呼吸困难,不进食或身体发白等。慢性实验中鮈鲫的死亡现象均发生在孵化出膜之后。
2.3 稀有鮈鲫各发育时期及形态特征
表6列出了稀有鮈鲫各发育时期及形态特征,包含卵裂期、囊胚期、原肠期、分裂期、成形期和孵化期,与斑马鱼相似[31-32]。稀有鮈鲫胚胎透明,受精卵具有黏性、能沉底、吸水膨胀,因此易观察,而未受精的卵呈乳白色。受精卵孵化温度一般在20~30 ℃范围内,随温度升高而缩短,表6为各个发育时期均为孵化温度((26±1)℃)的时间和形态特征。图2展示了稀有鮈鲫正常发育各个时期的显微镜观察照片。

表6 稀有鮈鲫各发育时期及形态特征

图2 稀有鮈鲫胚胎正常发育各时期图
3 讨论
3.1 急性毒性效应
急性实验结果显示,IBU对稀有鮈鲫胚胎死亡率的LC50为77.73 mg/L,与畸形率(77.73 mg/L)、异常率(66.70 mg/L)的毒性效应值相差不大。在高浓度作用下胚胎从产生畸形、心包水肿和卵黄囊肿等毒性效应到发生死亡凝结的时间间隔较小,死亡浓度范围较窄,说明在高浓度作用下稀有鮈鲫胚胎中毒作用快且明显。同样将大型蚤(Daphniamagna)暴露在高浓度IBU(200 mg/L)中,结果显示死亡均发生在暴露24 h后[33],浓度大于10 mg/L时大型蚤繁殖率降低,低于40 mg/L时不引起死亡,但高于80 mg/L时无存活。研究表明,IBU在低浓度下会对斑马鱼胚胎及仔鱼产生心脏毒性,对心脏结构和发育产生影响[36],EC50为2.496 mg/L。
暴露于IBU的斑马鱼胚胎同样产生了孵化率降低、发育迟缓、组织器官畸形、色素减退、心包水肿、胚胎死亡率升高及氧化损伤等毒性效应[22, 24]。IBU作为一种丙酸衍生物[37],又称非选择性抑制剂[22],能对环氧化酶(COX)产生抑制作用;而COX是胚胎发育过程中一种重要的酶[38]。IBU通过抑制COX-1和COX-2系统来抑制前列腺素(PG)的合成[39-40]前列腺素(PG)在生殖、维持心血管系统稳定以及组织器官形成中发挥重要作用[41]。IBU通过对COX-1的抑制,破坏心血管内环境稳定,导致胚胎心率异常、形成心包水肿,从而压迫心脏,造成心脏损伤等[42],最终导致胚胎发育迟缓、组织器官畸形等毒性效应[36]。这也是心包水肿在本研究中普遍产生的原因。
细胞色素P450酶(CYP)是与药物代谢相关的酶,IBU的致畸作用可能是由于其和多种CYP作用,发生了生物转化[43-44],使代谢产物具有更高的毒性[45]。本实验中随IBU浓度的升高,稀有鮈鲫胚胎的孵化率持续降低,这与Sánchez-Aceves等[24]和Xia等[46]的研究结果一致,可能是由于IBU的作用导致蛋白酶活性受到抑制、改变了绒毛膜的渗透性,使内部耗氧量增加致使自发运动减少,最终对发育过程产生影响,如尾巴不能正常脱落而导致胚胎死亡及孵化延迟等[47-49]。稀有鮈鲫的多种中毒现象表明,IBU会对稀有鮈鲫胚胎的孵化及组织器官、神经系统的发育产生影响,对其生存构成威胁。
3.2 慢性毒性效应
慢性实验中,低浓度组对稀有鮈鲫胚胎的孵化率、仔鱼的全长和干、湿质量均未产生明显毒性作用。当IBU浓度达到8 mg/L时,仔鱼形态异常的数量相较空白对照显著性差异,暴露期间仔鱼出现不游动、不进食和身体翻转等现象,1~2 d内均死亡。表明长期的IBU暴露会对稀有鮈鲫的心脏、脑和骨骼等组织发育及代谢等生理活动产生影响,出现氧化应激反应。有研究表明,较高浓度的IBU(1 000 μg/L)可通过改变生物标记物来降低菲律宾蛤仔的免疫力,最终导致氧化应激反应[50];暴露于较高浓度IBU的斑马鱼仔鱼同样出现了不游动或游动显著减少的现象,且相较双氯芬酸而言,IBU的毒性作用更为缓慢且持久[46]。
IBU直接作用于COX-1和COX-2系统,抑制环氧化酶,导致胚胎自发运动减少、孵化延迟和骨骼发育缺陷等,可能是稀有鮈鲫产生畸形和不游动的原因,且IBU是通过作用于人的中枢神经系统来达到止痛的目的[51],因此能够证明其具有潜在神经毒性[46]。对斑马鱼的基因测试也证实了这一点,基因表达的减少导致脑损伤,进而表现为行为异常等毒性效应[46]。鱼类暴露于IBU中导致其氧化还原系统发生变化,蛋白等被代谢为有毒物质,进而产生胚胎毒性,导致仔鱼严重畸形等[52]。
多项研究表明IBU可在鱼类肝脏和鳃等组织中富集[17, 20],并且由于其特殊的药物特性和作用机制,使其对水生生物的毒性效应缓慢且持久,长期的低浓度暴露引发氧化应激反应[19];这也表明IBU在组织器官中的蓄积作用可能是导致稀有鮈鲫产生宏观慢性毒性效应的原因。IBU对蜗牛(Planorbiscarinatus)的21 d毒理学实验结果显示,存活率的LOEC和NOEC分别为45.36和5.36 mg/L,孵化率的LOEC和NOEC分别为5.36和2.43 mg/L[53],与本实验毒性效应值相近;而IBU对斑马鱼DNA的慢性毒性效应值为66.4 ng/L[54],慢性毒性效应值相差较大。因此,IBU对水生生物的宏观和基因组学毒性效应之间的差异和联系还需进一步研究。通过本实验发现,稀有鮈鲫胚胎及仔鱼均展现了良好的生物学特性,其毒理学特征与斑马鱼具有很大程度的相似性,展现了良好的适用性,可作为毒理学实验的模式生物。且中国尚未开展布洛芬水质基准的研究与制定,本实验得出的IBU急、慢性毒性效应值可为今后IBU的基准制定提供依据。
3.3 展望
由于布洛芬具有化学稳定性,其在水环境中不易被降解,长时间的暴露对生物各个组织器官具有潜在危害,需进一步开展布洛芬对稀有鮈鲫早期生命阶段的组织器官和基因组学等方面毒性效应的研究,并与宏观毒性效应进行对比分析。另外,水环境中通常有多种污染物共同存在,混合物对水生生物的毒性作用与机制还有待研究。本研究中IBU的暴露浓度高于水环境中的检测浓度,对此,今后将进一步研究环境相关浓度下IBU对稀有鮈鲫胚胎的潜在毒性效应。
4 结论
(1)一定浓度的布洛芬暴露下,稀有鮈鲫胚胎及仔鱼均呈现不同程度的毒性效应,包括孵化率降低、凝结死亡、心包水肿、卵黄囊肿、脊柱和尾巴弯曲、发育迟缓、组织发育异常和行为异常等。其中:心包水肿在急性毒性实验中最普遍;行为异常在慢性实验中发生率最高。
(2)急性实验中,稀有鮈鲫的毒性效应贯穿胚胎发育全过程;慢性实验中,低浓度对胚胎发育、孵化率和畸形率无效应,但对孵化后的仔鱼具有毒性效应,多表现为行为异常。
(3)稀有鮈鲫胚胎透明、易观察、对污染物暴露敏感,可作为生态毒理学研究的潜在模式生物。
(4)水生生物对IBU存在生物蓄积作用,通过长期的暴露会对水生生物的生存和繁殖产生危害,应加强IBU慢性毒性效应的研究;另外,污水处理厂的进出水、河口及河流交汇处的IBU浓度高,具有较高的生态风险,应予以广泛的关注。

